INTRODUCCION
La fasciolosis es una parasitosis de importancia veterinaria y humana, causada por la ingesta de agua o alimentos contaminados con la metacercaria del trematodo Fasciola hepatica (Huson et al., 2017; Zaraei et al., 2019). Por otro lado, la paramphistomosis se ha asociado con una significativa morbilidad y severos trastornos patológicos, causada principalmente por la actividad de trematodos juveniles en el intestino y abomaso del hospedador final, el rumiante (Zintl et al., 2014; Giraldo et al., 2016). Las formas adultas provocan el engrosamiento de la mucosa y submucosa del rumen y retículo, propiciando la baja digestión y absorción de nutrientes esenciales para la producción (Bowman, 2014). Fasciola hepatica, por otro lado, ocasiona problemas metabólicos al alterar el funcionamiento adecuado del hígado en toda su estructura y en la producción de diversas enzimas o compuestos digestivos como la bilis (Valderrama, 2016).
Ambos trematodos están globalmente distribuidos (Saijuntha et al., 2018). Comparten el mismo hospedador intermediario, moluscos pulmonados de agua dulce que pertenecen a la familia Lymnaeidae (Dinnik, 1962; Mahulu et al., 2019), de modo que las coinfecciones son posibles, tanto en el hospedador intermedio como en el hospedador final (Jones et al., 2015). Esta situación está asociada a factores ambientales que favorecen su ciclo biológico, tales como los tipos de suelo, precipitación pluvial, zonas de vida, biotemperatura, cinturones altitudinales y elevación, situación que se encuentra en las áreas de pastoreo y en cuerpos de agua dulce abiertos utilizados para fines domésticos y agrícolas (Jiménez-Rocha, 2017; Isah, 2019).
Cajamarca es una región que cuenta con condiciones ambientales óptimas para el desarrollo de hospedadores intermediarios y parásitos que afectan a los animales domésticos, donde se ha identificado a Fasciola hepatica (Claxton et al., 1998) y a Calicophoron microbothrioides (Manrique et al., 2013). La crianza extensiva al pastoreo predispone la infección del ganado con diversos tipos de parásitos, siendo los más importantes aquellos que afectan el rumen e hígado de los rumiantes. Por tal motivo, el presente estudio se realizó con el fin de determinar la prevalencia de F. hepatica y C. microbothrioides en ganado vacuno criado al pastoreo de seis distritos de la región Cajamarca, y la posible asociación con la altitud, situación poco conocida por la falta de estudios publicados.
MATERIALES Y MÉTODOS
Se llevó a cabo en los distritos Caja-marca, Los Baños del Inca, La Encañada, Celendín, San Juan y Chota. El procesamiento y análisis de las muestras fecales se realizó en el Laboratorio de Parasitología Veterinaria y Enfermedades Parasitarias de la Facultad de Ciencias Veterinarias (LPV-FCV), Universidad Nacional de Cajamarca.
El número de muestras "n" por distrito fue calculado con relación a los antecedentes parasitarios y en aquellos donde no había antecedentes se calculó una proporción del 50% a un intervalo de confianza del 95% y error de 5%. De esta manera, se determinó la cantidad de muestras requeridas para el distrito de Cajamarca (n = 380), Los Baños del Inca (n = 296), La Encañada (n = 352), Celendín (n = 377), San Juan (n = 380) y Chota (n = 384). Dado que Cajamarca es una importante cuenca lechera del Perú, los criterios para la selección de los predios fueron en base a la comunicación directa con los propietarios inmersos en la ganadería láctea; asimismo, que dispongan de vacunos mayores a un año de edad, que no hayan sido dosificados con trematocidas en los últimos tres meses y que su principal alimentación sea a base de pastos y forrajes frescos. Además, en la visita a cada fundo se registraron las coordenadas geográficas para posteriormente obtener la altitud haciendo uso del sistema de información Google Earth v. 7.3.3.
Para que haya una mayor probabilidad de detectar animales infectados naturalmente, los muestreos se realizaron entre los meses de julio y agosto de 2017, correspondientes a la época de estiaje. Las muestras de heces fueron recolectadas en horas de la mañana (06:00 - 07:00 h), directamente del recto de los animales (aprox. 100 g). Las muestras, en bolsas de polietileno rotuladas fueron colocadas en cajas de poliestireno expandido con geles refrigerantes y se transportaron de inmediato al LPV-FCV, para los respectivos análisis coproparasitológicos. Las muestras fueron colectadas únicamente de animales mayores a un año y que no hayan sido dosificados con ningún antiparasitario durante al menos tres meses previos al muestreo.
Las muestras se procesaron usando el método de sedimentación rápida de Lumbreras (Lumbreras et al., 1962) y el diagnóstico de la presencia/ausencia de huevos de F. hepatica y C. microbothrioides se realizó leyendo los sedimentos en placas Petri, empleando un estereomicroscopio con aumentos de 3 y 4X (Figura 2). La diferenciación de género -especie se dio con base a las características morfocromáticas detalladas por Zajac y Conboy (2012), traspasándose los huevos presuntamente distintos entre sí a una lámina portaobjetos para su observación con microscopio binocular convencional a 10 y 40X. Se hizo uso de estadística descriptiva, de la prueba de Chi cuadrado y de la correlación de Pearson para el análisis de las variables en cuestión.
RESULTADOS
En todos los distritos se encontraron huevos de Fasciola hepatica en las muestras de heces, mientras que Calicophoron microbothrioides se encontró en todos con excepción de un distrito. El distrito de La Encañada presentó el mayor número de casos de fasciolosis (n = 221) y Cajamarca el menor número de animales positivos (n = 58). En lo que respecta a paramphistomosis, Cajamarca presentó 130 animales positivos en la coproparasitología; sin embargo, Los Baños del Inca tuvo la prevalencia más alta (38.5%), en tanto que San Juan solo presentó 22 casos y Chota ninguno (Figura 1, Cuadro 1). La coinfección por ambos parásitos fue mayor en el distrito de Cajamarca (15.8%) y nula en el distrito de Chota.
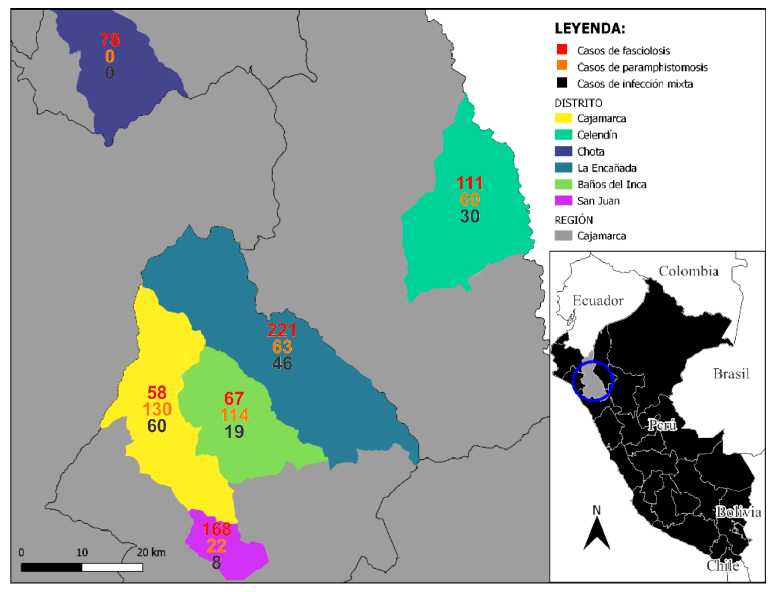
Figura 1. Mapa de la zona del estudio mostrando el número de vacunos infectados por distrito y caserío
No se halló asociación estadística en la presentación de un parásito y su coexistencia con el otro en un mismo animal (p>0.05). Por otro lado, la altitud no presentó correlación estadística con la mayor presencia de animales positivos a huevos fecales de parásitos (Pearson, r=0.19).
La detección de los huevos de ambos trematodos fue bastante efectiva, los caracteres morfocromáticos son claramente distinguibles y esto permitió establecer el género que se estaba observando (Figura 2).
DISCUSIÓN
Los animales presentaron huevos de F. hepatica y C. microbothrioides en todos los distritos, aunque este último no fue observado en Chota (Cuadro 1). Aun así, las coinfecciones reportadas en este estudio no fueron significativas.
La prevalencia de estos parásitos con relación a la altitud no fue significativa debido a que el rango ecológico en donde se distribuyen es demasiado amplio y variable. Se han reportado en Perú formas infectivas de F. hepatica en los hospedadores intermediarios por debajo de los 400 msnm (Vignoles et al., 2017; Silva et al., 2020) y hasta los 4500 msnm (Londoñe et al., 2009). Asimismo, paramphistomidos (C. microbothrioides) pueden encontrarse por debajo de los 200 msnm y también en zonas montañosas sobre los 3000 msnm donde existe disponibilidad de agua estancada para el ciclo de los hospedadores intermediarios (Cerda et al., 2019).
En Cajamarca se ha reportado C. microbothrioides en ovinos procedentes de lugares ubicados entre 2250 y 3620 msnm (Torrel-Pajares et al., 2022); sin embargo, debido a que ambos parásitos comparten los mismos hospedadores intermediarios, se puede inferir que los paramphistomidos pueden ubicarse en las mismas altitudes afectando a la población de vacunos. No obstante, este parásito aún no se distribuye a toda la región de Cajamarca por el poco tráfico animal desde la capital a los distritos y se considera una parasitosis emergente en el departamento (Torrel et al., 2014).
Esto se sustenta en los resultados obtenidos, ya que en el presente estudio se halló una menor frecuencia de positivos en los lugares más alejados del valle de Cajamarca, siendo Chota el distrito con menor prevalencia de animales positivos (20.3±4.0%), en comparación a los distritos más cercanos a Cajamarca como Los Baños del Inca (61.2±5.6%) y La Encañada (80.7±4.1%). Incluso, la presencia de paramphistomidos fue mayor a F. hepatica en los distritos de Cajamarca (34.2±4.8% vs. 15.3±3.6%) y Los Baños del Inca (38.5±5.5% vs. 22.6±4.8%), a diferencia del Chota, donde no se encontraron huevos de paramphistomidos.
En un estudio realizado con 377 vacunos lecheros procedentes de 150 predios ubicados en el valle cajamarquino, y con el mismo método diagnóstico se hallaron paramphistomidos (59.5%), Fasciola hepatica (43.5%) y un 26.4% de asociación entre ambos parásitos (Torrel et al., 2014), valores muy superiores a los hallados en el presente estudio (Cuadro 1). Esta disminución en el curso de los años posiblemente se deba al uso masivo de antiparasitarios y calendarios sanitarios con desparasitaciones trimestrales (Datos no publicados). En otras regiones como en la provincia de Oxapampa (Pasco-Perú), mediante sedimentación rápida, de 408 muestras de ganado lechero, se halló una prevalencia del 10.0±2.9% para Fasciola hepatica y 28.4±4.4% para paramphistomidos, sin asociación entre ambos parásitos (Paucar et al., 2010). Esta falta de asociación estadística podría deberse a una posible competencia interna de estos trematodos en los hospedadores intermediarios.
Los paramphistomidos se encuentran poco difundidos en el país, habiendo reportado en las regiones tropicales (Pinedo et al., 2010; Rojas et al., 2015; Cueva-Rodríguez et al., 2022). No obstante, se puede asumir que con el tiempo se diseminarán a más lugares, ya que no se cuentan con normas veterinarias estrictas en el transporte del ganado; además, otros fenómenos como el transporte interno e importación de ganado infectado, sumado al cambio climático que contribuye a la distribución de los parásitos en un territorio donde el hospedador intermediario haya logrado su adaptación (Jones et al., 2015), tal como ha sucedido con Fasciola hepatica en Perú (Claxton et al., 1998). En este sentido, en Colombia se ha descrito a Cotylophoron cotylophorum (Alarcón y Velásquez, 2009) y Cotylophoron panamensis (López y Velásquez, 2012), en Brazil a Cotylophoron marajoensis n. sp. (Amaral et al., 2020) y en Chile a Calicophoron microbothrioides (Cerda et al., 2019).
CONCLUSIONES
La prevalencia de trematodos hepáticos y ruminales en ganado vacuno lechero de crianza extensiva en seis distritos de Cajamarca, Perú, es moderada, con mayor presencia de Fasciola hepatica, seguido de Calicophoron microbothrioides, pero sin coexistencia significativa entre ambos (X², p>0.095). La altitud sobre el nivel del mar de los distritos no fue un factor concluyente asociado a la presencia de presencia de huevos fecales en los animales (r<0.70).












 uBio
uBio