INTRODUCCIÓN
El crecimiento esperado de la demanda mundial de alimentos de origen animal para el año 2050 (Keating et al., 2014) y la necesidad de potenciar la producción animal para satisfacerla requieren métodos efectivos para la eliminación de sus residuos. La producción avícola es uno de los sectores productores de alimentos de rápido crecimiento, por lo que es necesario conocer el riesgo asociado a los residuos. La carga microbiana en el estiércol de las aves de corral, incluidos los coliformes totales y fecales, Escherichia coli y Salmonella spp, se encuentran entre los patógenos más preocupantes en relación con la producción avícola (Shepherd et al., 2009), mientras que E. coli, aunque sea comensal, podría constituir otro problema importante desde un punto de vista ambiental y sanitario.
Entre las principales causas de enfermedades bacterianas se encuentran las causadas por Salmonella y E. coli (Puig et al., 2013), que son dos de los cinco tipos de bacterias más frecuentes causantes de enfermedades transmitida por productos avícolas (Vásquez-Ampuero y Tasayco-Alcántara, 2020). Se estima que, en los países desarrollados, la salmonelosis afecta a unos 93.8 millones de personas y que el 85% de esos casos se transmiten por los alimentos (Majowicz et al., 2010).
Las bacterias del género Salmonella producen infecciones asintomáticas en las aves de corral, facilitando la propagación del patógeno dentro de la parvada, aunque también producen manifestaciones clínicas que pueden traer altos niveles de mortalidad (Cardoso et al., 2018). Existen más de 2500 serotipos, de los cuales Salmonella Enteritidis y Salmonella Tiphymurium son los más importantes para la salud pública (Saleh et al., 2019). Los residuos avícolas generados en las unidades de producción podrían considerarse contaminantes e incluyen la gallinaza, la yacija, los materiales de cama (Wilkinson et al., 2011; Avidov et al., 2021), y los derivados del procesamiento de los animales, como las plumas (Wang et al., 2018). La yacija es uno de los principales residuos que deben ser tratados de forma eficiente, ya que contiene estiércol que constituye una fuente importante de patógenos (Mantha et al., 2017; Moffo et al., 2018). Por estas razones, es esencial disponer de métodos adecuados y eficaces para lograr la inactivación de estos patógenos.
El proceso de compostaje en pilas estáticas al aire libre para la inactivación de la carga microbiana patógena, incluyendo coliformes totales, coliformes fecales, E. coli y Salmonella spp ha sido propuesto como el método más económico y rápido que, además, produce un fertilizante natural (Singh et al., 2012). Las altas temperaturas y la relación carbono/nitrógeno (C/N) son variables que han demostrado ser eficaces en la reducción y desaparición de patógenos durante el proceso de compostaje (Erickson et al., 2015; Thomas et al., 2020).
Salmonella y E. coli se inactivan a temperaturas superiores a 55 °C (Isobaev et al., 2014) que podrían alcanzarse durante el proceso de compostaje. Sin embargo, existen pocos estudios que determinen los umbrales y tiempos de inactivación de estos microorganismos. Ejemplos de estos son los realizados por Barrena et al., (2009) que encontraron Salmonella spp en compost, incluso cuando se registraron temperaturas entre 68 y 70 °C, así como E. coli a temperaturas superiores a 55 °C tras 84 días de compostaje (Patel et al., 2015). Teniendo en cuenta estas observaciones, el objetivo de este estudio fue generar conocimientos sobre los umbrales de temperatura y los tiempos de inactivación de coliformes, coliformes fecales, E. coli y Salmonella spp durante el proceso de transformación de los residuos de producción avícola a través del compostaje.
MATERIALES Y MÉTODOS
Área de Estudio
El experimento se realizó en condiciones de campo en el Centro de Investigaciones Biológicas del Noroeste S.C. (CIBNOR), ubicado en las afueras de la ciudad de La Paz en Baja California Sur, al noroeste del Estado de México (Batista et al., 2017). La temperatura media anual en la zona es de 22 °C y la precipitación media anual de 200 mm. El estudio se realizó bajo condiciones controladas de temperatura y humedad y sobre una superficie impermeable.
Diseño Experimental
Se evaluaron dos tratamientos a través de un diseño completamente aleatorizado con ajuste factorial, donde el factor de variación fue la relación Carbono / Nitrógeno (C/N), con dos niveles de C/N (C/N 25, C/N 35) a fin de lograr diferencias en las temperaturas máximas alcanzadas en las pilas de compost estáticas al aire libre y detectar la inactivación de patógenos en cada tratamiento.
El tratamiento C/N 25 estuvo compuesto por 25.31, 40.42 y 34.27% de paja de frijol, forraje de sorgo y estiércol seco, respectivamente, y el tratamiento C/N 35 por 44.61, 12.90 y 42.50% de paja de frijol, forraje fresco de sorgo y estiércol seco, respectivamente. Estos materiales fueron procedentes de la cría de pollos de engorde en una granja semirústica. Tras mezclar y homogeneizar manualmente todos los residuos orgánicos, se establecieron pilas estáticas de compost al aire libre de 170 x 50 cm y 170 x 80 cm y de 1 m3 cada una.
Se estudiaron tres pilas estáticas de compost al aire libre por tratamiento y tres réplicas durante la fase termofílica sin volteo. El contenido de humedad de la pila de compost fue de 60%, la que se alcanzó al principio y no fue necesario añadir agua a las pilas durante el experimento. La temperatura interna de las pilas se controló mediante un sistema automatizado a través de sensores (De Anda-Trasviña et al., 2022). Los datos se registraron cada hora diariamente durante el experimento. El sistema de sensores se colocó en el interior de las pilas, uno en la parte inferior (cerca del suelo), otro en la parte media y otro en la superficie.
Experimento 1. Carga Microbiana
La carga microbiana se determinó para cada tratamiento al inicio y a los 12 días del proceso de compostaje, que es cuando finalizaba la etapa termófila. Se tomaron tres muestras (100 g) de la mezcla inicial del material a compostar por tratamiento y se remitieron al laboratorio de microbiología del CIBNOR. El análisis se realizó mediante metodologías estandarizadas para la determinación de mesófilos (Ballesteros et al., 2018), así como mediante procedimientos internos de laboratorio según las normas NOM-092-SSA1-1994 y NOM-114-SSA1-1994 para Coliformes y para Salmonella spp.
Experimento 2. Inactivación de Patógenos
Se utilizaron inóculos de E. coli y S. enterica Typhimurium de cepas existentes en el laboratorio de microbiología del CIBNOR, que se ajustaron a una densidad óptica de 1 y longitud de onda de 540 nm. Los microorganismos fueron inoculados en una solución de 10 ml de caldo de lactosa a una concentración de 1 x 106 y 1.270 x 109 unidades formadoras de colonias (UFC/ml) (Thomas et al., 2020), respectivamente, a razón de tres tubos de vidrio con un diámetro interno de 15 mm y externo de 16 mm por pila. Estos tubos se ubicaron dentro de cada pila, en la parte interna baja, media y alta, a una distancia de 30 cm de la superficie externa, para determinar el efecto de la temperatura en cada nivel. Los tubos fueron extraídos de las pilas de compost a las 72 h y el recuento de patógenos se realizó en placas con agar tripticasa de soja mediante el procedimiento descrito por Isobaev et al. (2014). Los resultados de la inactivación se expresaron en porcentajes, donde las UFC/ml inoculadas al inicio representaron el 100%.
Experimento 3. Inactivación de S. enterica Typhimurium
Este experimento se llevó a cabo utilizando la metodología descrita en el Experimento 2, pero solo para S. Typhimurium, donde la evaluación de inactivación se desarrolló a tres tiempos (72, 96 y 120 h). Además, se colocó una muestra de control fuera de la pila, a temperatura ambiente para evaluar la resistencia de la cepa y determinar si la inactivación observada en el experimento se debía a las temperaturas alcanzadas dentro de las pilas de compost y no a los efectos del medio de cultivo utilizado para las cepas.
Análisis Estadístico
El análisis de los datos se realizó con un análisis de varianza simple utilizando el software Statistica (Statsoft) v.10.0 (2011). Los principales efectos e interacciones se evaluaron mediante pruebas de homogeneidad de la varianza de Tukey con un nivel de significación de p=0.05.
RESULTADOS
En el Experimento 1 se obtuvo una disminución de la carga microbiana (Salmonella spp) por efecto del compost (Cuadro 1; p<0.000), pero sin diferencias significativas entre tratamientos.
Cuadro 1. Carga microbiana al inicio (día 0) y al final (día 12) del proceso de compostaje de materiales de paja de frijol, forraje de sorgo y estiércol seco de ave medidos en tres niveles de las pilas de compostaje durante el Experimento 1
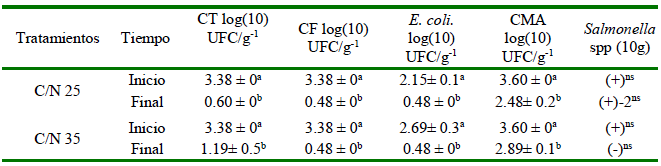
Los resultados se expresan como media ± error estándar
a,b Letras distintas en la misma columna indican diferencias significativas entre los tiempos de evaluación (prueba de Tukey, p<0.05)
CT: Coliformes totales; CF: Coliformes fecales; CMA: Recuento de bacterias mesófilas aerobias; (+) presente; (-) ausente
ns No significativo (p>0.05)
El tratamiento C/N 35 fue el que mostró mayor inactivación de patógenos determinada durante la fase termofílica del proceso, donde se confirma la eficacia del tratamiento en la inactivación de microorganismos al no detectar Salmonella spp. El tratamiento C/N 25 mostró la temperatura media más baja (54.68 ± 1.09 °C) en comparación con el tratamiento C/N 35 (58.75 ± 0.89 °C) (p<0.0002; Cuadro 2). Además, la temperatura entre los niveles de las pilas fue significativamente diferente (p<0.000), lo que refleja que la temperatura dentro de la pila no era homogénea. Es importante indicar que si bien, el proceso de volteo genera incrementos de temperatura, no se estudió esta variable para evitar la dispersión de microorganismos durante la manipulación.
Cuadro 2. Temperatura en tres niveles de las pilas de compostaje de materiales paja de frijol, forraje de sorgo y estiércol seco de ave con dos proporciones de C/N a los 12 días de iniciado el proceso, correspondientes al Experimento 1
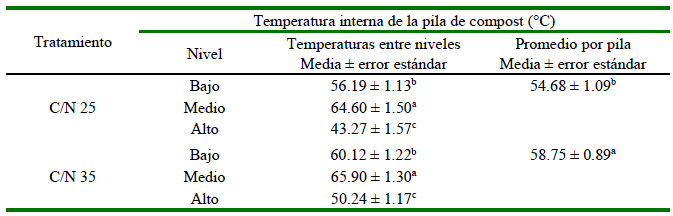
C/N 25 compuesto por 25.31, 40.42 y 34.27% de paja de frijol, forraje de sorgo y estiércol seco
C/N 35 compuesto por 44.61, 12.90 y 42.50% de paja de frijol, forraje fresco de sorgo y estiércol seco
a,b Letras distintas en la misma columna indican diferencias significativas entre tratamientos y niveles (prueba de Tukey, p<0.05)
En el Experimento 2, no hubo diferencias significativas entre tratamientos en la temperatura interna de las pilas de compost durante las primeras 72 horas del proceso, pero se observaron diferencias significativas (p<0.002) entre el nivel bajo y los niveles medio y alto (Cuadro 3).
Cuadro 3. Temperatura a las 72 horas de iniciado el proceso de compostaje en pilas compuestas por dos proporciones de compost compuesto por paja de frijol, forraje de sorgo y estiércol seco de ave (Experimento 2)
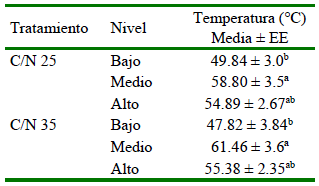
a,b Letras distintas en la misma columna indican diferencias significativas entre los niveles de las pilas de compostaje (prueba de Tukey, p<0.05)
En líneas generales, los porcentajes de inactivación obtenidos en los dos tratamientos y tres niveles fueron superiores al 79 y 99% para las cepas de S. Typhimurium y E. coli, respectivamente, a temperaturas entre 54 y 61 °C (Cuadro 4).
Cuadro 4. Porcentaje de inactivación de S. Typhimurium y E. coli entre tratamientos de proporciones carbono/nitrógeno (C/N) en tres niveles de profundidad de las pilas de compostaje de materiales de paja de frijol, forraje de sorgo y estiércol de ave a las 72 horas de iniciado el proceso (Experimento 2)
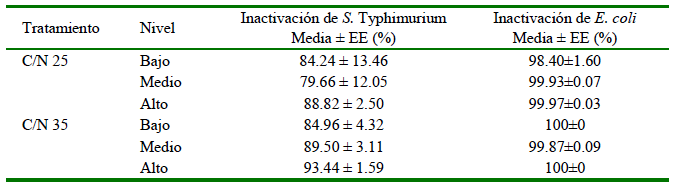
Sin diferencias significativas entre tratamientos ni entre niveles (p>0.05)
C/N 25 compuesto por 25.31, 40.42 y 34.27% de paja de frijol, forraje de sorgo y estiércol seco
C/N 35 compuesto por 44.61, 12.90 y 42.50% de paja de frijol, forraje fresco de sorgo y estiércol seco
Las temperaturas promedio a los 120 h de iniciado el proceso de compostaje del Experimento 3 mostraron diferencias significativas entre tratamientos (p<0.02) y entre niveles, donde el tratamiento C/N 35 presentó los valores más altos en el promedio total y entre niveles (Cuadro 5; p <0.000).
Cuadro 5. Temperatura en pilas de compostaje de materiales de paja de frijol, forraje de sorgo y estiércol de ave, a tres niveles de profundidad a las 120 horas de iniciado el proceso en cada tratamiento de proporción carbono/nitrógeno (C/N) (Experimento 3)
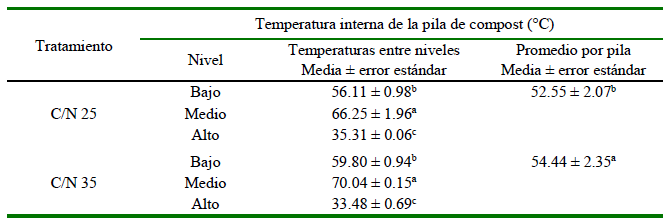
C/N 25 compuesto por 25.31, 40.42 y 34.27% de paja de frijol, forraje de sorgo y estiércol seco
C/N 35 compuesto por 44.61, 12.90 y 42.50% de paja de frijol, forraje fresco de sorgo y estiércol seco
a,b,c Letras distintas en la misma columna indican diferencias significativas entre tratamientos y niveles (prueba de Tukey, p<0.05)
En cuanto a las temperaturas medias registradas en los tres niveles de las pilas de compostaje, los valores más altos se registraron en el nivel medio en ambos tratamientos (Cuadro 6), indicando que la temperatura dentro de las pilas no fue homogénea.
Cuadro 6. Porcentajes de inactivación de la cepa S. enterica Typhimurium en tres niveles de profundidad de pilas de compostaje de paja de frijol, forraje de sorgo y estiércol seco de ave en tres tiempos de iniciado el proceso, de dos proporciones de carbono/nitrógeno (C/N) (Experimento 3)
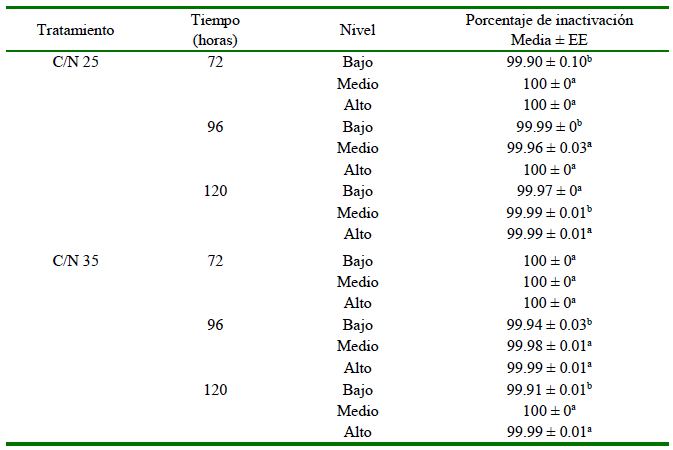
C/N 25 compuesto por 25.31, 40.42 y 34.27% de paja de frijol, forraje de sorgo y estiércol seco
C/N 35 compuesto por 44.61, 12.90 y 42.50% de paja de frijol, forraje fresco de sorgo y estiércol seco
a,b Letras distintas en la misma columna indican diferencias significativas entre los niveles de la pilas de compostaje (prueba de Tukey, p<0.05)
Solo se observó Salmonella en una de las tres muestras en el tratamiento C/N 25 a las 72 horas de iniciado el proceso de compostaje del Experimento 3. Los porcentajes de inactivación de la cepa de S. Typhimuriun obtenidos en el Experimento 3 fueron superiores al 99% en un rango de temperatura de 50 a 70 °C durante las 120 horas del proceso de compostaje, mientras en el tubo control (fuera de la pila) la carga fue de 3.61 x 106 UFC/ml a las 120 h, equivalente al 0.28 % de la carga del inóculo inicial.
DISCUSIÓN
El comportamiento de la carga microbiana observado en el Cuadro 1 coincide con lo referido por Shepherd et al. (2009) y Esperón et al. (2020), quienes reportan que las bacterias mesófilas aumentan cuantitativamente en comparación con las termófilas al inicio del proceso de compostaje y que, posteriormente disminuyen durante la etapa de maduración. Las relaciones C/N utilizadas en este estudio se corresponden a las propuestas por Erickson et al. (2015), quienes afirman que una relación C/N inicial de 25 a 35 es óptima para el desarrollo de los microorganismos y permite alcanzar la mejor calidad del compost. Por otro lado, las cargas microbianas observadas en las etapas inicial y final (Cuadro 1) se encuentran por debajo del rango permitido por las normas internacionales de la Unión Europea (Cesaro et al., 2015) y por la norma mexicana (NMXAA-180-SCFI, 2018).
La inactivación en la fase termófila del tratamiento C/N 35 presentó mejores resultados, coincidiendo con lo referido por Biswas et al. (2019) y Esperón et al. (2020), quienes demuestran que la supervivencia en compostaje es muy baja para patógenos sensibles al calor, y entre estas se encuentra Salmonella spp.
Las temperaturas dentro de los niveles de las pilas de compost fueron significativamente diferentes (Cuadro 2). En este sentido, Isobaev et al. (2014) afirman que la temperatura dentro de la pila es mayor que en la parte externa. Por otro lado, Ajmal et al. (2020) afirman que, en un compost bien gestionado, el rango de temperatura es de 55 a 65 °C, temperatura que fue obtenida en el presente estudio en la fase termofílica (Cuadro 3). Los resultados del estudio también coinciden con las normas mexicanas que establecen 65 °C como valor máximo de temperatura para mantener una mejor cantidad y calidad de nutrientes para las plantas (NMX-AA-180-SCFI, 2018). Los valores de temperaturas presentados en el Cuadro 4 se encuentran dentro del rango de temperaturas deseables (55-60 °C) durante la primera etapa del proceso (Barrena et al., 2009; Isobaev et al., 2014; Patel et al., 2015; Avidov et al., 2022). No obstante, Young et al. (2016) obtienen colonias de E. coli por encima de los límites recomendados por las guías internacionales como la de México que establece <1000 UFC/g.
Los resultados de inactivación coinciden con los obtenidos por Wilkinson et al. (2011) y Palmer et al. (2013), quienes reportan inactivación de E. coli en compost a 55 °C a las 72 horas de tratamiento. Peng et al. (2013), asimismo, informan que la mayoría de las cepas de E. coli se reducen en al menos 5 log10 tras temperaturas de 65 °C durante 25 minutos. En este sentido, Biswas et al., (2019) afirman que el mantenimiento de temperaturas entre 50 y 60 °C durante 2 a 3 semanas en el compostaje de residuos animales es efectivo contra E. coli y Salmonellas spp.
Aunque los valores de temperatura mostrados en el Cuadro 5 favorecen la inactivación de los patógenos, se requiere de valores superiores a 60 °C para conseguir de forma consistente este objetivo (Biswas et al., 2019; Viancelli et al., 2022). Del mismo modo, se coincide con Singh et al. (2012), Vinodkumar et al. (2014) y Vaddella et al. (2016), quienes validan la efectividad de la tecnología de compost para inactivar a Salmonella spp. Las diferencias obtenidas en el nivel superior de las pilas corroboran que la altura de la pila es una variable por considerar para lograr altas temperaturas en la fase termófila del compostaje (Shepherd et al., 2009; Malwana et al., 2013).
Los porcentajes presentados en el Cuadro 6 corresponden a los obtenidos por Wilkinson et al. (2011) quienes redujeron cerca del 90% de cepas de Salmonella spp. Y E. coli a temperaturas de 55 a 65 °C en residuos avícolas en condiciones de laboratorio; temperaturas que coinciden con las sugeridas por diversos autores (Isobaev et al., 2014; Biswas et al., 2019; Hwang et al., 2020). La efectividad del compostaje como método de inactivación tuvo, en consecuencia, dos importantes contribuciones: la inactivación total del patógeno y la reducción del tiempo en que permanece viable en el ambiente. Ambos efectos reducirían el riesgo de exposición para animales susceptibles, lo cual es otro elemento que permite sugerir la aplicación de este método de tratamiento de desechos orgánicos.
CONCLUSIONES
Los niveles de Salmonella Typhimurium y E. coli disminuyeron a los 12 días del proceso de compostaje, independientemente de los tratamientos de las relaciones de Carbono / Nitrógeno (C/N) del compost.
La inactivación de E. coli ocurrió a las 72 horas y de Salmonella Typhimurium a las 120 horas de iniciado el compostaje a temperaturas sostenidas entre 50 y 70 °C.
Las temperaturas alcanzadas durante la fase termofílica del compostaje no fueron homogéneas entre los niveles de las pilas del compost (p<0.000).
El proceso de compostaje constituye una tecnología alternativa eficiente para la eliminación de los residuos avícolas.












 uBio
uBio 


