INTRODUCCIÓN
La brucelosis es una enfermedad infecciosa, causada por bacterias del género Brucella. Entre estas, B. canis afecta a los caninos y genera alta pérdidas económicas en criaderos (Ji-Youl Jung et al., 2020). Según Troncoso et al. (2013) se reportan prevalencias de 7.3% en Argentina, 19.9% en Brasil y 15.9% en Perú. En Chile fue reportada en caninos por primera vez en 1978 y en los últimos años se indican prevalencias entre 7 a 20% (Sánchez, 2007; Troncoso et al., 2013; Sánchez, 2017; Galarce et al., 2020).
La brucelosis canina tiene una mayor presentación en los criaderos, pero también afecta a animales con propietario y/o de vida libre (Sánchez, 2007; Pardo et al., 2009). Dentro de los antecedentes nacionales, se encontró una positividad de 6% en una población canina de criadero (Borie et al., 2019a), de 2% en centros de rescate caninos, y de 16.8% en caninos que no eran de criadero de la Región Metropolitana, mediante la técnica de contrainmunoelectroforesis (CIEF) (Gómez, 2007; Borie et al., 2019b). Asimismo, en caninos vagabundos en Talca se reportó 7% de seropositividad por medio de inmunocromatografía (ICT) (Celis, 2013), y de 8.7% en un estudio con 449 perros clínicamente sanos y con dueño de 34 comunas del Gran Santiago, utilizando la técnica de ELISA-I B. canis con LPS-R (Sánchez, 2017). En fecha más reciente, Galarce et al. (2020) reportaron 7% de seroprevalencia en caninos con o sin dueño de la Región Metropolitana.
Si bien existen técnicas serológicas con diversa eficiencia para el diagnóstico de esta enfermedad (Galarce et al., 2020), el diagnóstico definitivo se obtiene mediante el aislamiento microbiológico. No obstante, dado que la bacteria se elimina de forma intermitente es posible obtener falsos negativos (Ardoino et al., 2006; Pardo et al., 2009). Además, es necesario contar con instalaciones de bioseguridad adecuados a nivel 3 y personal capacitado para ello (Ji-Youl Jung et al., 2020). Los métodos de amplificación de ADN han demostrado ser confirmatorios en el diagnóstico de la enfermedad, aunque también son complicados de realizar por la naturaleza del agente etiológico y el alto costo (Carmichael y Shin, 1996; Olivera et al., 2011; Galarce et al., 2020). Por otra parte, existe la prueba de histopatología, la cual puede ser realizada en los machos desde tejido testicular, donde las muestras son teñidas con Hematoxilina Eosina (H-E) para la visualización general del tejido testicular y con ácido Peryódico Shiff (PAS) para teñir las membranas basales, especialmente a nivel tubular (Borie et al., 2002).
Sumado a la dificultad diagnóstica que representa esta enfermedad, existe en Chile un alto número de caninos que pueden actuar como población susceptible de enfermar y convertirse en potenciales portadores asintomáticos. Se debe considerar el elevado número de caninos vagabundos y de tutores de canes que permiten que salgan a las calles sin supervisión (SUBDERE, 2022). Este tipo de tenencia de mascotas facilitarían el contagio entre caninos y a la vez permitiría contagiar a personas que puedan tener contacto con estos animales. Por último, en la zona centro sur del país existen pocos antecedentes epidemiológicos de la enfermedad, de allí que el objetivo de la presente investigación fue determinar la prevalencia de B. canis en una población de caninos vagabundos por medio de diferentes técnicas disponibles en Chile y evaluar el nivel de concordancia entre ellas.
MATERIALES Y MÉTODOS
El estudio de enfoque cuantitativo, de alcance descriptivo y corte transversal, fue realizado mediante un muestreo dirigido y por conveniencia a 30 caninos vagabundos de un sector de la zona oriente de la ciudad de Talca, Región del Maule, Chile. Como criterios de inclusión se consideraron canes macho que deambulaban en forma libre por la vía pública y sin identificación (collares o microchip). Los caninos eran parte de una campaña de esterilización del gobierno chileno amparada por la Ley de Tenencia Responsable N.° 21020 (Biblioteca del Congreso Nacional de Chile, 2017).
Previo a la toma de la muestra, se realizó un examen clínico general a cada animal, y se llenó una ficha clínica consignando la presencia de signos compatibles con la enfermedad (orquitis, dermatitis húmeda escrotal, atrofia testicular y/o dolor a la palpación) (Nelson y Couto, 2019). La muestra de sangre (tubo tapa roja) de 4 ml se obtuvo mediante punción de la vena cefálica externa. La muestra fue centrifugada a 1512 g durante 5 min y el suero resultante fue depositado en tubos Eppendorf y conservados a -20 °C. En el procedimiento quirúrgico para la castración se colectaron los testículos, que fueron almacenados en formalina diluida al 10%.
Los canes fueron considerados como positivos a B. canis si fueron positivos a por lo menos dos técnicas serológicas. Las técnicas llevadas a cabo fueron:
Inmunocromatografía (Anigen Rapid C. Brucella Ab. Test Kit(r), Bionote) (anticuerpos IgM). Sensibilidad igual o mayor al 90% y especificidad 90.1% (Castillo et al., 2002) y fue realizada según instrucciones del fabricante y procesadas en el hospital clínico veterinario docente de la Universidad Santo Tomás (HCVD UST). La prueba fue considerada positiva cuando se observó la presencia de dos bandas de color (la banda T y la banda C) en la ventana del kit, sin importar la banda que aparezca primero (Bionote, 2016).
ELISA comercial (ImmunoComb(r) Biogal, Israel). Sensibilidad de 98% y especificidad de 93% (Chinyoka et al., 2014). La prueba fue procesada en HCVD UST, siguiendo las instrucciones del fabricante. Las muestras fueron consideradas como negativas para S0, S1 y S2, el punto de corte fue S3 equivalente a título de anticuerpos IgG de 1:200 por inmunofluorescencia indirecta (IFA). Se consideraron como positivas S3-S6 (Biogal Galed Laboratories Acs Ltd, 2018).
Contrainmunoelectroforesis (CIEF). Sensibilidad de 100% y especificidad mayor al 95% (Sánchez, 2007). La prueba fue realizada en el Laboratorio de Microbiología de la Facultad de Ciencias Veterinarias y Pecuarias de la Universidad de Chile (FAVET). La técnica estandarizada es una serología que utiliza antígeno lipopolisacárido rugoso de Brucella ovis. Las muestras se preparan en portaobjetos con agarosa al 1% en buffer barbital sódico pH 8.6, con pocillos equidistantes entre sí. Las lecturas de bandas de precipitación se realizó previa inmersión de citrato de sodio al 5% para eliminar reacciones inespecíficas (Borie et al., 2002).
ELISA indirecto (ELISA-I B. canis con lipopolisacárido rugoso (LPS-R)). Sensibilidad de 97.5% y especificidad de 97.3% (Meza et al., 2012). Los sueros fueron procesados en el Laboratorio de Enfermedades Infecciosas, Departamento de Medicina Preventiva Animal de FAVET. La prueba de ELISA Indirecto (ELISA-I) se realizó en placas de poliestireno del tipo NUNC Polysorp, utilizando como controles positivos y negativos muestras diagnosticadas por CIEF, de acuerdo con las condiciones propuestas por Meza (2011), con algunas modificaciones. Los resultados se obtienen a través de un equipo INMUNOSKAN Plus(r) con un filtro de 405 nm. Para la interpretación de las lecturas, las absorbancias fueron transformadas en porcentajes de positividad (PP), considerando que el control positivo (con un 100% de PP) y uno negativo, obtenidos de muestras diagnosticadas por CIEF. La línea de corte entre positividad y negatividad (cut off) se consideró con un PP de 65%.
Histopatología testicular. Se realizaron cortes semiseriados de 4 µm de espesor y se tiñeron con Hematoxilina Eosina (H-E) para la visualización general del tejido testicular y con Ácido Peryódico de Schiff (PAS), para teñir las membranas basales, especialmente a nivel tubular (Borie et al., 2002). Las muestras fueron consideradas positivas cuando se detectó alteración en la membrana basal (engrosamiento o discontinuidad), degeneración tubular e inflamación (Borie et al., 2002).
Para el análisis de datos se utilizó estadística descriptiva, considerando para esto la frecuencia de presentación como porcentajes. Los datos obtenidos, fueron tabulados y representados en gráficos, en el programa Microsoft Office 2020. Los datos fueron resumidos en una tabla de contingencia de 2x2, con la que se realizó un análisis de concordancia (Kappa: <0 sin acuerdo; <0.20 acuerdo leve; 0.21-0.40 acuerdo justo; 0.41-0.60 acuerdo moderado; 0.61-0.80 acuerdo sustancial; 0.81-1.00 acuerdo casi perfecto).
RESULTADOS
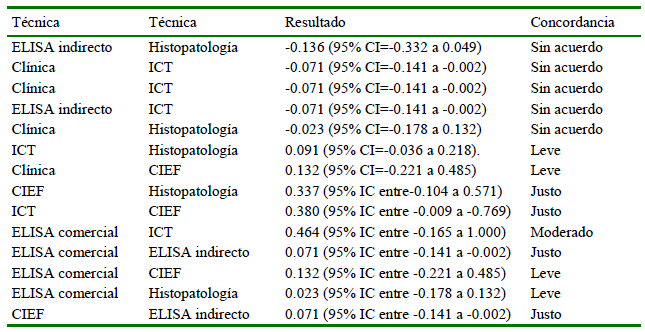
El 6.6% (2/30) de los animales muestreados fueron clasificados como positivos considerando el resultado positivo de al menos dos pruebas serológicas. En específico, tanto los signos clínicos como las técnicas de ICT, ELISA comercial y ELISA-indirecto presentaron 6.6% (2/30) de positividad, mientras que con CIEF fue de 23.3% (7/30) y mediante histopatología de 60% (18/30) (Figura 1).
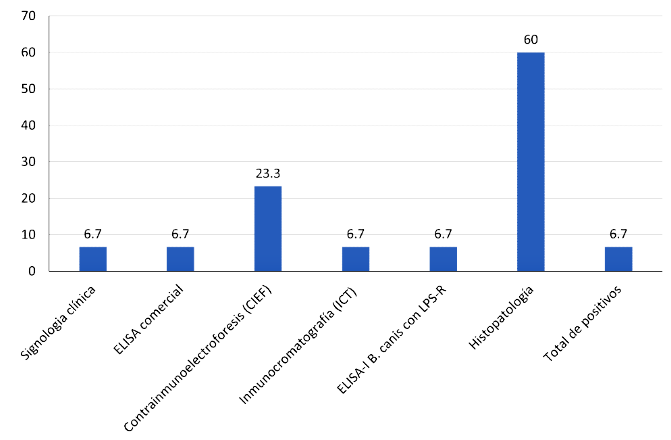
Figura 1. Frecuencia porcentual de caninos vagabundos positivos a brucelosis canina de un sector de la ciudad de Talca, Chile, según el criterio diagnóstico utilizado
En los análisis histopatológicos se evidenció que 29 canes (96.6%) presentaron degeneración tubular, 28 (93.3%) presentaron membranas basales discontinuas, 20 (66.6%) inflamación y membranas basales engrosada, 7 (23.3%) necrosis, 4 (13.3%) con presencia de eritrocitos en el lumen y en uno (3.3%) hubo presencia de hemosiderófagos (Figura 2).
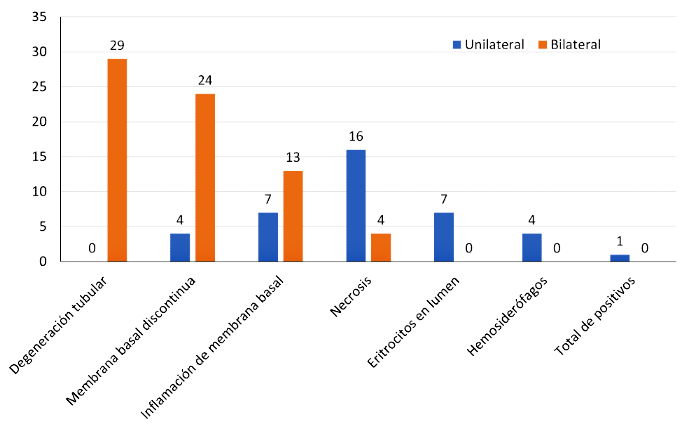
Figura 2. Lesiones histopatológicas encontradas a nivel testicular en caninos vagabundos positivos a brucelosis canina de un sector de la ciudad de Talca, Chile
En el análisis de concordancia solo se observaron relaciones pobres, leves, justas y moderadas entre técnicas; sin embargo, se destaca que todos los caninos positivos a CIEF también fueron detectados como positivos a la histopatología y solo 3% (1/30) de los caninos seropositivos fue, además, positivo a histopatología y signología clínica (Cuadro 1). La mejor concordancia entre técnicas correspondió a ICT con ELISA comercial (0.464; IC -0.165 a 1.000).
DISCUSIÓN
La signología clínica de la brucelosis es variada, incluso muchas veces compleja de identificar; sin embargo, en machos hay signos clínicos más evidentes como epididimitis unilateral o bilateral, aumento o atrofia testicular e inflamación de próstata, entre otros menos evidentes como linfoadenopatía periférica, discoespondilitis y esterilidad (Boeri et al., 2008). En una investigación realizada en Buenos Aires, Argentina, solo 4 de 16 perros seropositivos presentaron signología clínica asociada, resultados mayores a los de la presente investigación; sin embargo, sin diferencia estadística entre grupos, indicando que la signología clínica no se encuentra presente en todos los caninos expuestos a la enfermedad (Boeri et al., 2008).
La diferencia entre técnicas serológicas podría estar dada por sus sensibilidades y especificidades, por las reacciones cruzadas con otros microorganismos, y por la propia formación de antígenos y naturaleza intermitente a la bacteriemia. Asimismo, cualquier resultado positivo serológico debe ser corroborado con otra técnica (Camargo-Castañeda et al., 2021). En particular, en Chile se recomienda la antibioticoterapia junto con castración/esterilización e incluso la eutanasia en caninos sin tutores responsables (Weinborn, 2017). Sin embargo, el tratamiento con antibióticos y cirugía no excluye la posibilidad del que el animal sea una fuente de infección para las personas y otros animales, debido a que la bacteria se aloja en tejido genitourinario y en células del sistema reticuloendotelial (Carmichael y Shin, 1996). Asimismo, la presencia de anticuerpos en sangre se puede presentar en diferentes intervalos de tiempo dependiendo del método diagnóstico, volviéndose un microorganismo difícil de detectar por métodos serológicos, incluso hasta 12 semanas pos-infección (Borie et al., 2002; Camargo-Castañeda et al., 2021).
En cuanto a las muestras de laboratorio, la CIEF es una prueba de laboratorio de referencia en Chile para el diagnóstico de la brucelosis canina con especificidad y sensibilidad sobre el 96% (Sánchez, 2007). Gómez (2007) muestreó a 363 perros de clínicas veterinarias de la Región Metropolitana, encontrando 16.8% de seropositividad, siendo menor a la seropositividad obtenida en este trabajo (23.3%), lo cual podría explicarse por el tipo de animal (caninos vagabundos) de este estudio. También está documentado que CIEF podría reaccionar de forma cruzada con bacterias como Pseudomona aeruginosa, Staphylococcus spp, Bordetella bronchiseptica,y Actinobacillus spp, entre otras, resultando en falsos positivos (Carmichael y Shin, 1996; Weinborn, 2017), lo cual podría estar ocurriendo en la presente investigación.
Tuemmers et al., (2013) reportaron 1% de prevalencia de brucelosis canina en 400 muestras de perros vagabundos en la ciudad de Temuco, utilizando la misma técnica de ICT del presente trabajo. La concordancia pobre entre ICT y CIEF podría estar dada por la cantidad de antígenos presentes en el suero para que una muestra reaccione positiva, donde la técnica ICT requiere una mayor cantidad de anticuerpos para reaccionar positivo, a pesar de una similar sensibilidad y especificidad de estas técnicas (Tuemmers et al., 2011). Asimismo, Wanke et al. (2002) compararon la prueba de ICT con las técnicas de 2-mercaptoetanol (2ME-RSAT), inmunodifusión en gel de agar (AGID) y ELISA, determinando una sensibilidad y especificidad de 89 y 100%, respectivamente para la ICT en los casos agudos y subagudos, mientras que, estos valores fueron menores a los obtenidos por el ELISA en casos de brucelosis crónica. Ante esto, es posible que los caninos del presente estudio puedan tratarse de casos crónicos y, por ende, presentar falsos negativos (Palacios et al., 2021); sin embargo, para determinar la fase de la infección en la presente investigación se requieren estudios adicionales.
Por otra parte, Meza (2011) desarrolló una prueba ELISA-I para el diagnóstico de la enfermedad, en el cual utilizó un extracto altamente purificado de lipopolisacárido rugoso (LPS-R) de B. abortus CRB51, el cual presenta una sensibilidad de 97.5% y especificidad de 97.3% y, si bien, esta prueba tuvo un alto índice de concordancia con CIEF (Meza et al., 2013), en el presente estudio no se presenta ese mismo comportamiento, probablemente por el tamaño de la población estudiada.
Los niveles de lesiones histopatológicas encontradas a nivel testicular coinciden con el único estudio efectuado en Chile, donde los tres caninos con lesiones histopatológicas fueron positivos a la prueba serológica CIEF (Borie et al., 2002), mientras que, en el presente estudio solo un animal presentó todas las lesiones y fue positivo a CIEF. La lesión más común en casos de brucelosis canina es la degeneración testicular (Volkweis et al., 2020), coincidiendo con los resultados obtenidos en el presente estudio. Sin embargo, el factor cronicidad puede afectar el tipo de afección histopatológica (Anderson y Binnington, 1983; Camargo-Castañeda et al., 2021).
Otro factor que se debe considerar es el uso de formalina como herramienta de conservación de tejidos para el diagnóstico clínico, siendo una de sus principales desventajas la degradación de las proteínas, que podría influir en el resultado final (Shi et al., 1991). Asimismo, se debe considerar el tiempo de fijación de la muestra, el tipo de fijador, y la temperatura de almacenamiento, así como los protocolos para la detección de proteínas y extracción (Paavilainen et al., 2010). Por último, esta no es una técnica específica para diagnóstico de brucelosis canina, puesto que las lesiones encontradas pueden ser producidas por diferentes etiologías, desde traumáticas hasta infecciosas por otros patógenos.
Uno de los problemas actuales que se tiene en la ciudad de Talca y, en Chile en general, es la alta presencia de perros vagabundos (3,461,104 caninos sin sostenedores), a los que se les puede sumar el 20% de los caninos con tutor que se les permite salir a la calle sin supervisión (8,306,650 de caninos con sostenedor) (SUBDERE, 2022) y que podrían contagiarse de brucelosis o transmitirla al humano.
CONCLUSIONES
Existen caninos que deambulan libremente por la ciudad de Talca-Chile, con diferentes resultados frente a técnicas serológicas o de laboratorio para brucelosis canina.
La concordancia entre técnicas diagnósticas varió entre sin acuerdo (pobre), leve, justo y moderado, por lo que, se debe realizar más de una técnica diagnóstica, no recomendándose aquellas combinaciones con concordancia pobre o leve.
Se recomienda el uso combinado de la prueba de inmunocromatografía (ICT) con ELISA comercial.
No se recomienda la histopatología como única técnica diagnóstica.












 uBio
uBio