INTRODUCCIÓN
La infección parasitaria gastrointestinal es un grave problema en el manejo del ganado, y sus efectos pueden variar según la edad, el sexo, las condiciones del agua de bebida, el estado nutricional y la gravedad de la infección (Gunathilaka et al., 2018; Khan et al., 2022). Con el fin de contrarrestar los efectos negativos de los parásitos se han desarrollado diversos métodos de control integral, entre ellos, el desarrollo de fármacos antihelmínticos y su uso estratégico; sin embargo, el uso intensivo y la administración inadecuada de estos fármacos, en momentos y grupos de rumiantes inapropiados, han contribuido al desarrollo de resistencia de los parásitos a estas sustancias, representando un grave problema sanitario productivo (Márquez, 2003; Anziani y Fiel, 2015).
Perú es un país caracterizado por una ganadería extensiva o semiintensiva en la sierra y selva, siendo el parasitismo por nematodos un fenómeno frecuente en el ganado lechero. Por ejemplo, en La Libertad se ha reportado una prevalencia de 67.5% de parasitismo gastrointestinal (Oesophagostomum spp, Cooperia spp, Haemonchus spp, Ostertagia spp, Trichostrongylus spp y Trichuris spp) en bovinos cebú, Holstein y Brown Swiss (Colina et al., 2014), en tanto que en el Valle del Mantaro (Junín) se han identificado nematodos en ganado Holstein, Brown Swiss y Jersey, con prevalencias de 24.5 y 30.3% y una carga parasitaria mensual de 118.3 y 87.4 hpg en promedio en dos distritos, respectivamente (Briones et al., 2020). Asimismo, en la región Amazonas se ha reportado la presencia de nematodos, asociado principalmente a la edad, tamaño del rebaño (<50 animales) y la crianza extensiva (Frias et al., 2023). En forma similar, en bovinos criollos de 11 distritos de Santa Cruz, Cajamarca, se encontró una prevalencia de 50%, especialmente por nematodos de los géneros Bunostomum, Trichostrongylus, Oesophagostomum, Strongyloides, Cooperia, Ostertagia y Haemonchus (Livia et al., 2021)
Cajamarca (Perú) es una región ganadera lechera con alta presencia de parásitos en rumiantes, donde los productores recurren a un control basado en quimioterapia, fármacos que han sido utilizados por largos periodos de tiempo y sin evaluación de la eficacia que logran. Es así que la presente investigación se centró en evaluar la eficacia nematicida de antiparasitarios de uso frecuente (fenbendazol, levamisol e ivermectina) en vacas lecheras de tres ganaderías ubicadas en tres provincias de la región.
MATERIALES Y MÉTODOS
Área de Estudio
La investigación se llevó a cabo en explotaciones ganaderas de tres provincias de la región de Cajamarca, Perú (Figura 1) durante los meses de octubre a noviembre de 2019.
Establecimiento I (E-I): En la provincia de Cajamarca, a una altitud de 3000 msnm, con clima templado, temperatura mínima de 3.0 °C y máxima de 26.5 °C, humedad relativa 69% y precipitación anual promedio de 1.14 mm/día.
Establecimiento II (E-II): En la provincia de San Marcos, a una altitud promedio de 2650 msnm, con clima cálido-seco a subhúmedo, temperatura mínima de 2.9 °C y máxima de 25.2 °C, humedad relativa de 73% y precipitación anual promedio de 1.39 mm/día.
Establecimiento III (E-III): En la provincia de San Miguel, a una altitud de 2645 msnm, clima templado, temperatura mínima 5.5 °C y máxima de 25.5 °C, humedad relativa de 70% y precipitación anual promedio de 0.97 mm/día.
Según la información oral brindada por el personal a cargo de cada fundo, el calendario de desparasitaciones está establecido en una frecuencia trimestral, siendo los antiparasitarios más usados productos combinados a base de levamisol y triclabendazol, fenbendazol y triclabendazol y en los últimos años, ivermectina y clorsulon.
Diseño Experimental
Se hizo una evaluación inicial del ganado bovino de cada establecimiento para obtener grupos homogéneos. Se seleccionaron 30 hembras mayores de 6 meses por establecimiento, siendo animales Jersey en E-I y Holstein en E-II y E-III, todos en condiciones similares de manejo y alimentación, bajo un sistema de cría en pastoreo sobre rye grass (Lolium multiflorum) y trébol (Trifolium repens). Los animales no habían sido dosificados con antiparasitarios durante 12 semanas previas al inicio del estudio. Se seleccionaron animales infectados naturalmente con huevos de nematodos gastroentéricos y con una carga parasitaria individual ≥ 150 huevos por gramo de heces (hpg) y se distribuyeron en grupos homogéneos en cuanto a carga parasitaria de 10 animales por tratamiento.
Para el cálculo de la dosis (mL) de cada antiparasitario se consideró el peso vivo de los animales (mediante una cinta bovinométrica para las razas Jersey y Holstein), la dosis terapéutica de cada principio activo y la concentración de cada producto. Los antiparasitarios fueron administrados en el día 0, siendo fenbendazol a razón de 7.5 mg/kg, vía oral (Febantec(r) 10%, TQC, Perú), levamisol 7.5 mg/kg, vía subcutánea (Prolevan(r) 15%, Lab. Hofarm, Montana, Perú), e ivermectina 0.2 mg/kg, vía subcutánea (Ivomec(r) 1%, Boehringer Ingelheim, Brasil).
Muestras y Análisis Coprológicos
Los controles coproparasitológicos se realizaron en el Día 0 y en el Día 14 posdosificación en los tres establecimientos. Las muestras fecales fueron recolectadas directamente del recto de los animales (100 g) con la ayuda de guantes obstétricos veterinarios en horas de la mañana (06:00), y transportadas en una caja de poliestireno expandido con geles refrigerantes al Laboratorio de Parasitología Veterinaria y Enfermedades Parasitarias de la Universidad Nacional de Cajamarca para los análisis respectivos en el mismo día.
Para determinar la carga parasitaria se utilizó la técnica McMaster modificada (Fiel et al., 2011). El cultivo de larvas se llevó a cabo de muestras de los animales que presentaban huevos al día 14. Para el cultivo se siguió el protocolo de la técnica de Baermann para obtener larvas L3 para su identificación siguiendo los lineamientos de Ueno y Gonçalves (1998).
Evaluación de la Eficacia
El porcentaje de reducción del conteo de huevos fecales, se calculó mediante la fórmula %R={[(Xc -Xt)/Xc]x100}, donde Xt es el promedio de hpg de los grupos en el día 14 (postratamiento) y Xc es el promedio de hpg en el Día 0 (pretratamiento) (Young et al., 1999). Según el conteo de huevos fecales, los parásitos se clasificaron en tres categorías: sensibles, sospechoso de resistente y resistentes. Se consideró que los parásitos eran sensibles si el porcentaje del recuento de huevos era superior al 95%, presentan resistencia si el porcentaje de reducción del recuento de huevos era inferior al 95% y el nivel de confianza del 95% era inferior al 90%, en tanto que si solo se cumplía uno de los dos criterios, se consideró como sospechoso de resistencia (Coles et al., 1992). Se calculó el intervalo de confianza al 95% de las eficacias logradas.
RESULTADOS
Se encontró falla terapéutica de fenbendazol y de levamisol en los dos primeros establecimientos (E-I y E-II). De manera opuesta, los dos antiparasitarios mostraron ser eficaces en el Establecimiento III (EIII). Los nematodos de los tres fundos se presentaron como resistentes y con sospecha de resistencia a ivermectina (Cuadro 1). Se identificaron larvas L3 de Trichostrongylus spp, Haemonchus spp, Ostertagia spp y Oesophagostomum spp (Figura 2).
Cuadro 1. Eficacia de tres antiparasitarios en bovinos lecheros de tres provincias de la región de Cajamarca, Perú (n = 10 animales por fármaco) (año 2019)
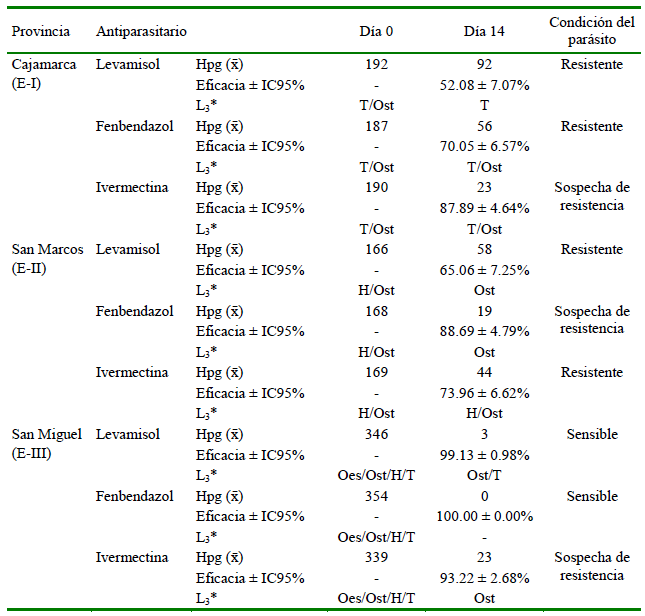
Dosis: Levamisol 7.5 mg/kg, Fenbendazol 7.5 mg/kg, Ivermectina 0.2 mg/kg.Y
L3: T: Trichostrongylus spp; H: Haemonchus spp; Ost: Ostertagia spp; Oes: Oesophagostomum spp

Figura 2. Larvas L3 de nematodos encontradas en las tres explotaciones. Trichostrongylus spp (T), Haemonchus spp (H), Ostertagia spp (Ost) y Oesophagostomum spp (Oes)
Con base a la información recopilada sobre los calendarios sanitarios de los tres establecimientos, se destaca que estas drogas son utilizadas desde hace varios años, con un programa de cuatro desparasitaciones anuales y este proceso es llevado a cabo por el personal encargado del cuidado del ganado (no profesional). Asimismo, utilizan al levamisol en bajas dosis como inmunoestimulante.
DISCUSIÓN
Los resultados muestran que las drogas antiparasitarias de uso frecuente en el control de nematodos gastrointestinales en bovinos de los establecimientos en estudio alcanzaron bajos porcentajes de eficacia, siendo aceptables solo en uno de ellos (Cuadro 1). El uso continuo de estas drogas en estos establecimientos puede haber sido un factor predisponente para la disminución de la eficacia de los antiparasitarios (Márquez, 2003; Anziani y Fiel, 2015). El efecto hallado en el E-III podría deberse al uso exclusivo de productos a base de clorsulon e ivermectina durante los últimos años, según manifestación del administrador de la finca.
Los estudios de resistencia de nematodos estrongilos a los antiparasitarios en bovinos a nivel nacional son escasos. Ya en el año 2006 en la región Cajamarca se reportó la falla terapéutica de levamisol (7.5 mg/kg) en el control de Haemonchus spp y Trichostrongylus spp en vacunos de dos fundos, el primero ubicado en el valle de Cajamarca y el otro en el distrito de San Pablo. En el mismo estudio, fenbendazol (7.5 mg/kg) e ivermectina (0.2 mg/kg) mostraron una eficacia del 100% (Rojas, 2007).
Los nematodos se mostraron resistentes y con sospecha de resistencia a ivermectina. La ivermectina se usa en diferentes especies animales debido a su capacidad de endectocida y amplio margen de seguridad. En Perú se usa incluso en camélidos sudamericanos en el control de parásitos (Cárdenas et al., 2021). De manera similar, se administra en cuyes (Cavia porcellus), a pesar de no haber productos comerciales a base de ivermectina indicados para esta especie; condición que ha podido dar lugar a la resistencia de nematodos entéricos en cuyes (Rojas-Moncada et al., 2023).
El levamisol ha sido reportado como un antiparasitario muy efectivo solo o en combinación en el control de nematodos como Cooperia spp, Trichostrongylus spp y Haemonchus spp en bovinos en el sur de Brasil (Ramos et al., 2016). Sin embargo, se ha reportado resistencia al levamisol en otras regiones de Brasil (Soutello et al., 2007; Bezerra et al., 2021), al igual que en la presente investigación, contra Trichostrongylus spp y Ostertagia spp. Asimismo, Becerra-Nava et al. (2014) reportaron resistencia a Cooperia spp, seguido de Haemonchus spp, Ostertagia spp y Oesophagostomum sp en México. Por otro lado, ante la resistencia a principios activos únicos, la asociación de fármacos pertenecientes a diferentes grupos químicos representa una opción eficaz contra los nematodos gastrointestinales multirresistentes (Ramos et al., 2016).
Aunque algunas investigaciones han encontrado que el fenbendazol es el fármaco más eficaz (Ramos et al., 2016), otros estudios han mostrado una baja eficacia contra Ostertagia ostertagi (Bartley et al., 2021) y contra Cooperia (Kelleher et al., 2020). El escenario de la resistencia a los benzimidazoles en las poblaciones de nematodos no es favorable debido al alto costo del descubrimiento y desarrollo de fármacos, por lo que es urgente implementar medidas de control y monitorizar la eficacia/resistencia a los nematodos en el ganado (Jaeger y Carvalho-Costa, 2017). Por otro lado, ha surgido resistencia a nuevos antiparasitarios, lo que indica que no se puede controlar el parasitismo únicamente con el uso de productos químicos sintéticos, sino que es necesario un cambio de enfoque para lograr un control sostenible, como podría ser el uso de hongos nematofagos y extractos de plantas que representan alternativas potenciales (Ahuir-Baraja et al., 2021).
Otros estudios en bovinos han encontrado resistencia de los nematodos estrongilos a la ivermectina. En el sur de Chile se reportó una eficacia de ivermectina del 73.5%, siendo Trichostrongylus spp y Cooperia spp los parásitos involucrados (Sievers yAlocilla, 2007). De manera similar, Encalada et al. (2008) y Muñiz-Lagunes et al. (2015) en México encontraron resistencia de Cooperia spp, principalmente a la ivermectina. En Brasil, en 19/20 granjas se reportó resistencia de Haemonchus spp a ivermectina (Bezerra et al., 2021). Europa no ha sido la excepción, habiéndose confirmado la resistencia a la ivermectina en explotaciones ganaderas del Reino Unido, Alemania y Francia, en los que Ostertagia resultó ser el nematodo más resistente (Geurden et al., 2015).
La resistencia de los nematodos gastrointestinales a los benzimidazoles es una preocupación mundial (Jaeger y Carvalho-Costa, 2017; Dey et al., 2020). Este fenómeno está muy extendido en cuanto a prevalencia y gravedad en todo el mundo, por lo que es fundamental desarrollar estrategias útiles y sostenibles para el control de los parásitos del ganado hasta que las tecnologías modernas puedan proporcionarnos mayores alternativas (Lanusse et al., 2018). Incluso queriendo adoptar una alternativa ecológica de control, su aplicación no sería universal ya que el pastoreo y el manejo de los parásitos varían entre países, por lo que las estrategias de manejo de los parásitos deben ser específicas para cada lugar y difundirse con métodos adecuados (Takeuchi-Storm et al., 2019).
CONCLUSIONES
Los antiparasitarios levamisol, fenbenzadazol e ivermectina mostraron una eficacia reducida en 2/3 establecimientos contra Trichostrongylus spp, Ostertagia spp y Haemonchus spp.
Los nematodos del ganado lechero de uno de los tres establecimientos fueron sensibles a los tres fármacos en estudio, siendo los nematodos Haemonchus spp y Oesophagostomum spp los prevalentes en la finca.












 uBio
uBio