INTRODUCCIÓN
Los procedimientos ortopédicos pueden generar dolor moderado a severo en pequeños animales. El dolor quirúrgico conlleva a alteraciones importantes en la fisiología y el comportamiento; por lo tanto, es primordial realizar estudios que permitan un manejo analgésico eficiente, prolongado y seguro en pacientes que requieren este tipo de procedimientos (Rehart et al., 2018).
No obstante, para estos estudios es importante definir que, el dolor es un síntoma dependiente de cada individuo, subjetivo, difícil de valorar, y dependiente del evaluador (Vallecilla, 2016). Por tanto, se han desarrollado diversas escalas que realizan mediciones objetivas y subjetivas del dolor (Hernandez-Avalos et al., 2019), entre ellas la escala para la evaluación del dolor posoperatorio en perros de la Universidad de Melbourne, que evalúa respuestas comportamentales, cambios de conducta y datos fisiológicos, antes y después del procedimiento (Pohl et al., 2011; Vallecilla, 2016); y la escala creada por la Universidad de Glasgow, que comprende valoraciones de la actitud general, postura, movilidad, atención al medio, vocalización y respuesta al tacto cerca del área lesionada, a distancia y en contacto con el paciente (Reid et al., 2007; Canfrán, 2021), ambas con una eficacia similar (Silva et al., 2016; Hidalgo et al., 2021; Acosta et al., 2022). Aun así, los datos cuantitativos resultantes de la aplicación de estas escalas pueden ser sesgados por factores intrínsecos del paciente y del evaluador (Grimm et al., 2013).
Dentro de las herramientas disponibles para el manejo analgésico de los procedimientos ortopédicos del esqueleto apendicular, las técnicas de anestesia loco-regional se consideran seguras y eficientes, y tienen la capacidad de reemplazar a la anestesia neuroaxial que se considera más invasiva y riesgosa (Grueso Angulo et al., 2019). Es así como bloqueos anestésicos de los nervios del miembro pélvico se consideran una excelente alternativa para el control del dolor perioperatorio en perros (Otero y Portela, 2017). En este sentido, se ha demostrado con el uso de estas técnicas efectos análogos a la analgesia epidural, superioridad a la analgesia posquirúrgica con diversos fármacos y reducción de efectos adversos asociados al uso de opioides perioperatorios (McCally et al., 2015; Romano et al., 2016; Grueso Angulo et al., 2019).
Sin embargo, los bloqueos loco-regionales tienen limitaciones por el corto efecto de los analgésicos locales y la baja posibilidad de re-aplicación, planteándose el uso de fármacos aditivos que pueden mejorar y prolongar el efecto analgésico, entre ellos, la buprenorfina, clonidina, dexmedetomidina y dexametasona (Bailard et al., 2014; Kirksey et al., 2015; Cabezas y de la Víbora, 2018). En humanos hay evidencias que indican que la dexmedetomidina y la dexametasona prolongan el tiempo de acción de los bloqueos loco-regionales, siendo la dexametasona aparentemente superior (Albrecht et al., 2019). En caninos, se han realizado estudios con analgesia epidural, bloqueo del nervio ciático y femoral adicionando dexmedetomidina e indican aumento del tiempo para recuperar la función motora y sensorial (Odete y Smith, 2013; Trein et al., 2017; Acquafredda et al., 2021). Asimismo, se reporta que el uso de dexametasona en perros sometidos a cirugía de rodilla aumenta el tiempo de analgesia posoperatoria (Manzo et al., 2014).
Con base a estos antecedentes y a la ausencia de estudios comparativos entre los fármacos adyuvantes para la analgesia loco-regional en caninos y a la subjetividad y variabilidad en la evaluación del dolor posoperatorio; este estudio tuvo como objetivo comparar la eficacia y duración de la analgesia posoperatoria utilizando dexmedetomidina o dexametasona como adyuvantes a la levobupivacaína para el bloqueo de los nervios ciático y femoral en perros sometidos a cirugía de rodilla terapéutica y, adicionalmente, evaluar la concordancia entre las escalas del dolor de Glasgow y Melbourne para la evaluación del dolor y la necesidad de rescate analgésico posoperatorio.
MATERIALES Y MÉTODOS
Aspectos Éticos y Animales
Se realizó un estudio clínico prospectivo en el Centro Veterinario Animal Hospital, ubicado en Sabaneta y en el Centro de Veterinaria y Zootecnia (CVZ) de la Universidad CES ubicado en Envigado, ambos en Antioquia, Colombia. Los protocolos del estudio fueron aprobados por el Comité Institucional para el Cuidado y Uso de los Animales de la Universidad CES (Sesión #46 del 29 de junio de 2021). La participación de los animales en el estudio fue autorizada por los respectivos tutores, después de ser informados de los objetivos del estudio, sin recibir beneficios económicos y mediante firma de consentimiento informado.
Grupos Experimentales
Se seleccionaron perros adultos (1-9 años), que requerían cirugía de rodilla para corrección de luxación rotuliana o por ruptura del ligamento cruzado entre 2021 y 2022, con miras a una meta de 30 animales. Los pacientes debían ser clasificados como de riesgo anestésico ASA I o II (según la Sociedad Americana de Anestesiólogos -ASA) (Horvath et al., 2021), mediante un examen clínico; además, debían tener valores dentro de los rangos de referencia para los análisis de hemograma, concentración sérica de alanina-aminotransferasa (ALT) y creatinina (Latimer et al., 2011). Pacientes agresivos o de difícil manejo, con histórico de cardiopatías, enfermedad renal crónica, con signos clínicos compatibles con otras enfermedades, o que hayan recibido analgésicos o antinflamatorios en los últimos 10 días eran excluidos del estudio.
Los pacientes seleccionados fueron divididos aleatoriamente (sorteo en bolsa negra) en tres grupos experimentales de igual número: Grupo control, GC: bloqueo con levobupivacaína 0.2 mg/kg por punto a ser bloqueado; Grupo dexmedetomidina, GC + 1 mcg de dexmedetomidina por cada mililitro de levobupivacaína; y Grupo dexametasona, GC + 2 mg de dexametasona por cada mililitro de levobupivacaína.
Procedimiento Experimental
Los perros fueron sometidos a un ayuno de 8 h. Una vez en la sala de preparación, por medio de auscultación torácica se registraron los parámetros basales (M0) de la frecuencia cardiaca (FC) y respiratoria (FR). Además, se evaluó la escala del dolor de Melbourne (Firth y Haldane, 1999) y de Glasgow (Reid et al., 2007) por dos evaluadores (P y G) debidamente entrenados y que no tenían conocimiento del tratamiento aplicado a cada paciente. Inmediatamente, se realizó la cateterización intravenosa administrando como medicación preanestésica 0.03 mg/kg de acepromacina y 2 µg/kg de fentanilo por vía IV. Luego de 15 min se realizó la inducción de la anestesia general con propofol, administrado en bolos (2 mg/kg/IV en 30 s) hasta la pérdida del reflejo palpebral, momento en que se realizaba la intubación orotraqueal con sonda de Magill de tamaño apropiado. El mantenimiento anestésico se realizó mediante inhalación de isofluorano en concentración suficiente para mantener el plano anestésico quirúrgico según los parámetros clásicos de Guedel (Drew et al., 2019), diluido en oxígeno al 100%, por medio de un circuito circular (pacientes de más de 8 kg) o semi-abierto (pacientes de menos de 8 kg) conectado a una máquina de anestesia inhalatoria y en ventilación espontanea.
Una vez obtenido el plano anestésico quirúrgico, se administró 20 mg/kg de Cefalotina IV y se instauró la infusión IV de 5 mL/kg/h de Ringer lactato. Se conectaron los sensores para el monitoreo y registro de las funciones vitales. Se procedió a realizar el bloqueo perineural del nervio ciático y femoral con ayuda de un neuroestimulador (Stimuplex®; aguja de 0.7x50 mm Braun, Alemania), según el procedimiento descrito por Otero y Portela (2017):
Para el bloqueo del nervio ciático se trazó una línea imaginaria entre el trocánter mayor del fémur y la tuberosidad isquiática del miembro a ser intervenido. Se puncionó con una aguja acoplada al neuroestimulador entre el tercio más craneal y el medio de esta línea, activando el equipo con la configuración: frecuencia 1 Hz, duración del estímulo 0.1 ms e intensidad 1.0 mA. Como respuesta de proximidad de la aguja al nervio, se esperaba la contracción del músculo gastrocnemio, extensión y flexión del tarso. Hecho esto, se reducía la intensidad a 0.5 mA y la respuesta debía mantenerse, si se perdía, la aguja era reposicionada hasta alcanzar una nueva respuesta positiva. Finalmente, se administraban los fármacos que hacían parte del bloqueo según el grupo experimental correspondiente.
Para el bloqueo del nervio femoral, los puntos de referencia fueron el triángulo femoral visible a la abducción del miembro y la arteria femoral detectable a la palpación. El sitio de punción fue justo craneal a la arteria femoral, lo más próximo posible al anillo inguinal en dirección al músculo psoas, atravesando el espesor de la parte caudal del músculo sartorio y la fascia iliaca. Una vez realizada la punción el neuroestimulador era activado y se seguía el procedimiento descrito para el nervio ciático, pero en este caso la respuesta positiva debía corresponder a la contracción del músculo cuádriceps femoral con extensión de la articulación de la rodilla.
Luego de 15 min de los bloqueos loco-regionales, se redujo la concentración de isofluorano para establecer un plano anestésico superficial (globo ocular levemente rotado ventralmente, reflejo corneal presente y reflejo palpebral disminuido o ausente). Se evaluaron en ambos miembros y en tres oportunidades los reflejos tendinosos y patelar como indicador de la función del nervio femoral, el reflejo ciático y el reflejo tibial craneal como indicadores del nervio ciático. Se esperaba respuesta negativa en el miembro intervenido y positiva en el contralateral. En caso la respuesta de alguno de los reflejos resultase positiva en el miembro intervenido, el paciente era retirado del estudio y su procedimiento anestésico/quirúrgico era adaptado a los protocolos institucionales y continuaba de forma rutinaria. En caso el reflejo en el miembro contralateral resultase negativo, se reducía la concentración del anestésico inhalatorio y se repetía la prueba 5 min después hasta obtener respuesta.
Posterior a la comprobación del bloqueo anestésico, se procedió a realizar tricotomía y asepsia de la zona quirúrgica para dar inicio al procedimiento, realizado siempre por el mismo equipo. Los procedimientos incluidos fueron: surcoplastia en cuña de la patela, osteotomía de nivelación de la meseta tibial (TPLO) y avance de la tuberosidad tibial (TTA).
Al término del procedimiento quirúrgico, la vaporización de isofluorano era cerrada y posterior a la comprobación de presencia de reflejos palpebrales, el investigador principal realizaba la evaluación del bloqueo sensorial por medio del pinzamiento de un espacio interdigital del miembro posterior con pinza de Halsted cerrada hasta alcanzar el primer gancho de traba. En el miembro contralateral debía haber respuesta de retirada (caso no fuese positiva se esperaba 1 min y se repetía hasta encontrarla). En el miembro intervenido no debería haber respuesta de retirada, pero si resultase positiva el paciente se excluía del estudio.
Una vez recuperado el reflejo tusígeno los pacientes eran extubados y llevados a la sala de recuperación anestésica (climatizada y con baja luminosidad), donde se monitoreaba de cerca su recuperación, signos de dolor o de cualquier complicación posoperatoria. Al alcanzar la recuperación anestésica total, se iniciaba la evaluación del dolor por parte de los dos evaluadores (P y G), aplicando nuevamente las escalas de Melbourne y de Glasgow. En el caso que en alguna de estas escalas por parte de alguno de los evaluadores resultase igual o mayor a 6 puntos, se realizaba rescate analgésico mediante administración IV lenta (30 s) de 0.1 mg/kg morfina (Kögel et al., 2014). Además, se volvía a registrar la FC y FR cada 2 h y durante 24 horas. Con estos valores se determinó su variación (ΔÄFC y ΔFR, como la diferencia porcentual entre el momento de estas evaluaciones y la del momento basal). Caso hubiese necesidad de rescate, y aunque el paciente era acompañado y monitoreado para garantizar su recuperación completa, se le retiraba del estudio.
Cuando el paciente asumía la posición cuadrúpeda autónoma, se realizaba la evaluación de bloqueo motor, determinando la capacidad de caminar con normalidad y la propiocepción. Adicional a la evaluación del dolor, se registraban todos los aspectos físicos y comportamentales que llamaran la atención de los evaluadores y caso se considerase apropiado, se realizaban las intervenciones necesarias para garantizar el bienestar del animal, retirando el paciente de los registros posoperatorios. Una vez finalizadas las evaluaciones posoperatorias los animales recibían 25 mg/kg de dipirona y 0.2 mg/kg de meloxicam vía IV, eran dados de alta para el cuidado ambulatorio con formulación de meloxicam 0.1 mg/kg cada 24 h vía oral (VO) durante 3 días y cefalexina 20 mg/kg VO cada 12 h durante 7 días, además de control médico a los 7 días, y retiro de puntos de sutura y control ortopédico a los 15 días.
Análisis Estadístico
El análisis estadístico se realizó utilizando el software R (Chan et al., 2018). El diseño experimental para las evaluaciones estadísticas fue completamente aleatorio con medidas repetidas en el tiempo. Los valores resultantes de ΔFC, ΔFR, Escala del dolor de Melbourne y escala del dolor de Glasgow fueron comparados entre los tratamientos, momentos de evaluación y su interacción, por medio del test de Friedman adaptado para medidas repetidas en el tiempo y si resultasen significativos era aplicado el post-test de Dunns. Se comparó la necesidad de rescate analgésico entre los tratamientos mediante el método de supervivencia de Kaplan-Meyer. Las variables recolectadas por los evaluadores para las escalas fueron comparadas por la prueba Mann-Whitney, correlacionadas entre los evaluadores y las escalas por el test de Spearman y sometidas al análisis de concordancia de Bland-Altman, con el objetivo de determinar la precisión y el sesgo de las mediciones entre evaluadores y entre las escalas. La significancia se fijó para todas las pruebas como p<0.05 y los datos se presentan como la mediana ± AIC (amplitud intercuartílica).
RESULTADOS
Después de realizar las pruebas para garantizar la funcionalidad del bloqueo, se incluyeron en los análisis completos del estudio a 24 animales (8 pacientes por grupo experimental). Con esta muestra se calculó el poder estadístico a-posteriori basados en las escalas del dolor evaluadas y los resultados del análisis utilizado (no paramétrico en diseño experimental completamente aleatorio con medidas repetidas en el tiempo), usando software especializado (G*Power® Version, Universität Kiel, Alemania). De esta forma, con significancia objetiva del 95% (error de probabilidad α=0.05), una muestra de 24 unidades divididas en 3 grupos y 1 covariable (momentos), el poder estadístico (1 -error de probabilidad α) fue de 70% para la escala del dolor de Melbourne y de 68% para la de Glasgow, valores que se consideran adecuados para este tipo de estudio (Cadeddu et al., 2008).
El bloqueo loco-regional y el protocolo anestésico fue satisfactorio en todos los animales y no se presentaron complicaciones que pusieran en riesgo la vida o el bienestar de los pacientes. Dentro de los procedimientos quirúrgicos, en 7 pacientes se practicó surcoplastia en cuña de la patela, en 13 pacientes osteotomía de nivelación de la meseta tibial (TPLO) y en 4 pacientes avance de la tuberosidad tibial (TTA). De los animales incluidos, se tuvo 9 machos y 15 hembras, con peso de 3 a 38 kg (23.4±14.4 kg), edades de 1 a 9 años (5.7±2.1 años), de las razas Pinscher, French Poodle, Yorkshire Terrier, Beagle, Husky, Golden Retriever, Rottweiler y mestizos.
El análisis estadístico indicó que el ΔFC, el ΔFR (Cuadro 1) y las evaluaciones del dolor (Cuadro 2) por la escala de Glasgow fueron similares entre tratamientos (p>0.05), momentos (p>0.05) y su interacción (p>0.05), en tanto que la evaluación del dolor realizada con la escala de Melbourne resultó menor en el grupo dexmedetomidina durante los momentos 2, 4, 6, 8, 10, 14, 18 y 22 h (p=0.0197) que en los demás grupos estudiados (Figura 1).
Cuadro 1. Mediana ± amplitud intercuartílica (AIC), del delta de frecuencia cardíaca (ΔFC) y respiratoria (ΔFR), así como los valores de probabilidad del test de Friedman para los tratamientos (P-Trat), momentos (P-Mom) y su interacción (P-TxM) en 24 perros sometidos a cirugía terapéutica de rodilla, bajo anestesia general y con bloqueo del nervio ciático y femoral
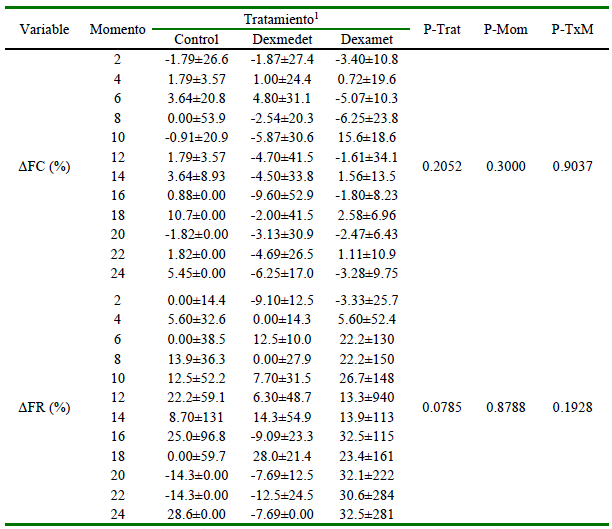
1 Bloqueo con bupivacaína (Control), complementado con Dexmedetomidina (Dexmedet) o Dexametasona (Dexamet), evaluados cada 2 horas (Momento) durante el posoperatorio
Cuadro 2. Mediana ± amplitud intercuartílica (AIC) de la evaluación del dolor por la escala de la Universidad de Melbourne y por la escala de Glasgow, así como los valores de probabilidad del test de Friedman para los tratamientos (P-Trat), momentos (P-Mom) y su interacción (P-TxM) en 24 perros sometidos a cirugía terapéutica de rodilla, bajo anestesia general y con bloqueo del nervio ciático y femoral
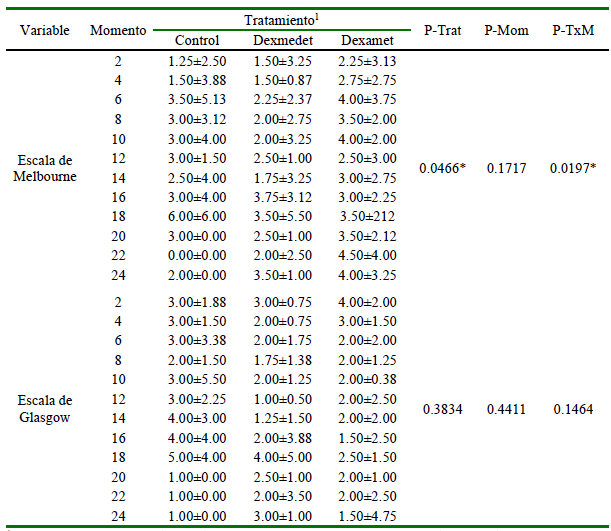
1 Bloqueo con bupivacaína (Control), complementado con Dexmedetomidina (Dexmedet) o Dexametasona (Dexamet), evaluados cada 2 horas (Momento) durante el posoperatorio
* Diferencia significativa por el test de Dunns
La necesidad de rescate analgésico en las 24 horas de evaluación en el grupo dexmedetomidina (25%; 2/8 animales) fue menor (p=0.0338) que en el grupo control (63%; 5/8 animales) y que en el grupo dexametasona (88%; 7/8 animales; Figura 1).
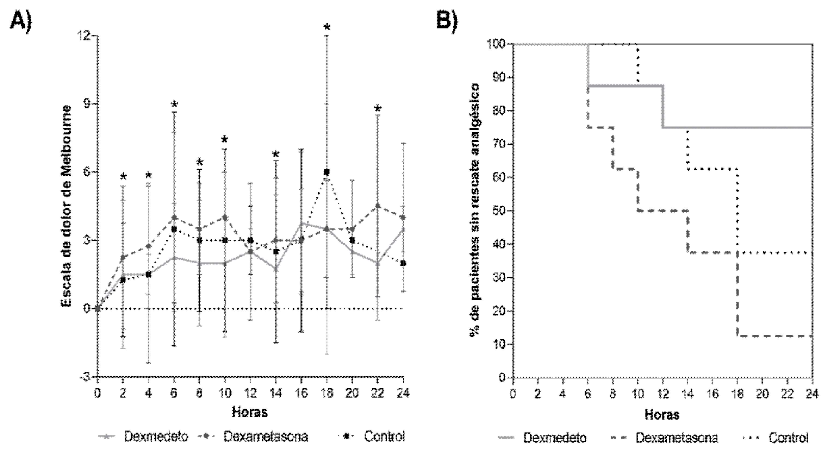
Figura 1. Representación gráfica de: A) Evaluaciones del dolor por medio de la escala de Melbourne. B) Porcentaje de pacientes que no necesitaron rescate analgésico en 24 perros sometidos a cirugía terapéutica de rodilla, bajo anestesia general y con bloqueo del nervio ciático y femoral realizado con bupivacaína (Control), complementado con Dexmedetomidina (Dexmedeto) o Dexametasona (Dexametasona), evaluados cada 2 horas durante el posoperatorio
En la comparación entre las escalas para la evaluación del dolor y los evaluadores que las aplicaron se pudo determinar que los resultados de la escala de Melbourne fueron similares entre evaluadores (p=0.3365), correlacionados entre sí (p=0.0001 y r=0.454) y con un sesgo bastante limitado (0.205±1.4; Figura 2). La escala de Glasgow también presentó resultados similares entre evaluadores (p=0.3276), correlacionados entre sí (p=0.0010 y r=0.36) y con sesgo bastante limitado (0.103±1.39, Figura 1). No obstante, al comparar las escalas entre sí, la escala de Melbourne resultó en valores mayores (p=0.0038), aunque con un sesgo bajo (0.3316±1.7) y buena correlación (p<0.0001 y r=0.529; Figura 1), en tanto que a la hora de determinar la necesidad de rescate analgésico la escala de Melbourne es más sensible (p=0.0434) con una verosimilidad de 95.7%, que indica rescate en 16 de los 24 pacientes evaluados (67%), mientras que la escala de Glasgow fue en 13 de los 24 pacientes con verosimilidad de 54% (Figura 2).
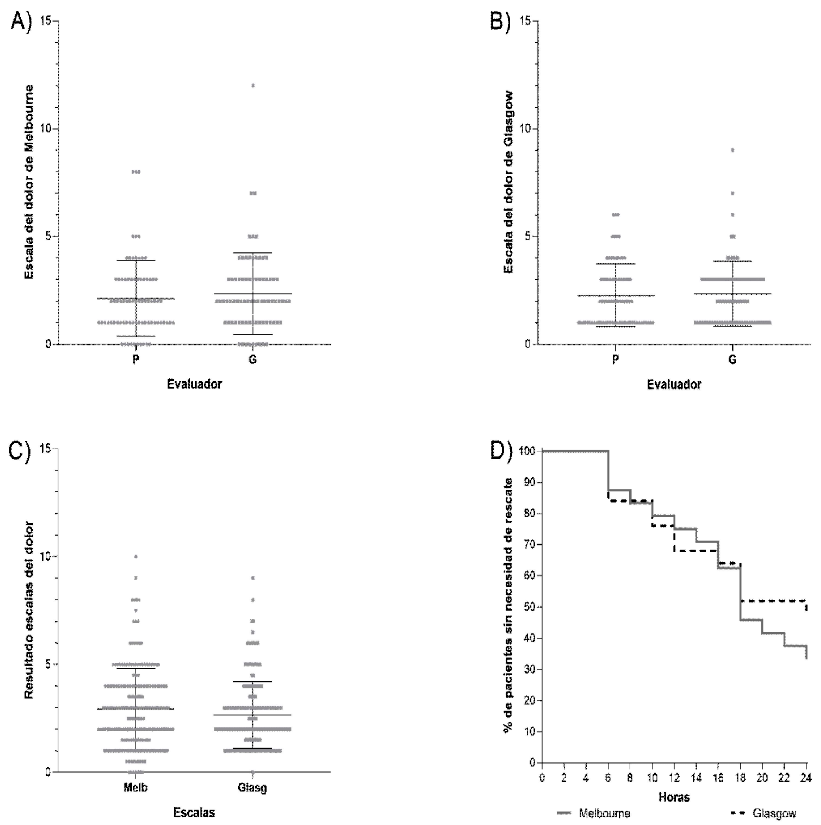
Figura 2. Representación gráfica de las evaluaciones realizados por los dos evaluadores (P y G) usando la escala de Melbourne (A) y la escala de Glasgow (B). Además, evaluaciones resultantes de la escala de Melbourne y Glasgow independientemente de los evaluadores (C) y porcentaje de pacientes que no necesitaron rescate analgésico (curvas de sobrevivencia de Kaplan Meyer) en las 24 horas de evaluación según la escala de Melbourne o Glasgow (D). Evaluaciones realizadas en 24 perros sometidos a cirugía terapéutica de rodilla, evaluados cada 2 horas durante el posoperatorio
DISCUSIÓN
Diversos autores han indicado los beneficios de administrar coadyuvantes de anestésicos locales, ya que funcionan de forma sinérgica y mejoran la analgesia (Bailard et al., 2014; Kirksey et al., 2015; Srikantha y Niraja, 2021). En el presente estudio, se pudo Melbourne. B) Porcentaje de pacientes que no necesitaron rescate analgésico en 24 perros sometidos a cirugía terapéutica de rodilla, bajo anestesia general y con bloqueo del nervio ciático y femoral realizado con bupivacaína (Control), complementado con Dexmedetomidina (Dexmedeto) o Dexametasona (Dexametasona), evaluados cada 2 horas durante el posoperatorio observar que la administración de dexmedetomidina, como adyuvante del anestésico local para el bloqueo perineural del nervio ciático y femoral, dio como resultado menor intensidad del dolor posoperatorio y menor necesidad de rescate analgésico en las primeras 24 horas posquirúrgicas, comparado con el tratamiento control o con el uso de dexametasona como adyuvante. En este contexto, experimentos en animales han demostrado que la dexmedetomidina aumenta de manera dependiente de la dosis la duración del bloqueo del nervio ciático casi en un 75%, proporcionando un control eficaz del dolor agudo (Brummett et al., 2011).
Diversos mecanismos han sido propuestos para explicar la mejora que la dexmedetomidina proporciona al bloqueo, entre ellos, a) la vasoconstricción alrededor del sitio de inyección retrasando la absorción del anestésico local; b) la atenuación de la inflamación perineural inducida por los anestésicos locales sin causar daño a los nervios; c) el bloqueo de la corriente catiónica activada por hiperpolarización; d) la inhibición de la liberación de noradrenalina por la activación del adrenoreceptor α-2 pre-sináptico; e) la estimulación de adrenorreceptores possinápticos a nivel de la medula espinal; y e) la reducción de la liberación de neurotransmisores β, sustancia P y glutamato (Brummett et al., 2011; Zhang y Bai, 2013; Gao et al., 2019). Dentro de estos mecanismos, el efecto antinflamatorio sobre los nervios periféricos, que modula el estrés oxidativo, la degranulación de mastocitos y las citocinas pro-inflamatorias (IL-6 y TNF-α), parece ser el que mejor explica la acción de la dexmedetomidina (Tüfek et al., 2013; Huang et al., 2014; Kang et al., 2018).
Según los resultados evidenciados en estudios humanos, se esperaba que la dexametasona aumentase la duración de la analgesia, inclusive en mayor proporción que la dexmedetomidina (Albrecht et al., 2019); no obstante, no se evidenció en este estudio la ventaja en la analgesia posoperatoria cuando se usó la dexametasona como adyuvante del bloqueo, inclusive se evidencia una tendencia de reducción en el tiempo de analgesia. Esta heterogeneidad en los resultados con el uso de dexametasona ha sido evidenciada en otros estudios (Kirkham et al., 2018; Marhofer et al., 2018; Li et al., 2022), los cuales reportan superioridad, equivalencia o inferioridad en los bloqueos interescalénico, axilar y supraclavicular del plexo braquial, poniendo en discusión la dosis utilizada y el lugar de ejecución del bloqueo. Los estudios que prueban su efectividad la atribuyen a la reducción de mediadores inflamatorios y descargas de las fibras C mediadas por los canales de potasio (Albrecht et al., 2019; Gao et al., 2019). Sin embargo, esta explicación fisiológica está ligada a la presencia de dolor crónico, sensibilización central y alteraciones inflamatorias neuronales, que no están presentes en animales que no sufren de dolor crónico al momento del procedimiento, como es el caso de los pacientes de este estudio.
La identificación del dolor es una prioridad y un desafío en medicina veterinaria, principalmente porque no existen metodologías completamente confiables para tal fin en las diversas especies (Hernandez-Avalos et al., 2019). En el presente estudio se utilizaron las escalas de Melbourne y Glasgow para la evaluación del dolor, escalas que han sido objeto de estudio y se encuentran validadas para este fin; sin embargo, en este estudio se determinó, además, la variabilidad entre observadores para estas escalas tratando de validar de forma apropiada esta evaluación, evidenciando que esta variación no fue significativa en ninguna de las dos escalas, lo que indica confiabilidad para detectar el dolor posquirúrugico en los perros, permitiendo aplicar un manejo analgésico adecuado (Quinn et al., 2007). Por otro lado, al comparar las escalas entre sí se evidenció buena correlación, resultado que concuerda con el estudio de Comassetto et al. (2017), quienes valoraron el dolor postoperatorio en perras sometidas a mastectomía con las escalas de Glasgow, Colorado y Melbourne, así como con el estudio de Pohl et al. (2011).
En este mismo contexto, el estudio de Maticic et al. (2010) evaluando dolor posquirúrgico en perros sometidos a corrección del ligamento cruzado reportó mejores resultados con la escala de Melbourne indicando entre otros, que elimina el sesgo entre observadores. Asimismo, Silva et al. (2016) reportaron que Melbourne detectó dolor en 17% de los casos en perros sometidos a orquiectomía; resultados similares a los del presente estudio, guardando las proporciones con respecto al nivel álgido de la cirugía. Estos resultados se explican por la amplia variedad de parámetros que Melbourne evalúa, incluyendo medidas fisiológicas como la FC, FR y temperatura y no solo comportamentales, como ocurre en la escala de Glasgow. No obstante, Comassetto et al. (2017) concluyen que Glasgow es más sensible para indicar la necesidad de rescates analgésicos y sugieren disminuir la puntuación de cohorte para rescate analgésico con Melbourne que fue de 9 puntos. En este sentido, el valor de cohorte se considera un factor determinante de la sensibilidad de esta escala y así el valor de 6 puntos usado en el presente estudio y recomendado por Pohl et al. (2011) y Silva et al. (2016) es aceptable, pues permite identificar el dolor que necesita tratamiento con más sensibilidad y así reduce el sufrimiento animal.
En este estudio pueden ser identificadas algunas limitaciones. Entre ellas, el tamaño de la muestra que, aunque permite un poder estadístico aceptable, podría aumentarse para permitir una visión más clara de las diferencias encontradas; la falta de evaluación del dolor transoperatorio, mediante las variables fisiológicas cardiopulmonares y el consumo de anestésicos inhalatorios, que no fue realizada debido a limitaciones técnicas institucionales. Asimismo, en próximos estudios se debería incluir métodos de evaluación del dolor más objetivos como los filamentos de Von Frey y las escalas digitales que están abriéndose campo en este momento.
CONCLUSIONES
La dexmedetomidina tiene un efecto adyuvante al bloqueo anestésico local del nervio ciático y femoral, reduce la intensidad del dolor y la necesidad de rescate analgésico en las primeras 24 horas posteriores a cirugía terapéutica de rodilla, sin causar efectos adversos evidentes en las condiciones estudiadas.
El uso de dexametasona no presentó efectos beneficiosos evidentes.
La evaluación del dolor posoperatorio utilizando las escalas de Melbourne y Glasgow se considera confiable y con sesgos limitados; sin embargo, la escala de Melbourne presenta mayor sensibilidad cuando se utiliza un valor de cohorte de 6 puntos, identificando con mayor agudeza la necesidad de rescate analgésico y así puede proporcionar un mejor manejo de los pacientes.












 uBio
uBio 


