INTRODUCCIÓN
La leptina es una hormona proteica sintetizada y secretada por el tejido adiposo, la cual ha demostrado regular la ingesta de alimento en varias especies, incluyendo al cerdo (Al-Hussaniy et al., 2021). Su descubrimiento ha mejorado el entendimiento de la relación entre el tejido adiposo y la homeostasis energética (Lv et al., 2019). Es capaz de inhibir la ingesta de alimentos, aumentar el gasto energético, mejorar la eficiencia del metabolismo de las grasas y promover la hidrólisis de las grasas para limitar su almacenamiento; además, se encuentra relacionada con diferentes procesos inmunológicos (Kunová et al., 2021; Mármol-Sánchez et al., 2021; Solé et al., 2021).
El papel de la leptina a nivel productivo es determinante, influyendo en el crecimiento y la composición de la canal del cerdo (Getmantseva et al., 2017; Balatsky et al., 2022). El contenido de grasa y su distribución en la canal porcina son características importantes de la calidad de la carne (Tartrakoon et al., 2016; Davoli et al., 2019). La leptina y los genes receptores de leptina juegan un importante rol en la regulación de la deposición de grasa (Balatsky et al., 2022) y, por lo tanto, en la aceptación de la carne en el mercado. Los cerdos con carcasas grasosas se caracterizan por un mayor nivel de mRNA de leptina que cerdos con carcasas más magras (Benítez et al., 2018). Las concentraciones séricas de leptina se incrementan con la edad y la adiposidad en cerdos (Piórkowska et al., 2011).
La industria porcina ha buscado alternativas que permiten reducir la grasa y aumentar la deposición de músculo, proceso en el cual se espera un efecto sobre la expresión y los niveles séricos de leptina. Algunos de estos aditivos como la ractopamina (4-[3[[2-hidroxi-2-(4-hidroxifenil)-etil]amino]butil]fenol) han mostrado efectos importantes para la producción y la deposición de grasas, pero están prohibidas en cerca de 160 países del mundo (Niño et al., 2017). Otras alternativas, como la suplementación con cromo orgánico han mostrado efectos importantes en la deposición de grasa y el rendimiento productivo (Sales y Janèík, 2011). Este oligoelemento esencial desempeña un papel clave en el metabolismo de la glucosa, las proteínas y las grasas en los tejidos animales, ya que es un componente del factor de tolerancia a la glucosa, que aumenta la señalización de la insulina y estimula la captación de glucosa y aminoácidos por parte de las células diana (Sanches et al., 2021).
Una deficiencia nutricional de cromo puede causar intolerancia a la glucosa, aumentar la grasa corporal y los niveles sanguíneos de insulina, colesterol, triacilgliceroles, y reducir la proteína corporal (Untea et al., 2017). Sin embargo, los reportes que establecen el efecto de estos aditivos sobre los niveles de leptina sérica y el perfil de ácidos grasos son escasos (Untea et al., 2017; Alencar et al., 2021), habiéndose observado resultados contradictorios con diferentes fuentes de suplementación, sexo, manejo, alimentación y categoría, entre otras variables (Gebhardt et al., 2016; Alencar et al., 2021). Por lo tanto, el objetivo de este trabajo fue determinar el efecto de la ractopamina y el cromo-levadura sobre el perfil de ácidos grasos, variables hematológicas y los niveles de leptina sérica en cerdos en finalización.
MATERIALES Y MÉTODOS
Localización, Animales y Manejo
El estudio se realizó en la porcícola comercial «Los Alpes» (N4°56’48.4" W75°55’25.9") ubicada en el municipio de Balboa (Risaralda, Colombia), con temperatura promedio de 20 ºC y a una altitud de 1150 msnm. Se emplearon 20 cerdos de la línea Topigs Traxx x Topigs 40 (16 hembras y 4 machos) distribuidos al azar en cuatro grupos experimentales. Los animales tenían un peso de 63.2±7.6 kg y 118 días de edad al inicio de la fase experimental.
Cada grupo de animales fue alojado en un corral con piso de concreto de 11 m2. Cada corral contó con un comedero tipo canoa (2.5 m lineales) y un bebedero tipo chupete (2 L/min). Las prácticas de manejo animal fueron el estándar para el sistema de producción, que incluían la recolección de excretas y lavado del corral cada mañana, raciones de alimento ofrecidas a las 07:00, 13:00 y 18:00 horas, y vigilancia sanitaria diaria al finalizar la jornada.
Dietas y Grupos Experimentales
Se formularon dietas isocalóricas (3255 kcal/kg) e isoproteicas (16% PC) que cumplían con los requerimientos nutricionales para la etapa de finalización (Rostagno et al., 2017). La base del alimento balanceado fue igual en todos los casos. La ractopamina (Pig light 4000®) y el cromo-levadura (Levacrom) se adicionaron a la micromezcla, previo a su mezcla con el núcleo base de la formulación (Cuadro 1).
Los tratamientos fueron:
T1: dieta control negativo, alimento balanceado de finalización, sin suplementación de ractopamina, ni de cromo-levadura,
T2: adición de 10 ppm/kg de ractopamina como suplemento al alimento balanceado (valor usado en las producciones comerciales),
T3: adición de 0.2 ppm/kg de cromo orgánico de levadura como suplemento al alimento balanceado, sin adición de ractopamina (Valor recomendado comercialmente),
T4: adición de 0.4 ppm/kg de cromo orgánico de levadura como suplemento al mismo alimento balanceado, sin adición de ractopamina (Valor mayor al comercial).
Cuadro 1. Ingredientes utilizados en la formulación de las dietas experimentales
| Ingredientes (%) | T1 | T2 | T3 | T4 |
|---|---|---|---|---|
| Maíz USA | 58.44 | 58.55 | 58.43 | 58.42 |
| Torta de soya importada | 20.69 | 20.74 | 20.69 | 20.69 |
| Galleta | 8.00 | 8.00 | 8.00 | 8.00 |
| Mogolla trigo | 6.12 | 5.91 | 6.12 | 6.12 |
| Aceite recuperado | 3.50 | 3.50 | 3.50 | 3.50 |
| CaCO3 | 1.05 | 1.04 | 1.05 | 1.05 |
| BM Cerdos Nutritec | 0.80 | 0.80 | 0.80 | 0.80 |
| Lisina | 0.43 | 0.42 | 0.43 | 0.43 |
| Sal | 0.30 | 0.30 | 0.30 | 0.30 |
| Fosbicálcico | 0.27 | 0.27 | 0.27 | 0.27 |
| Treonina | 0.18 | 0.18 | 0.18 | 0.18 |
| DL-Metionina | 0.17 | 0.17 | 0.17 | 0.17 |
| Cloruro de colina 60% | 0.05 | 0.05 | 0.05 | 0 |
Muestras de Sangre
La fase de campo del experimento tuvo una duración de 30 días, tiempo típico para la fase de finalización del engorde. Se colectaron dos muestras de sangre por animal los días 0, 15 y 30 del experimento por punción de la vena yugular usando agujas calibre 16 en tubos BD Vacutainer, uno sin anticoagulante y el otro con anticoagulante EDTA (7.2 mg). Las muestras, se almacenaron en una nevera portátil a 4 ºC mientras se transportaron hasta el laboratorio multifuncional de ciencias animales de la Universidad Tecnológica de Pereira para su procesamiento.
Niveles de Leptina
Los niveles de leptina en sangre se evaluaron a los 15 y 30 días de la fase experimental mediante ELISA. Para ello, la muestra de sangre sin anticoagulante fue centrifugada (Spectrafuge 6C, Labnet®, Inglaterra) a 3000 rpm durante 15 minutos. Las pruebas se realizaron en un equipo de ELISA cuantitativa 5 en 1 Crocodile (Titertek-Berthold, Alemania) empleando el kit comercial Pig Leptin Elisa MyBiosource (MyBiosource, CA, USA), siguiendo las recomendaciones del fabricante. A partir de las concentraciones estándar y sus densidades ópticas, se realizó la curva de calibración y mediante el paquete drc del programa R (R Core Team, 2021), se realizó un modelo para estimar las concentraciones de leptina en sangre. Los resultados se expresan en ng/ml.
Grasa Dorsal
El espesor de grasa dorsal se midió a todos los animales al día 30 del estudio en el punto P2 (región de inserción de la última vértebra torácica con la primera lumbar, a 6 cm de la línea dorsal). Se empleó una sonda lineal de 12 cm a 7.5 MHz en un ecógrafo Esaote Aquila Pro (Esaote, Italia). El resultado de la medición se expresó en milímetros (Ayuso et al., 2013).
Variables Hematológicas
Se realizó un análisis hematológico en las muestras colectadas a los 0, 15 y 30 días del estudio mediante un equipo automatizado URIT 2900Vet plus (URIT®, China) en la opción para cerdos. Se tomaron las variables: conteo de glóbulos blancos (WBC), glóbulos rojos (RBC), hemoglobina (HGB), hematocrito (HCT) y plaquetas (PLT), para determinar posibles alteraciones en la salud al inicio del trabajo y observar si la suplementación afecta algunas de estas variables.
Perfil de Ácidos Grasos en Carne
Los animales fueron sacrificados el día 31 del experimento según las normas técnicas vigentes para Colombia, en la planta beneficio de La Virginia (Risaralda). A la altura de la décima costilla del lado derecho de la canal se tomaron muestras de 100 g de lomo (Longissimus lumborum). Se empacaron al vacío y se enviaron en refrigeración al laboratorio de nutrición humana de la Universidad de Antioquia para el análisis de ácidos grasos en carne por medio de cromatografía de gases (GLC).
Análisis de Datos
Se utilizó un diseño completamente al azar con cuatro tratamientos y cinco repeticiones. Se realizó una estadística descriptiva y, luego se realizaron análisis de correlación de variables cuantitativas para probar los supuestos. Se encontró que los datos presentan homocedasticidad entre los 15 y 30 días en el tratamiento con la leptina, pero no normalidad, por lo que se realizó un análisis de varianza de Kruskal-Wallis. Adicionalmente, se realizó una prueba de Wilcoxon y una prueba de corrección del Holm para comparar los grupos pareados. Posteriormente, se estimaron las correlaciones entre los contenidos de ácidos grasos de la carne, el espesor de grasa dorsal y los contenidos de leptina en suero a los 15 y 30 días. Finalmente, se realizó un análisis de componentes principales (PCA) y la representación biplot entre las variables antes mencionadas, con el fin de mejorar la comprensión de la relación entre ellos. Se uso un nivel de significancia de α=0.05 y todos los procedimientos se realizaron en el software R (R Core Team, 2021).
RESULTADOS
Los niveles de leptina de cada tratamiento se presentan en el Cuadro 2. Se encontraron diferencias significativas entre tratamientos al día 15 (p=0.04), con mayor valor en T1 y T3; sin embargo, no hubo diferencias entre tratamientos (p=0.93) al día 30. Asimismo, la variación en la concentración de leptina entre días de medición dentro de tratamientos no mostró diferencias significativas (p>0.05).
Cuadro 2. Concentraciones de leptina en suero (ng/ml) a los 15 y 30 días en cerdos en finalización que consumieron alimento base (T1), suplementados con ractopamina 10 ppm (T2) y con cromo-levadura a 0.2 (T3) y 0.4 ppm (T4)
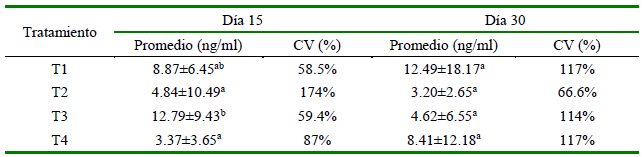
a,b Letras distintas indican diferencias significativas (p<0.05) entre medias de los tratamientos dentro del día de medición. CV: coeficiente de variación
Las variables hematológicas fueron similares entre tratamientos en el día 0 (p>0.05, con valores globales para WBC de 17.71±0.54 x109/l, para RBC de 6.72±0.10 x1012/l, para HGB de 12.88±0.22 g/dl, para HCT de 36.38±0.70% y para PLT de 341±17.93 x109/l, sin evidencia de valores anormales, indicando que se encontraban clínicamente sanos (Cuadro 3). Tampoco se encontraron diferencias significativas entre tratamientos los días 15 y 30 del estudio, ni entre días dentro de tratamientos.
Cuadro 3. Valor medio de las variables hematológicas al día 0, 15 y 30 en cerdos de finalización suplementados con Ractopamina y Cr-levadura

WBC: recuento de glóbulos blancos; RB: recuento de glóbulos rojos; HGB: hemoglobina; HCT: hematocrito; PLT: plaquetas
Alimento base (T1), suplementados con ractopamina 10 ppm (T2) y con cromo-levadura a 0.2 (T3) y 0.4 ppm (T4)
No se encontró diferencia significativa (p=0.125) entre tratamientos con respecto al espesor de la grasa dorsal al día 30 (Cuadro 4). Sin embargo, en el perfil de ácidos grasos, hubo diferencias significativas (p<0.05) entre tratamientos, tanto en los ácidos grasos saturados como en mono y poliinsaturados (Cuadro 4). Es importante notar que la suplementación con Cr-levadura, sobre todo en la dosis más alta (0.4 ppm), aumenta el tenor de la mayoría de los ácidos grasos, especialmente los poliinsaturados como el ácido linoleico y el araquidónico, en tanto que la suplementación con ractopamina tiende a disminuir todos los ácidos grasos, incluidos los insaturados.
Cuadro 4. Efecto del tratamiento (T1: alimento base; T2: 10 ppm de ractopamina; T3: 0.2 ppm de cromo-levadura; T4: 0.4 ppm de cromo-levadura) sobre el espesor de grasa dorsal y la cantidad de ácidos grasos en el lomo de cerdos al sacrificio

a,b Letras distintas indican diferencias estadísticamente significativas entre medias de los tratamientos (p<0.05).
Al evaluar la relación entre los diferentes ácidos grasos, el espesor de la grasa dorsal y los niveles de leptina, se observó en general una relación fuerte (r>0.6) y positiva entre la mayoría de los ácidos grasos entre sí, incluyendo saturados, monoinsaturados y poliinsaturados (Figura 1), aunque con una menor correlación con el espesor de la grasa dorsal(r<0.3).Sinembargo,elácidomiristoleico y el cis-11,14,17-eicosatrienoico tuvieron baja relación con los demás ácidos grasos y una correlación de 0.6 entre sí. Asimismo, las concentraciones de leptina en sangre presentaron una correlación baja y negativa con la mayoría de los ácidos grasos a los 15 días, la cual se invirtió a los 30 días (Figura 1).

Figura 1. Correlación de Pearson entre los ácidos grasos de una sección del lomo, el espesor de grasa dorsal y los nieles de leptina en sangre en sangre en cerdos en finalización
Por otra parte, la representación biplot (Figura 2) del análisis de componentes principales, sugiere la misma relación entre la mayoría de los ácidos grasos evaluados y poca relación con el ácido miristoleico y el cis11,14,17-eicosatrienoico, que se encuentran correlacionados positivamente entre sí. Sin embargo, las cantidades de estos ácidos grasos parecen ser contrarios al espesor de grasa dorsal y a los niveles de leptina a los 30 días. Por lo anterior, al evaluar detalladamente estas relaciones se pudo observar una fuerte correlación significativa entre el ácido miristoleico y el cis-11,14,17-eicosatrienoico, pero con una baja y no significativa correlación de Pearson (r<0.29) entre las demás variables (Figura 3).

Figura 2. Representación biplot del análisis de componentes principales a partir de la información de los ácidos grasos de una sección del lomo, el espesor de grasa dorsal y los nieles de leptina en sangre en cerdos en finalización
DISCUSIÓN
La leptina, es una proteína de 16 kDa que consta de 146 aminoácidos que se sintetiza principalmente en el tejido adiposo y se secreta en el torrente sanguíneo después de la escisión del péptido señal de 21 aminoácidos (Barb et al., 2001). Esta hormona tiene efectos sobre la reproducción (Barb et al., 2005; Lv et al., 2019) y el sistema inmune (Maurya et al., 2018; Qi et al., 2019); sin embargo, el principal efecto de la leptina es a nivel metabólico, regulando la homeostasis energética.
No existen reportes en la literatura sobre el efecto de la ractopamina o del Cr-levadura sobre los niveles de leptina sérica en cerdos, lo que convierte esta investigación en el primer reporte al respecto. Los resultados sugieren acumulación de grasa en los tratamientos T1 (control) y T4 (0.4 ppm/kg de Crlevadura) y un efecto contrario en T2 (10 ppm/kg de ractopamina) y T3 (0.2 ppm/kg de Cr-levadura) a los 15 días, sin embargo, no se pudo comprobar su efecto en el tiempo, pues a los 30 días no se encontraron diferencias. Una posible razón que explica estos resultados puede estar relacionada con el tamaño de muestra aquí empleado. Un resultado similar se reportó en bovinos Angus donde la inclusión de 300 mg/animal/d de ractopamina durante los últimos 35 días del ciclo de engorde, no tuvo efecto sobre la concentración de leptina (p>0.6) (Grubbs, 2010).
El principal efecto metabólico del uso de la ractopamina en la alimentación de cerdos es la hipertrofia de las células musculares (Soares et al., 2022), lo que puede resultar del aumento de la síntesis de proteínas musculares, de la disminución de la degradación de proteínas o ambos (Soares et al., 2022). Asimismo, se reporta una mejora en la eficiencia alimenticia y el rendimiento de la canal (Peterson et al., 2015). En los adipocitos, la ractopamina promueve un aumento de la lipólisis y una inhibición de la síntesis de ácidos grasos y triacilglicerol, suprimiendo la actividad de las enzimas lipogénicas y la capacidad de síntesis de ácidos grasos de novo, por lo tanto, la ractopamina antagoniza la acción de la insulina en los adipocitos porcinos (Abbas et al., 2022; Almeida et al., 2012).
A pesar de lo anterior, no se han observado reducciones en la deposición de grasa inducida por la ractopamina (Abbas et al., 2022). En el presente estudio la inclusión de 10 ppm de ractopamina (T2) disminuyó, aunque de forma no significativa, respecto del control (T1), el espesor de grasa dorsal, lo que concuerda con lo obtenido en diversas investigaciones (Almeida et al., 2010; Hinson et al., 2011; Hoque et al., 2020). Por el contrario, Rickard et al. (2017) encontraron que la inclusión de 7.4 mg/kg de ractopamina durante 21 y 35 días disminuyó el espesor de la grasa dorsal en un 6.3% en comparación con el tratamiento control. Un metaanálisis que incluyó 54 trabajos publicados entre 2004 y 2016 (Pompeu et al., 2017) no encontraron efectos significativos de la ractopamina sobre el espesor de la grasa dorsal, aunque con diferencias entre hijos de primerizas vs multíparas y entre sexos, sugiriendo el uso de la ractopamina a los últimos 28 días del ciclo de engorde.
En general, los resultados no muestran cambios en el contenido de ácidos grasos saturados, mono y poliinsaturados con la inclusión de 10 ppm de ractopamina (T2) respecto del control (T1). Por el contrario, Graham et al. (2014) muestran que los animales suplementados con ractopamina (10 mg/kg) disminuyeron significativamente (p<0.05) las concentraciones de ácido palmítico (C16:0) y esteárico (C18:0), pero aumentaron el ácido linoleico (C18:2n-6) en comparación con el grupo control, en tanto que no hubo cambios en otros ocho ácidos grasos evaluados.
Sanches et al. (2021) no encontraron diferencias significativas en la ganancia de peso, consumo de alimento y conversión alimenticia con la inclusión de 0.4 mg/kg Crlevadura en el alimento durante el ciclo de engorde; resultado similar al del presente estudio donde no encontró diferencias en el espesor de la grasa dorsal entre tratamientos.
En los cerdos, el Cr puede promover el desarrollo del tejido muscular, debido a la energía adicional generada por el aumento de la captación de glucosa por parte de las células sensibles a la insulina, que luego puede utilizarse para la síntesis de proteínas, apoyando el crecimiento muscular y el mantenimiento celular (Albuquerque et al., 2019). En un estudio, que empleó 0.4 ppm de Cr-levadura en cuatro periodos (0, 38, 62 y 94 días antes del sacrificio) el periodo de suplementación influyó (p<0.05) en el perfil lipídico de la grasa dorsal y en el perfil de ácidos grasos de la carne (Longissimus lumborum), encontrando un efecto cuadrático para el ácido γlinolénico (C18:3n6) (Alencar et al., 2021), y se planteó que existe un efecto máximo del cromo en un periodo determinado, para luego disminuir. Por otro lado, Un metaanálisis determinó que cuanto más tarde fuera el inicio de la suplementación con cromo, mayor era la respuesta de reducción de grasa y el aumento de la deposición de carne en la canal (Sales y Janèík, 2011), siendo para Alencar et al. (2021) este tiempo a los 53 días antes del sacrificio. En el presente estudio el tiempo de evaluación fue de 30 días y se trabajó con animales relativamente jóvenes (118 días de edad), pero con las edades típicas de la zona para el inicio de la finalización. Esto indicaría que el efecto puede ser mas marcado si los animales son llevados a una mayor edad al sacrificio.
A diferencia de reportado por Alencar et al. (2021), el Cr-levadura afectó (p<0.05) el contenido total de ácidos grasos saturados, monoinsaturados y poliinsaturados. Gebhardt et al. (2016) propone que no es el tiempo de suplementación sino la concentración utilizada de Cr. Los resultados obtenidos demuestran que con dos concentraciones diferentes de Cr (T3 y T4) es posible obtener algún efecto (Cuadro 4).
Se ha considerado que uno de los principales efectos del cromo en las canales porcinas es la reducción de la grasa depositada, con la consiguiente reducción de la grasa subcutánea (Wang et al., 2014), pudiendo ir acompañada de una modificación en el perfil de ácidos grasos. Los resultados del presente estudio muestran una reducción no significativa del espesor de grasa dorsal entre los animales suplementados con Cr (T3 y T4), en tanto que el análisis de correlaciones y el PCA entre el perfil de ácidos grasos y el espesor de la grasa dorsal no mostraron una relación entre ambos.
Estas variaciones en las respuestas pueden estar relacionadas con varios factores, como la concentración de nutrientes en la dieta, el medio ambiente, el manejo (Lindemann et al., 2008), sexo, edad, nivel de inclusión e incluso con la fuente de cromo, ya que, si bien las fuentes orgánicas tienen mayor biodisponibilidad que las inorgánicas, existen diferencias entre ellas (Wang et al., 2014; Sadeghi et al., 2015). Por ejemplo, al cambiar la fuente de Cr-levadura por propionato de Cr no se encontraron diferencias en el crecimiento (Matthews et al., 2005), mientras que, la adición de Cr-metionina no tuvo efecto sobre el crecimiento de cerdos (Tian et al., 2014). Por otro lado, la adición picolinato de Cr aumentó la ingesta de alimento (Gebhardt et al., 2019). Asimismo, las diferencias pueden también haberse debido a que el perfil de ácidos grasos se midió en la carne y no en la grasa dorsal, dado que la grasa de la carne tiene una menor presencia de triglicéridos debido a su menor depósito de lípidos en comparación con la grasa subcutánea y una mayor cantidad de fosfolípidos de la pared celular (Corino et al., 2014).
Es importante señalar que no existe una recomendación nutricional para requerimientos mínimos de Cr para cerdos en finalización (Sanches et al., 2021) y que los niveles de Cr utilizados en esta investigación durante la etapa final del engorde de cerdos no fueron suficientes para promover efectos positivos y significativos en las variables analizadas. Se requiere evaluar en futuras investigaciones un aumento en el tiempo de utilización del suplemento, una mayor dosis Cr o en cerdos con un peso final más alto. Asimismo, se deberá evaluar la calidad de la grasa porcina, mediante los índices aterogénicos y trombogénicos que evalúan la capacidad de la grasa de los alimentos en aumentar las posibilidades de aterosclerosis y trombosis (Alencar et al., 2021).
Finalmente, la medición de parámetros hematológicos puede proporcionar información importante sobre la salud animal y es una herramienta práctica para evaluar condiciones patológicas de forma individual ypara monitorear el estado de salud en grupos de animales. Además, los valores hematológicos reflejan la respuesta del animal a su entorno y pueden revelar condiciones adversas, aunque los animales no muestren signos clínicos de enfermedad (Ježek et al., 2018). Los valores hematológicos del presente estudio estuvieron dentro de los valores de referencia (Ventrella et al., 2017; Ježek et al., 2018; Yin et al., 2019). Además, los valores no cambiaron con el tiempo ni con la inclusión de la ractopamina o del Cr-levadura en la dieta lo que sugiere que estos aditivos no alteran las principales variables hematológicas en cerdos en fase de finalización.
CONCLUSIONES
La concentración de ractopamina y de cromo-levadura evaluadas afectaron los niveles de leptina a los 15, pero no a los 30 días, lo que sugiere que un menor tiempo de suplementación puede ser mejor. Sin embargo, estos valores no pudieron ser confirmados con el espesor de grasa dorsal.
La ractopamina y el cromo-levadura no afectaron la calidad de la grasa, aunque el primero mostró un mejor perfil de ácidos grasos.
La inclusión de estos aditivos en la dieta no repercutió en la salud de los animales.
En general, los ácidos grasos se correlacionaron entre sí, pero no con los niveles leptina.












 uBio
uBio 



