INTRODUCCIÓN
El sector avícola en el Perú representa una importante contribución al valor bruto de la producción agropecuaria (26.3%), evidenciando un crecimiento sostenido. La carne de pollo representa la principal fuente de proteína animal, alcanzando consumos de 50.96 kg/hab/año (MIDAGRI, 2022), posicionando al Perú como el mayor consumidor de carne de pollo en América Latina (Industria Avícola, 2020). Debido a la demanda de carne de pollo, las explotaciones de crianza intensiva utilizan antibióticos promotores de crecimiento (APC) para prevenir enfermedades y mejorar la producción. Sin embargo, diversos estudios (Sinovec y Markovic, 2005; Cota-Rubio et al., 2014; Ardoino et al., 2017) demostraron que el consumo continuo de dietas con APC promueve la resistencia bacteriana en humanos. Ante esto, los Estados Unidos de América y la Unión Europea han establecido normas que prohíben el uso de APC en la alimentación animal (Cervantes, 2007).
En dicho sentido, es responsabilidad del sector avícola nacional brindar productos accesibles, inocuos y de alto valor nutritivo (Berrocal, 2019) sin los riesgos de los APC, por lo que se vienen buscando nuevas estrategias nutricionales (Castanon, 2007) para el reemplazo parcial o total de los APC. Entre estas estrategias se encuentra el uso de probióticos, prebióticos, antioxidantes, enzimas exógenas (Dhama et al., 2014) y hierbas o fitogénicos (Abudabos et al., 2018) con efecto antimicrobiano, antioxidante, antiinflamatorio y de modulación del microbiota intestinal y, por lo tanto, con potencial para mejorar la producción avícola (Molina, 2022).
La espirulina (Arthrospira platensis) es una microalga verde-azul, ampliamente distribuida en la naturaleza, y se le ha empleado durante muchos años como alimento debido a los altos niveles de proteína (Dillon et al., 1995; Bensehaila et al., 2015), minerales, vitaminas, pigmentos como carotenoides y Cficociacina (Park et al., 2018a), y carbohidratos (Salmeán et al., 2015; Seyidoglu et al., 2017). Sin embargo, la espirulina puede también ser utilizada como ingrediente funcional (Pulz y Gross, 2004), debido a que presenta actividad biológica como antioxidante, por la presencia de ficocianina (Mirzaie et al., 2018; Momo et al., 2021), betacaroteno y tocoferol, lo cuales retrasan o inhiben la oxidación de los lípidos (El-Desoky et al., 2013; Kuhad et al., 2006). Park et al. (2018a) demostraron que la adición de hasta 1% de espirulina en la dieta estimuló la actividad de las enzimas antioxidantes, especialmente de superóxido dismutasa, la cual se incrementa en forma lineal. Asimismo, el ã-ácido linolénico, ácido graso láurico y ácido palmitoleico de la espirulina (El-Sheekh et al., 2014) tienen actividad antimicrobiana y mejoran la capacidad de absorción y la digestibilidad de los nutrientes. Algunos autores también han demostrado que el uso de espirulina disminuyó la población de coliformes en el íleon del pollo (Toyomizu et al., 2001; Fathi et al., 2018; Zahir et al., 2019), e incrementó las bacterias ácido-lácticas (Shanmugapriya et al., 2015a), demostrando su actividad prebiótica (De Jesus-Raposo et al., 2016).
El efecto de espirulina en la producción ha sido probado en diversas especies de animales como peces (Zhang et al., 2020), corderos (Holman et al., 2012), cerdos (Šimkus et al., 2013), aves (Jamil et al., 2015; Madeira et al., 2017; Selim et al., 2018; Pango, 2021), incluyendo codornices (Hajati y Zaghari, 2019; Cheong et al., 2015). Investigaciones usando la línea de pollos Cobb probaron el efecto de la inclusión de espirulina hasta los 28, 35 y 38 días sobre los parámetros productivos con resultados variables (Jamil et al., 2015; Fathi et al., 2018; Zahir et al., 2019).
La longitud de vellosidad (LV) y la profundidad de la cripta de Lieberkühn (PC) se relacionan con la capacidad digestiva del intestino delgado (Pango, 2021). Estudios realizados por Asmaz y Seyidoglu (2022) mostraron que dosis de 1000 mg/kg de espirulina en el alimento incrementaron la LV y la relación LV/PC (RLP) y disminuyeron la PC en el duodeno de ratas Wistar alimentadas por 45 días. Adicionalmente, Furbeyre et al. (2017) reportaron que 1% de espirulina en la dieta aumentó la LV en el yeyuno en lechones destetados, mientras El-Hady et al. (2022) demostraron su influencia favorable sobre la LV y la RLP en pollos.
Los pollos Cobb son la línea genética que predomina en Perú (hasta en un 60%), en la cual el pollo de engorde es consumido a la edad de 42 días (MINAGRI, 2015). Sin embargo, no hay experiencias sobre el efecto de la espirulina en pollos de engorde en el país. Ante esto, el objetivo del estudio fue determinar el efecto de la inclusión de espirulina en la dieta sobre el rendimiento productivo y morfometría intestinal del pollo de engorde en condiciones experimentales.
MATERIALES Y MÉTODOS
Lugar de Estudio
La fase de crianza se llevó a cabo en los galpones experimentales del Laboratorio de Producción Avícola y Especies Menores (LPAYEM), en tanto que las evaluaciones histológicas se realizaron en el Laboratorio de Anatomía Animal, ambos en la Facultad de Medicina Veterinaria de la Universidad Nacional Mayor de San Marcos, Lima, Perú.
Arreglo Experimental
Se utilizaron 240 pollos machos de la línea Cobb 500 distribuidos aleatoriamente en 4 tratamientos con 6 repeticiones cada uno. Se empleó un diseño de bloques completamente al azar. Las unidades experimentales estuvieron conformadas por corrales con una densidad de 10 pollos por metro cuadrado. Los tratamientos fueron: T0: dieta base sin espirulina (Control), T1: dieta base con 0.25% de espirulina, T2: dieta base con 0.5% de espirulina, y T3: dieta base con 1% de espirulina.
La dieta base (Cuadro 1) fue formula-da mediante el Software Dapp Nutrition®, según los requerimientos nutricionales de la etapa de crianza. La fuente de espirulina fue el producto comercial de Qingdao Huineng Biotech (China), presentado como un pulverizado verde oscuro con 7% de humedad, 60% de proteína cruda, 8% de ficocianina, 1% de clorofila, 1% de carotenoides y 8% de ceniza.
Cuadro 1. Dieta base y composición nutricional de alimento utilizado en pollos de la Línea Cobb en fase de inicio, crecimiento y acabado
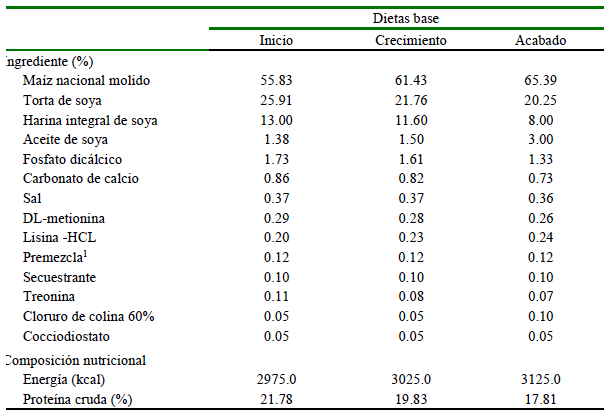
1 Premezcla: Vit A 12 000 000 UI, Vit D3 5 000 000 UI, Vit E 30 000 UI, Vit K3 3 g, Vit B1 2 g, Vit B2 10 g, Vit B6 3 g, Vit B12 0.015 g, Vit B5 11 g, Vit B9 2 g, Vit B3 30 g, Vit B7 0.15 g, manganeso 80 g, zinc 80 g, hierro 50 g, cobre 12 g, yodo 1 g, selenio 0.30 g
Los pollos fueron criados desde el nacimiento hasta el día 42 de edad sobre una cama de viruta de madera. El manejo ambiental se realizó según las recomendaciones de la guía de manejo de la línea Cobb para la edad (Cobb, 2019). El alimento y agua fueron ofrecidos ad libitum en equipos semi automáticos modelo campana.
Variables Evaluadas
Parámetros productivos
Al final de la etapa de acabado se evaluó la respuesta a los tratamientos en términos de ganancia de peso (GP): diferencia entre el peso inicial y el peso a los 42 días; consumo de alimento (CA): diferencia entre el alimento ofrecido y el alimento residual; índice de conversión alimenticia (ICA): cantidad de alimento consumido para producir una unidad de ganancia de peso (CA/GP); índice europeo de eficiencia productiva (IEPE): (viabilidad x ganancia diaria de peso x 100) / edad (días) x ICA (Gonzáles et al., 2013), donde la viabilidad es el porcentaje de aves con vida al final de los 42 días. El IEPE permite evaluar el rendimiento integral de una parvada de pollos de engorde (Tolentino et al., 2008) y está influenciado por valores bajos de mortalidad e índice de conversión de las aves en un lote (Manfredi, 2014). Para determinar los pesos de las aves y del alimento se utilizó una balanza digital con una capacidad de 10kg y una precisión de 0.1g.
Morfometría intestinal
Los cambios en morfometría intestinal como respuesta a los tratamientos fueron medidos a través de las dimensiones de las vellosidades intestinales. Al final de los 42 días de crianza se seleccionaron al azar seis aves por tratamiento y se sacrificaron en la sala de necropsias del LPAYEM posterior a un ayuno de 8 h. Se extrajeron segmentos de intestino de 1 cm de largo, tomando como referencia la mitad de cada una de tres porciones: duodeno, desde la molleja hasta los ductos biliares y pancreáticos, yeyuno, desde los ductos biliares y pancreáticos hasta el divertículo de Meckel, e íleon, desde el divertículo de Meckel hasta la unión ileocecal. Los segmentos fueron fijados por 24 h en formalina tamponada neutral al 10% (Wu et al., 2016), colocados en frascos rotulados y enviados al laboratorio privado Lab. Crishistotecnologa (Lima, Perú), encargados de realizar los cortes histológicos y tinción de los núcleos y citoplasma celular (Santos, 2017) con Hematoxilina-Eosina (HE), siguiendo el protocolo de técnicas histológicas para procesamiento de tejidos (Megías et al., 2017).
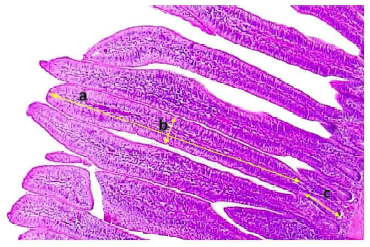
Asimismo, se midió la longitud (LV) y ancho (AV) de las vellosidades intestinales, profundidad de las criptas de Lieberkühn (PC) y la relación LV/PC en los cortes transversales de cada segmento intestinal mediante (Canto, 2019). Se seleccionaron de 8 a 10 campos por lámina y se observaron con un microscopio (Leica® DM1000, cámara ICC50W) a 40X. La LV se midió (µm) desde el ápice de la vellosidad hasta la entrada de la cripta, el AV se midió (µm) considerando una línea perpendicular a la sección media de la vellosidad y la PC se midió (µm) desde la entrada de la cripta hasta la zona basal de la misma (Vallejos et al., 2015) (Figura 1).
Análisis Estadístico
El efecto de los niveles crecientes de espirulina fue evaluado mediante contrastes ortogonales polinómicos del tipo lineal y cuadrático (Carcelén et al., 2020). La estimación del nivel óptimo de inclusión de espirulina en la dieta se llevó a cabo mediante maximización de las ecuaciones cuadráticas de regresión (García, 2000). Se empleó el paquete estadístico R v. 4.02 (R Core Team, 2021), con las bibliotecas lm y ggplot2. Para todas las pruebas estadísticas el nivel de significación fue 0.05.
RESULTADOS Y DISCUSIÓN
Parámetros Productivos
Ganancia de peso
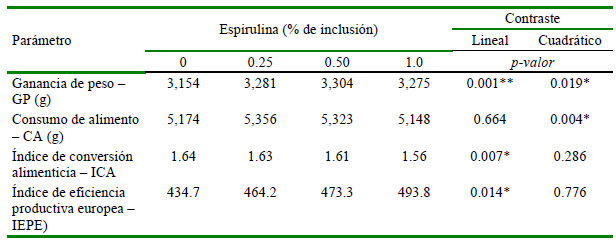
Los componentes lineal y cuadrático de la respuesta a la inclusión de hasta 1.0% de espirulina fueron significativos (p<0.001 y p<0.019, respectivamente) (Cuadro 2, Figura 2). La dosis estimada de espirulina para un máximo de GP fue 0.68% (IC0.95: 0.570.99) la cual produjo 3331g (IC0.95: 31943467).
El efecto de la espirulina sobre la ganancia de peso es explicable. Osman et al. (2019) indicaron que la ficocianina de la espirulina aunada a presencia de aminoácidos con actividad antioxidante puede ser crucial para mejorar el estado de salud. En este sentido, Park et al. (2018b) observaron que la alta digestibilidad de la espirulina permite la absorción de nutrientes y por tanto en el mejor crecimiento del pollo.
Resultados análogos a los del presente estudio fueron obtenidos por Jamil et al. (2015) quienes encontraron un incremento significativo del peso corporal como respuesta a la inclusión de espirulina en la dieta de pollos Cobb a los 28 días de edad. Asimismo, en estudios con dosis más bajas, como los de Shinde et al. (2018) y Fathi et al. (2018), se evidenció un incremento del peso vivo como respuesta a la inclusión de 0.06 a 0.08% de espirulina en la dieta de pollos a los 42 días, y con 0.05 a 0.09% a los 38 días, respectivamente. Por otro lado, Pango (2021) y Zahir et al. (2019) al evaluar pollos Ross (21 días de edad) y Cobb (28 días de edad), respectivamente, no encontraron diferencias estadísticas (p>0.05) al utilizar 0.15, 0.50, 1.0 o 1.5% de espirulina en la dieta en términos de ganancia de peso. Del mismo modo, Bonos et al. (2016), al utilizar 0.5 y 1.0% de espirulina en dietas de pollos hasta los 42 días de edad no evidenciaron diferencias (p>0.05) con el grupo control.
Consumo de alimento
La respuesta en CA a los niveles crecientes de espirulina fue significativa, aunque solo se evidenció un componente cuadrático (p<0.004) (Cuadro 2, Figura 2), lo que sugiere que los niveles de espirulina más altos tendieron a disminuir el CA. La dosis estimada de espirulina para un máximo de CA fue 0.47% (IC0.95 0.29-0.48), la cual produjo 5353 g (IC0.95 5070-5636). Khan et al. (2020) observaron que el consumo de alimento aumentó con el mayor nivel de inclusión de espirulina (2 g espirulina/kg alimento), sin embargo, Ross y Dominy (1990) encontraron que la inclusión de espirulina por encima del 10% en dieta disminuyó el consumo de alimento y retrasó el crecimiento.
El mecanismo por el cual el incremento en espirulina reduce el consumo no está claro; sin embargo, la presencia de fenilalanina dentro de la composición de aminoácidos presentes en la espirulina estaría relacionada con el retraso del vaciado del buche, la cual produciría la disminución en el consumo de alimento (Furuse et al., 1991). La fenilalanina es un liberador de la CCK (colecistoquinina), hormona que participa en los mecanismos de la ingesta de alimento provocando un efecto de saciedad (Ballinger y Clark, 1994).
Cuadro 2. Rendimiento productivo de pollos Cobb a los 42 días de edad, alimentados con una dieta base (control) y tres niveles de espirulina (Arthrospira platensis)
* Respuesta significativa a 0.05; ** Respuesta significativa a 0.01
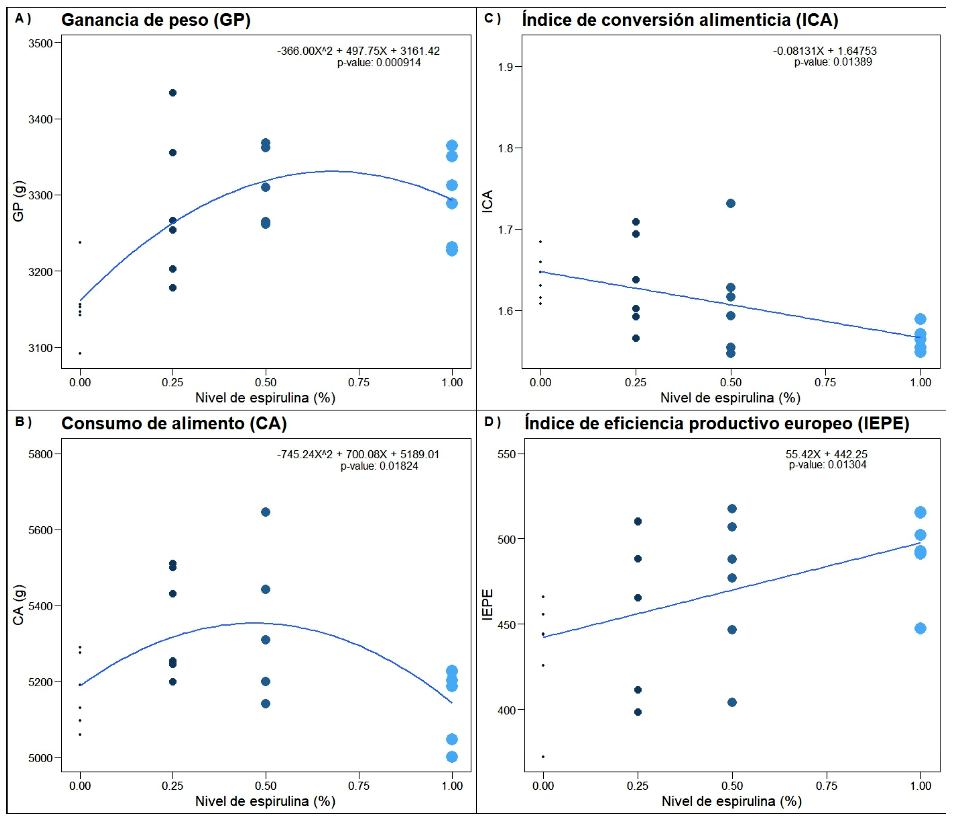
Figura 2. Ajuste al modelo cuadrático de la ganancia de peso (A) y el consumo de alimento (B), y ajuste al modelo lineal de la conversión alimenticia (C) e índice de eficiencia productiva europeo (D) en pollos Cobb 500 en respuesta a niveles crecientes de espirulina (Arthrospira platensis)
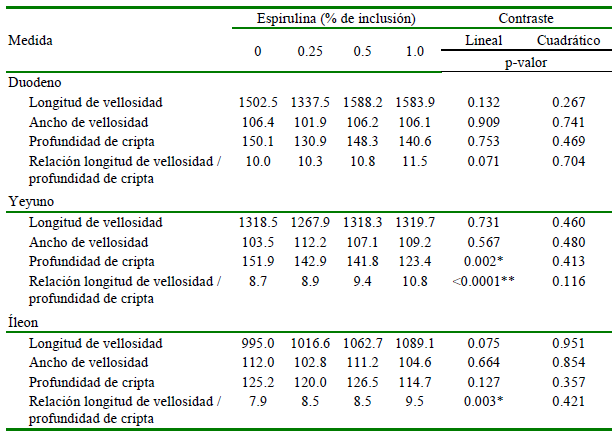
Cuadro 3. Medidas morfométricas (µm) de los segmentos del intestino delgado (duodeno, yeyuno e íleon) en pollos Cobb 500 (42 días de edad) alimentados con cuatro niveles de espirulina (Arthrospira platensis)
* Respuesta significativa a 0.05; ** Respuesta significativa a 0.01
Otras experiencias con espirulina muestran un incremento significativo en el CA con la inclusión de 0.04, 0.06 y 0.08% en la dieta en pollos Vencobb 400Y criados sobre cama de cascarilla de arroz hasta los 42 días de edad (Shinde et al., 2018). Sin embargo, Pango (2021), Zahir et al. (2019) y Fathi et al. (2018) no encontraron diferencias en el CA con respecto al control al incluir niveles de 0.15, 1.0 y 0.09% de espirulina en la dieta de pollos de engorde hasta 21, 28 y 38 días, respectivamente. En tanto, Hernández (2020) reportó un menor CA al incluir 0.5% de espirulina en la dieta de pollos Ross 308 criados hasta los 42 días a 36ºC en un clima seco sobre cama de viruta. La diferencia de los resultados obtenidos en el CA en la presente investigación en comparación con otros estudios puede estar relacionada con el medio ambiente en donde fueron criados los pollos, así como el manejo y la calidad de la espirulina utilizada (Shinde et al., 2018).
Índice de conversión alimenticia
Únicamente el componente lineal de respuesta en ICA a los niveles crecientes de espirulina fue significativo (p<0.007) (Cuadro 2, Figura 2). La ausencia de una respuesta cuadrática no permite la estimación de una dosis óptima para esta variable de respuesta o sugiere que esta es mayor que la dosis máxima empleada. Una respuesta favorable en términos de ICA a espirulina fue también encontrada por Shanmugapriya et al. (2015a), quienes reportaron diferencias entre las dosis de 0.5 y 1% de espirulina en la dieta en pollos de la línea Ross 308 a los 36 días de edad. Asimismo, se reportaron resultados favorables con niveles de 0.2, 0.4 y 0.8% (Jamil et al., 2015), con niveles de 0.5, 1.0 y 1.5% en pollos de 28 días (Zahir et al., 2019) y con 0.05 y 0.07% en pollos Vencobb 400Y (Shinde et al., 2018), todas estas con cama de cascarilla de arroz. Adicionalmente, Sugiharto et al. (2018) indicaron que la adición de 1% de espirulina produjo una disminución del ICA en pollos de engorde Lohmann (MB-202) de 21 días. Por otro lado, Bonos et al. (2016) no encontraron efectos significativos con la adición de espirulina en dosis de 0.5 y 1.0% en pollos de engorde en crianza mixta hasta los 42 días. Estas diferencias podrían ser atribuidas a la composición del alimento, condiciones de alojamiento y a los sistemas de producción (Zahir et al., 2019).
Índice de eficiencia productivo europeo (IEPE)
Los niveles crecientes de espirulina produjeron una respuesta lineal significativa en IEPE, aunque las diferencias entre los niveles fueron mínimas (Cuadro 2, Figura 2). Debido a que la crianza se realizó en condiciones experimentales no se evidenciaron diferencias sustantivas en mortalidad entre los tratamientos evaluados, pero pudo ser influenciada por los valores del ICA. Similares resultados para este parámetro han sido obtenidos por Park et al. (2018b) quienes evidenciaron una tendencia lineal en IEPE en dosis de hasta 1% de espirulina en la dieta de pollos Ross a los 35 días de edad criados en baterías, mientras que Hajati y Zaghari (2019) reportaron un mejor IEPE, aunque no significativo con dosis de 0.5% en codornices de 35 días. Por otro lado, Park et al. (2018b) indican que la presencia de nutrientes tales como aminoácidos, vitaminas, minerales y otros compuestos biológicos presentes en la espirulina pueden estar contribuir en metabolismo y por tanto tener efecto sobre el rendimiento productivo.
Morfometría Intestinal
Los resultados del análisis estadístico de las respuestas en morfometría intestinal a los niveles crecientes de espirulina se presentan en el Cuadro 3. No se tuvo respuestas lineales ni cuadráticas significativas en LV a nivel de duodeno, yeyuno e íleon. El AV tampoco presentó tendencia significativa en los tres segmentos intestinales en estudio. Por otro lado, solo se obtuvieron respuestas lineal significativas en la PC y LV/PC en yeyuno y en LV/PC en íleon por efecto de los niveles crecientes de espirulina en la dieta.
Los resultados del efecto de espirulina sobre la morfometría intestinal son variables. Pango (2021), al evaluar la inclusión de espirulina a 0.15% en dieta en pollos Ross a los 21 días, no encontró diferencias significativas (p>0.05) en la altura de vellosidades, profundidad de cripta, ancho de vellosidad, área de vellosidad, ni en la relación altura/ profundidad cripta en yeyuno, mientras que Shanmugapriya et al. (2015b) reportaron un incremento en LV del yeyuno en comparación con el control con dosis de 0.5, 1 y 1.5% en pollos Ross de 36 días y Khan et al. (2020) observaron un incremento de la LV con dosis de 0.2% en la dieta. Asimismo, Ansari et al. (2018) reportaron valores más altos para LV/PC de duodeno y yeyuno, pero no observaron efecto a nivel del íleon con respeto al control con la inclusión de la dosis de 1.5 y 2% de espirulina en la dieta de pollos Ross 308 a los 42 días. Asmaz y Seyidoglu (2022) observaron un incremento de LV/PC en duodeno de ratas Wistar con la inclusión de espirulina en dosis de 1000 mg/kg, adicionalmente evidenciaron que el índice de proliferación en las criptas duodenales de Liberkühn fue más alto, sugiriendo que el contenido de proteínas y polisacáridos de espirulina pueden apoyar el crecimiento de las células epiteliales y, por lo tanto, de la mucosa intestinal.
Se ha demostrado que hay una correlación positiva entre la altura de la vellosidad y la absorción de nutrientes, además que la PC es un indicador de la salud del intestino, donde criptas más profundas son un indicativo de mayor requerimiento por el alto recambio celular al enfrentar la presencia de patógenos, toxinas (Tfaile et al., 2020; Salim et al., 2013) o radicales libres (Zou et al., 2016). Por otro lado, el uso de aditivos que disminuyan el ancho de vellosidad intestinal sería benéfico para la salud del ave (Jiménez, 2022), al aumentar la cantidad de vellosidades para una mejor respuesta fisiológica (Rodriguez y Alsina, 2010). Además, valores mayores en LV/PC también indican mejor capacidad de digestión y absorción en el intestino delgado (Rubio et al., 2010; Vallejos et al., 2015), lo cual permite un mejor desempeño productivo (Tfaile et al., 2020). Por otro lado, el uso de espirulina ha demostrado efecto antioxidante asociado al efecto antiinflamatorio a nivel intestinal en ratas inducidas a colitis experimental (Abdel-Daim et al., 2015).
CONCLUSIONES
La inclusión de diferentes niveles de espirulina en la dieta de pollos Cobb 500 a los 42 días de edad mostró un comportamiento lineal significativo para variables índice de conversión alimenticia (ICA) e índice de eficiencia productiva europeo (IEPE), profundidad de cripta (PC) y la relación longitud de vellosidad / profundidad de cripta (LV/PC) en yeyuno y en íleon. En tanto, un comportamiento cuadrático significativo para variables ganancia de peso (GP) y conversión alimenticia (CA).
El nivel óptimo de espirulina en la dieta para maximizar la ganancia de peso en pollos de engorde fue estimado en 0.68% de la dieta, dando un valor predictivo de 3330 g.












 uBio
uBio