INTRODUCCIÓN
El Síndrome Metabólico Equino (SME) es reconocido como una colección de factores de riesgo para el desarrollo de laminitis de origen endocrino (Durham et al., 2019). Se encuentra asociado al desarrollo de obesidad y desregulación de la insulina, y su directa relación con la presentación de laminitis aumenta su impacto en términos tanto de morbilidad como de mortalidad (Tadros y Frank, 2013; Bertin y de Laat, 2017). También se ha relacionado con la presentación de hipertensión, síndrome hiperlipémico y osteocondrosis, así como con problemas reproductivos en yeguas (Johnson et al., 2004, 2012).
Se ha encontrado que el SME afecta más a ponis y razas como Mustang, Árabe y Pura Sangre Español. La presentación en caballos Pura Sangre Inglesa es rara y no se conoce mucho sobre su prevalencia en asnales y caballos de tiro (Frank et al., 2010; Bamford et al., 2014). El Caballo de Paso Fino, el cual es una modalidad del Caballo Criollo Colombiano (CCC), ha sido reconocido en varios estudios como una raza predispuesta al desarrollo de esta afección (Geor et al., 2013); sin embargo, se requiere de investigaciones más específicas, debiendo considerarse la interacción entre factores genéticos y medioambientales para el desarrollo de este síndrome (Frank et al., 2018).
Según el último censo del Instituto Colombiano Agropecuario (2018), la población de caballos es de 1 685 000 animales, siendo la mayoría de la raza CCC. En los centros de crianza de CCC es común encontrar animales con condición corporal igual o superior a 7/9, ya que entre propietarios y montadores esto se relaciona frecuentemente con un mejor fenotipo, llevándolos a tener mejores puntuaciones en las competencias y en su comercialización; sin embargo, no se tiene en cuenta que la obesidad de estos animales puede tener efectos nocivos en su salud y rendimiento deportivo.
La obesidad es altamente prevalente en los equinos a nivel mundial y es considerada como uno de los parámetros para tener en cuenta en el diagnóstico del SME (Burns, 2016; Durham et al., 2019). Sin embargo, otros estudios sugieren que la obesidad puede no ser el factor principal, sino un marcador de una disfunción metabólica subyacente (Frank et al., 2010; Geor et al., 2013).
Estos cambios en el fenotipo generalmente están acompañados de alteraciones en la regulación de la insulina, que se manifiestan como hiperinsulinemia y/o resistencia a la insulina, donde la presencia de gran cantidad de tejido adiposo complica estos hallazgos (Reynolds et al., 2019). La sensibilidad a la insulina puede estar alterada por factores adicionales, como la dieta, ejercicio, e incluso en pacientes con afecciones sistémicas relevantes como en el caso del Síndrome de Respuesta Inflamatoria Sistémica (SIRS) (Bertin et al., 2016). En estudios en caballos con SME, la hiperinsulinemia ha sido detectada entre el 22 y 29% de la población equina susceptible, demostrándose que animales con resistencia a la insulina tienen un riesgo 10 veces superior para el desarrollo de laminitis en comparación con los animales que no la tienen (Geor y Harris, 2009). Se desconoce la prevalencia de laminitis atribuida solamente al desarrollo de SME, pero hay estudios que estiman entre 1.5 y 34%, sin especificar su origen y todavía no es claro el mecanismo por el cual se genera (Morgan et al., 2015).
Los pacientes con SME pueden tener además afectados los niveles de leptina y triglicéridos (McCue et al., 2015). Se ha demostrado que altos niveles de leptina, la cual es producida por los adipocitos, puede llevar a un aumento en el estrés oxidativo de las células endoteliales, alterando también de este modo la perfusión del casco (Kearns et al., 2006). Es de gran importancia de adquirir mayor conocimiento sobre la relación entre los componentes del SME con el fin de lograr un reconocimiento temprano de animales en riesgo, un diagnóstico más acertado y estrategias de prevención y tratamiento más confiables (Sojka y Johnson, 2014).
El objetivo general de este estudio fue diagnosticar el Síndrome Metabólico en el Caballo Criollo Colombiano basado en la relación entre obesidad, adiposidad regional, hiperinsulinemia, hiperleptinemia e hipertrigliceridemia y asociarlo al desarrollo de signos clínicos de laminitis en equinos de la Sabana de Bogotá, Colombia.
MATERIALES Y MÉTODOS
Animales
El estudio fue realizado en la Sabana de Bogotá (2600 msnm) en siete criaderos de Caballo Criollo Colombiano. La población estudiada fue de 40 animales con edades entre 5 y 15 años, tanto machos como hembras. Se incluyeron 30 equinos con características fenotípicas compatibles con SME (condición corporal igual o mayor a 7/9 según la escala de Henneke [1983] y presencia de adiposidad regional reflejada en una cresta del cuello igual o mayor a 3/5 según la escala de Carter et al. [2009]), sin otra evidencia de anormalidad a nivel general, y 10 equinos clínicamente sanos, con condición corporal 6/9 y cresta del cuello menor a 3/5, como grupo control. Se reclutaron cuatro equinos obesos y un equino control por finca, aproximadamente. Los animales objeto de estudio debían haber sido criados en el sitio o que su estancia mínima hubiese sido de un año en la finca en donde se realizó el muestreo.
La dieta de los animales estuvo basada en 3 kg de concentrado de mantenimiento, heno, agua y sal mineralizada para equinos dada a voluntad, todo esto durante por lo menos el mes previo a la toma de las muestras. El último tratamiento contra vermes fue entre 2 y 3 meses previos al estudio. Todos los animales estuvieron en estabulación las 24 horas, con un promedio de 20 minutos de trabajo al día. El estudio fue aprobado por el comité de ética de la Universidad de la Salle y se realizó con la autorización previa de los propietarios de los animales.
Evaluación General
Se hizo un examen clínico completo a los animales con énfasis en la evaluación de signos asociados a laminitis (presencia de pulsos digitales positivos, respuesta a la prueba de la pinza y aumento de temperatura de los cascos). El peso corporal fue obtenido con la fórmula de Carroll y Huntington (1988). Se clasificó la condición corporal de cada uno de los individuos según la escala de Henneke. Se midió la circunferencia del cuello con la cabeza y cuello en posición vertical normal, se tuvo en cuenta la distancia de la nuca a la parte craneal de la cruz, se dividió la zona en tres tercios y se realizó la medición de la circunferencia con una cinta métrica en cada caso y se promediaron los valores (Frank et al, 2006). Se clasificó la cresta del cuello según la clasificación de Carter et al, (2009).
Muestras y Pruebas de Laboratorio
La noche previa a la realización de las pruebas, los animales fueron alimentados con una galleta de heno y se les colocó un catéter calibre 14 en la vena yugular para minimizar el estrés al momento de la toma de las muestras. Las muestras fueron colectadas en tubos tapa roja entre las 06:00 y las 08:00 con los animales en ayuno. Las muestras fueron centrifugadas y los sueros resultantes almacenados a -20 °C hasta su procesamiento.
Se determinaron los niveles de leptina mediante una prueba de ELISA cuantitativa tipo sandwich (Diasource®) y los niveles de triglicéridos con una técnica colorimétrica de punto final tipo ELISA (SpinReact®). Además, se realizó una prueba de insulina-glucosa combinada (TIGC), para evaluar los niveles de insulina y glucosa en diferentes tiempos, según la prueba diseñada por Eiler et al. (2005). La medición de glicemia se realizó con un glucómetro manual para humanos, basado en el método de glucosa-oxidasa y para la medición de insulina se empleó una prueba ELISA colorimétrica tipo sándwich (Accubind®).
Para la prueba de TIGC se midió la glucosa e insulina basal al inicio del estudio, luego se administró 150 mg/kg de dextrosa al 50% IV, seguido de 5 ml de solución salina heparinizada y luego 0.1 U/kg de insulina regular por la misma vía. Luego, por medio del glucómetro se realizó la medición seriada de glucosa con una gota de sangre obtenida por medio del catéter al minuto 5, 15, 25, 35, 45. Durante la prueba se tuvieron dos jeringas de 60 ml con dextrosa al 50% listas para ser administradas, en caso de que el animal mostrara signos de hipoglicemia o sus niveles de glucosa decayeran a menos de 30 mg/dl.
Diseño y Análisis Estadístico
Los datos registrados de cada animal del grupo control (n=10) y del grupo de equinos obesos (n=30) fueron el peso, condición corporal, cresta del cuello, presencia o no de signos asociados a laminitis (pulsos digitales, presencia de ceños, prueba de la pinza positiva), mediciones de glucosa (minuto 0, 5, 15, 25, 35, 45), insulina (minuto 0 y 45), leptina (min 0) y triglicéridos (min 0) y se analizaron con el Software Statistix v. 8.0. Se realizó una estadística descriptiva (media, desviación estándar, varianza y error estándar) para cada una de las variables en cada grupo. El modelo utilizado fue una prueba t de Student para comparar el grupo control con el grupo de equinos obesos para las diferentes variables. De igual forma, se realizó una comparación de los parámetros entre los animales que presentaron signos asociados o no a laminitis. Se utilizó un nivel de significancia del 0.05%.
RESULTADOS
Uno de los equinos del grupo control tuvo que ser excluido del estudio ya que, a pesar de presentar un examen clínico normal y los parámetros fenotípicos se ajustaban a los criterios de inclusión, los resultados posteriores a las pruebas de laboratorio estuvieron elevados. Las comparaciones entre las variables en estudio con relación a las características fenotípicas de los animales se presentan en el Cuadro 1. El peso y la circunferencia del cuello fueron significativamente mayores en el grupo de animales obesos.
Cuadro 1. Datos comparativos entre el grupo de equinos con obesidad y características fenotípicas compatibles con el Síndrome Metabólico Equino (SME) y el grupo control
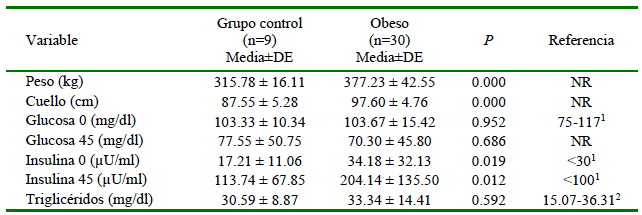
1 Valores de referencia de glucosa e insulina (Toribio, 2010)
2 Valores de referencia de triglicéridos (Díaz et al., 2008) NR: No hay referencia
La medición de glucosa basal (minuto 0) en el TIGC presentó valores similares en los dos grupos. Al comparar las dos curvas de glucosa durante los 45 minutos se evidenció la presencia de la curva bifásica normal, siendo la primera curva positiva hasta el minuto 30 y la segunda negativa con respecto a los valores basales de glucosa. En el grupo de equinos obesos, fue notorio un pico de glucosa mayor con respecto al grupo control en el minuto 5 (Figura 1) y cinco animales de este grupo no presentaron la fase negativa de la curva; es decir, los niveles de glucosa estuvieron siempre por encima del nivel basal, lo cual podría corresponder a la presentación de resistencia a la insulina no compensada.
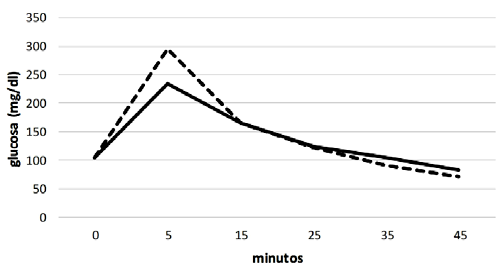
Figura 1. Curvas de glucosa en la prueba de insulina-glucosa combinada entre equinos con obesidad y características fenotípicas compatibles con el Síndrome Metabólico Equino (SME) y el grupo control, clínicamente normal. La línea continua corresponde al grupo control y la línea discontinua al grupo de obesos
Como hallazgo adicional, en los dos grupos hubo casos en los cuales los niveles de glucosa descendieron a menos de 30 mg/dl al final de la prueba, siendo solo evidente una leve manifestación clínica en uno de ellos (parche de sudor de 2 cm de diámetro), motivo por el cual se le administró 120 ml de dextrosa al 50% para ayudar a su recuperación. A estos animales se les administró alimento de inmediato. Además, se les practicó dos mediciones adicionales encontrando la recuperación de los niveles de glucosa.
Los niveles de insulina al minuto 0 fueron significativamente diferentes entre grupos (p=0.0193) y con varianzas desiguales (p=0.0019). En forma similar, estos valores también fueron diferentes al finalizar el TIGC al minuto 45 (p=0.018), con varianzas desiguales (p=0.00234) (Cuadro 1). En ambos casos, tanto al inicio como al final de la prueba, los animales obesos tuvieron niveles de insulina más altos que los equinos control (Figura 2).
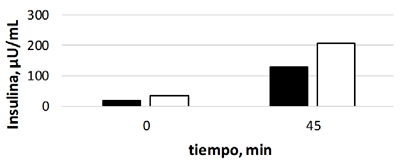
Figura 2. Comparación de medias de los niveles de insulina (µU/ml) al minuto 0 (lado izquierdo) y al minuto 45 (lado derecho) entre el grupo control (negro) y el grupo de equinos obesos (blanco)
Los niveles de triglicéridos fueron similares para los dos grupos (p=0.592; Cuadro 1). Sin embargo, a pesar de estos resultados, se pudo observar que, dentro del grupo de los caballos obesos, los niveles de triglicéridos tendían a ser más elevados en los caballos con condición corporal mayor.
Para los valores de leptina, los datos no fueron confiables debido a problemas en la técnica empleada para su medición.
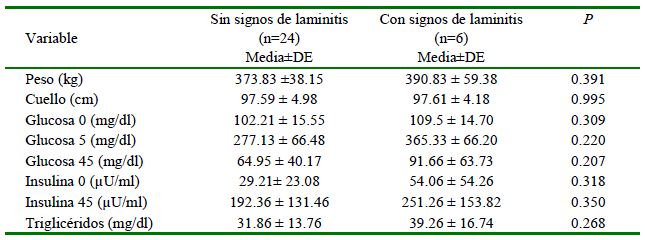
Dentro del grupo de equinos obesos, se encontró que seis de ellos presentaron signos asociados a laminitis (pulsos digitales, presencia de ceños y aumento de temperatura en el casco). Al realizar una comparación dentro de este grupo basados en la presentación o no de signos clínicos se encontró que no hubo diferencias significativas en los diferentes parámetros evaluados (Cuadro 2).
DISCUSIÓN
Según el consenso del Colegio Americano de Medicina Interna Veterinaria (ACVIM) en 2010 (Frank et al., 2010) y del Colegio Europeo de Medicina Interna Equina (ECEIM) en 2018 (Durham et al., 2019), la obesidad y particularmente la adiposidad regional es uno de los criterios que se tiene en cuenta para definir el fenotipo del SME, principalmente los depósitos de grasa en el cuello, conocido como cresta del cuello y su clasificación hecha por Carter et al. (2009), así como en la base de la cola, cerca al prepucio, ubre o sobre las costillas.
Entre las características fenotípicas que se observaron en los equinos del grupo obeso, se encontró un peso corporal mayor y circunferencia del cuello de mayor tamaño, lo cual coincide con una cresta del cuello igual o mayor a 3/5 observadas en pacientes con SME. La presencia de adiposidad regional, particularmente en la región del cuello, es uno de los hallazgos más comunes; sin embargo, basados en el fenotipo de algunos caballos de esta raza, se observa en la región del estudio que los caballos de ciertas líneas genéticas poseen un mayor desarrollo de la masa muscular a nivel del cuello, lo cual puede generar inadecuadas apreciaciones al caracterizar estos pacientes, de allí la conveniencia de observar si hay presencia de otros depósitos de grasa localizada.
Si bien estas características físicas son descritas dentro de los parámetros del SME, todavía no se ha establecido con certeza si la obesidad es causa o consecuencia de la desregulación de la insulina, otro de los componentes claves de esta afección (Bamford et al., 2014). Uno de los animales del grupo control fue excluido ante una sospecha de alteración metabólica, dado que la insulina, el TIGC y los triglicéridos se encontraron alterados. Esto indica que la obesidad no debe ser usada como un parámetro único para sospechar del problema, ya que no necesariamente es una característica primaria del síndrome, sino que puede ser un indicador de un problema metabólico que, según otros factores como la dieta o el ejercicio, puede llevar al acúmulo de grasa y al desarrollo de obesidad (Geor et al., 2013).
El término desregulación de la insulina se viene utilizando para indicar alteraciones entre el balance de las concentraciones de insulina, glucosa y lípidos en el organismo y se ha asociado a la presentación de SME, relacionándose con el desarrollo de laminitis de origen endocrino. Por esta razón, ante la sospecha de SME, es pertinente recurrir a la realización de pruebas de laboratorio que puedan confirmar el diagnóstico (De Laat et al., 2019).
Jeffcott et al. (1989) fueron pioneros en sugerir diferencias metabólicas innatas entre ponis y caballos Pura Sangre Inglés. Hoy en día se tiene conocimiento de las diferencias entre razas en cuanto a la sensibilidad a la insulina y la respuesta que se puede obtener en las diferentes pruebas, lo cual hace más difícil tener parámetros confiables para dar una definición consensuada acerca de la desregulación de la insulina en los equinos (Geor et al., 2013, Bamford et al., 2014). Las técnicas utilizadas para detectar este tipo de alteraciones son múltiples. Hay que partir del hecho que hay muchos factores que pueden afectar la sensibilidad a la insulina, y los valores de referencia se manejan de acuerdo con el tipo de prueba. No se han validado los parámetros de referencia para las diferentes pruebas, encontrando cambios asociados principalmente a la raza, lo cual afecta su sensibilidad y especificidad (Schuver et al., 2014; Dunbar et al., 2016; Bertin y de Laat, 2017).
En el presente estudio se utilizó la prueba de insulina glucosa-combinada (TIGC), la cual, al ser una prueba dinámica, la hace más sensible frente a las mediciones basales, pudiendo identificar animales con hiperinsulinemia y resistencia a la insulina, evaluando mucho mejor la sensibilidad a la insulina por parte de los tejidos (Morgan y McGowan, 2015). Es una prueba sencilla de realizar que al medir la respuesta del individuo en el tiempo hace que el animal sea su mismo control, arrojando resultados más confiables. Sin embargo, en la actualidad se recomienda la realización de pruebas donde la administración de glucosa sea por vía oral, ya que asemejan las condiciones de administrar dietas ricas en carbohidratos no estructurales, activando el eje enteroinsular y la producción de incretinas, estimulando al páncreas generando una mayor liberación de insulina (Rapson et al., 2018).
Durante la TIGC se tienen en cuenta las mediciones de glucosa e insulina. Los caballos sanos muestran una curva bifásica de la glucosa, una inicial que cursa con hiperglicemia (curva positiva) y otra en la cual los niveles caen por debajo de los basales (curva negativa), encontrándose los valores de glucosa normalizados al minuto 45. Los valores de referencia límites para la insulina basal son de 20 µU/ml y de 100 µU/ml al minuto 45 (Durham et al., 2018). Al realizar el TIGC en los dos grupos, la presencia de ambas curvas de glucosa después de la administración de la insulina fue evidente. En la medición inicial de glucosa se observó que dos de los animales del grupo de equinos obesos presentaron un grado leve de hiperglicemia. Generalmente los caballos con SME, a pesar de tener alteraciones en los niveles de insulina, cursan con normoglicemia, lo que es conocido como una resistencia a la insulina (RI) compensada (Dunbar et al., 2016).
Cuando hay casos de obesidad crónica puede generarse una descompensación y reflejarse en hiperglicemia, para lo cual hay que tener en cuenta que puede haber una sobrecarga de trabajo de las células beta del páncreas y tener como resultado un caballo con Diabetes tipo II (Bertin y De Laat, 2017). En estos animales también es necesario descartar la posibilidad de la presentación de disfunción de la pars intermedia (Carter et al., 2009). En algunos caballos obesos solo se detectó la fase positiva de la glucosa durante los 45 minutos de la prueba, tiempo suficiente para la evaluación (Toribio, 2010): la ausencia de retorno a los niveles basales de glucosa puede atribuirse a RI no compensada, ya que se esperaría que estas concentraciones descendieran rápidamente por la insulina exógena administrada (Frank et al., 2006).
Hay que tener en cuenta que la hipoglicemia puede ser una complicación potencial, aunque infrecuente, en este tipo de pruebas debido a la administración de insulina. Se mencionan valores mínimos de 40 mg/dl (Eiler et al., 2005; Frank et al., 2010). En este estudio, nueve caballos presentaron hipoglicemia marcada, incluso por debajo de 30 mg/dl, sin generar signos clínicos relevantes, teniendo en cuenta que los animales estaban en reposo. Esto pudo estar asociado con el volumen de insulina usado, ya que pudo haber errores en el peso, teniendo en cuenta que se trabajó con pesos estimados. Por otro lado, no se puede descartar una respuesta por efecto del ayuno (McCue et al., 2015).
En la medición de insulina en el presente estudio, hubo diferencias entre los dos grupos en los dos tiempos, siendo más marcados al minuto 45, confirmando que el grupo de animales obesos presentó desregulación de la insulina. Esto puede indicar que, los animales no solo pueden presentar una mayor liberación de la hormona, sino además puede haber una disminución en la velocidad de su metabolismo, haciendo que esté más tiempo presente en sangre (Frank et al., 2011; Geor et al., 2013). En estos casos se ha reportado la medición de la relación proteína C/insulina para evaluar el clearance a nivel hepático y detectar si esto está contribuyendo con los niveles altos de insulina (Chameroy et al., 2016).
Los niveles de leptina en ambos grupos de animales se encontraron por fuera de los valores reportados en la literatura, lo cual pudo deberse al tipo de prueba empleada (ELISA), mientras que en la mayor parte de los reportes se ha hecho a través de pruebas de radioinmunoensayo usados en medicina humana y validados para equinos (Kearns et al., 2006).
Pleasant et al. (2013) sugieren que los triglicéridos en casos de RI prolongada pueden encontrarse aumentados, ya que la insulina en condiciones normales disminuye la síntesis de triglicéridos. No obstante, en el presente estudio, los niveles de triglicéridos solo mostraron una ligera tendencia es estar más elevados en los animales con mayor condición corporal, pero sin relación con los signos asociados a laminitis.
Recién en los últimos años se empezó a reconocer la laminitis de origen endocrino como la forma de presentación más común sobre las causas relacionadas con enfermedades sistémicas severas (Karikoski et al., 2015). Alteraciones en los niveles de insulina y la obesidad se encuentran asociadas a un estado proinflamatorio, lo cual está estrechamente relacionado con el desarrollo de laminitis de origen endocrino (Heliczer et al., 2017). Su presentación se manifiesta de una forma subclínica más prolongada, que termina volviéndose crónica, con cambios más sutiles por estrés en las células de la membrana basal de animales con laminitis endocrinopáticas (Patterson-Kane et al., 2018; Elliot y Bailey, 2023). En el presente estudio se encontraron seis animales con hallazgos clínicos compatibles con laminitis dentro del grupo de caballos obesos; sin embargo, el reducido número de animales afectados impide hacer inferencias desde el punto de vista estadístico.
El SME es un problema de sanidad y bienestar animal, reconocido en la actualidad a nivel mundial. Es necesario continuar con estudios acerca del tema y poder establecer valores de referencia para la raza.












 uBio
uBio