INTRODUCCIÓN
Fasciola hepatica es un trematodo que afecta la producción en la industria ganadera (Charlier et al., 2020). El ciclo de vida incluye una migración abdominal y hepática de trematodos juveniles antes de que los adultos se asienten en los conductos biliares (Beesley et al., 2018). La enfermedad puede ser (sub)aguda, con reducción de la ingesta de alimento, letargo, anemia y muerte súbita, o crónica la cual se asocia con pérdida de peso, menor respuesta productiva, pudiendo además asociarse con fallas reproductivas secundarias (Munita et al., 2019).
Clínicamente, la fasciolosis se considera una enfermedad debilitante crónica; sin embargo, en el ovino es más frecuente la enfermedad aguda o subaguda (Hayward et al., 2021), debido a una menor resistencia a este parásito, lo cual posibilita una mayor infestación y daño hepático, causando muerte súbita en estos animales (Munita et al., 2019). Por otro lado, la infección en el caprino generalmente evoluciona como una enfermedad crónica, aunque pueden ocurrir casos de fasciolosis subaguda y aguda con altas tasas de mortalidad (Hashemnia et al., 2015; Radostis et al., 2017). En general, la función hepática comprometida conduce a trastornos del metabolismo de carbohidratos, proteínas y grasas, lo que afecta la salud, el bienestar y la productividad de las ovejas y cabras infectadas (Sargison y Scott, 2011; Rokni, 2014).
Otro inconveniente con la fasciolosis es que es una enfermedad subdiagnosticada, ya que el método más usado es la identificación de huevos en las heces, técnica que solo permite identificar infecciones con presencia del parásito en fase adulta, por lo que la sensibilidad es limitada (Davies Calvani et al., 2018). Por otro lado, pruebas más sensibles como la detección de anticuerpos permiten detectar infecciones más recientes, pero dan títulos positivos durante varias semanas después del tratamiento, mientras que la detección de coproantígenos puede detectar infecciones antes que se puedan observar huevos en las heces, pero tiene un rendimiento variable, además del alto costo de la prueba (Howell y Williams, 2020). Ante esto, la detección de anticuerpos anti-F. hepatica específicos en muestras de suero con la técnica de ELISA es un método adecuado para el diagnóstico precoz de la infección (Afshan et al., 2013).
En Colombia existen muy pocos estudios en ovejas y cabras sobre el diagnóstico de F. hepatica (Pulido-Medellín et al., 2014; Sierra et al., 2018; Pinilla et al., 2019), además del deficiente control de la enfermedad en explotaciones de pequeños rumiantes. Ante esto, el objetivo del presente estudio fue detectar F. hepatica por medio de la técnica de ELISA indirecto pequeños rumiantes de Boavita, Boyacá, Colombia.
MATERIALES Y MÉTODOS
Lugar de Estudio
La investigación de llevó a cabo en el municipio de Boavita, departamento de Boyacá, Colombia. La zona (dependiendo de la altitud 1300-3000 msnm) presenta climas templado seco, húmedo y frío húmedo con temperatura ambiental entre 6 y 24 °C y precipitación pluvial de 1200 a 2000 mm (Alcaldía de Boavita, 2021).
Tamaño de la Muestra
El municipio de Boavita registra 1350 ovinos y 2750 caprinos (ICA, 2020), de modo que se consideró un tamaño muestral de 638 animales (297 ovinos y 337 caprinos), tomando en cuenta un error del 5%, nivel de confianza del 95% y tasa de prevalencia esperada del 50%.
Material Biológico
Se colectaron muestras de sangre (7 ml) mediante venopunción de la yugular utilizando tubos al vacío sin anticoagulante (Vacutainer tapa roja). Las muestras fueron llevadas al Laboratorio de Parasitología Veterinaria de la Universidad Pedagógica y Tecnológica de Colombia (UPTC) donde fueron centrifugadas a 2500 rpm durante 10 min para la obtención del suero (Figueiredo Marques et al., 2017). La determinación de anticuerpos contra F. hepatica se realizó con el kit comercial ELISA BIO K 211 - Monoscreen AbELISA F. hepatica (Bio-X Diagnostics, Bélgica), siguiendo las indicaciones del laboratorio fabricante.
Variables
Las variables evaluadas fueron clasificadas en variables de manejo: tipo de pastoreo (extensivo, en estaca, rotacional, o mixto [extensivo rotacional]), fuente de agua para el consumo de los animales (acueducto, caño o quebrada), signos clínicos (diarrea), presencia de otras especies (bovinos), presencia de caracoles acuáticos del género Lymnaea; así como en variables relacionadas con el animal: sexo, grupo etario ((<1, 1-3, >3 años) y raza.
Análisis Estadístico
El estudio es de tipo descriptivo de corte transversal. Se trabajó como un muestreo aleatorio simple, donde los animales fueron seleccionados al azar. Los datos epidemiológicos fueron procesados con el programa EpiInfo®. Los factores determinantes fueron determinados mediante la Razón de Prevalencia (RP). La variable dependiente (Y) incluyó los resultados serológicos y las variables independientes (X) fueron los factores incluidos en la encuesta epidemiológica aplicada durante la toma de muestras. La asociación entre las variables y los resultados obtenidos se realizó con la prueba exacta de Fisher (Martinez et al., 2017). Los valores de RP que fueron superiores a 1 (intervalo de confianza inferior LCI 95% <1) y con p<0.05 se consideraron factores de riesgo, mientras que los valores de PR inferiores a 1 (intervalo de confianza superior UCI 95% <1) y con p<0.05 se consideraron factores de protección. Una vez establecidos estos factores, se realizó una regresión logística estratificada para probar la confusión e identificar la interacción simultánea entre las variables significativamente asociadas con fasciolosis (Martin et al., 1997).
RESULTADOS
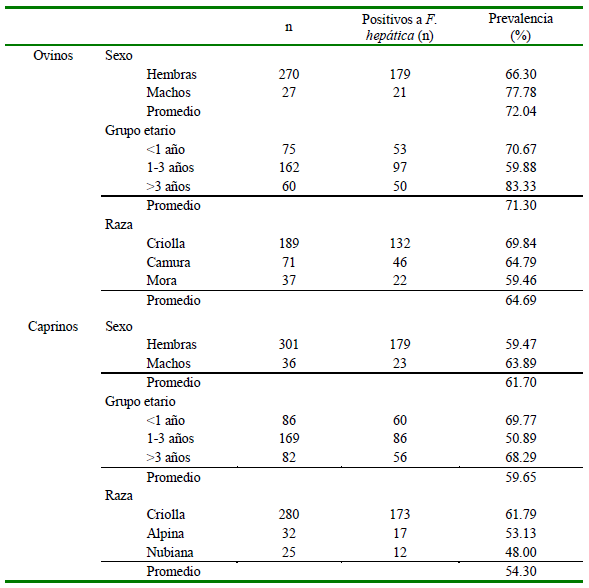
La seroprevalencia general de F. hepatica fue de 67.34% (200/297) en ovinos y de 59.94% (202/337) en caprinos. Asimismo, la seroprevalencia fue mayor en los machos (ovinos: 77.78%. 21/27; caprinos: 63.89%, 23/36), en ovinos mayores de 3 años (83.33%, 50/60) y en caprinos menores de 1 año (69.77%, 60/86), así como en los de raza criolla (ovinos: 69.84%; caprinos: 61.79%) (Cuadro 1).
Cuadro 1. Seroprevalencia de Fasciola hepatica determinada mediante la técnica de ELISA indirecto según el sexo, grupos etarios y razas en ovinos y caprinos de Boavita (Boyacá, Colombia)
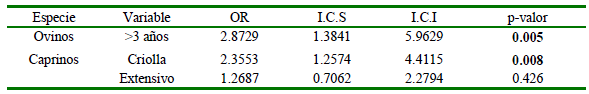
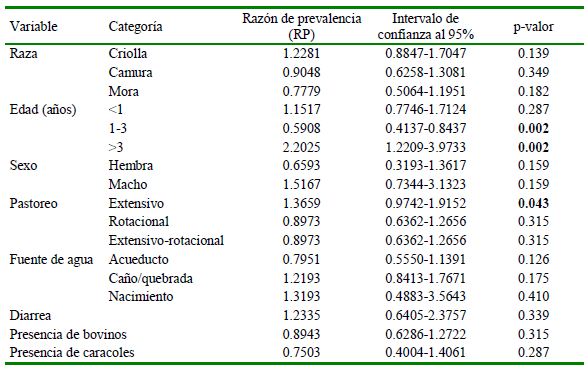
Se aplico Razón de Prevalencias (RP) como medida de asociación. Una RP>1 indica un mayor riesgo o posible factor de riesgo, mientras que una RP< 1 sugiere un menor riesgo a los individuos expuestos o posible factor de protección. La edad de ovinos fue un factor significativo, donde los animales mayores de 3 años (RP = 2.2025, p=0.002) y el pastoreo extensivo (RP = 1.3659, p=0.043) son posibles factores de riesgo, mientras que el grupo etario de 1-3 años (RP= 0.5908, p=0.002) es un posible factor de protección (Cuadro 2).
Cuadro 2. Posibles factores de riesgo asociados con las infecciones de fasciolosis en ovinos de Boavita (Boyacá, Colombia)
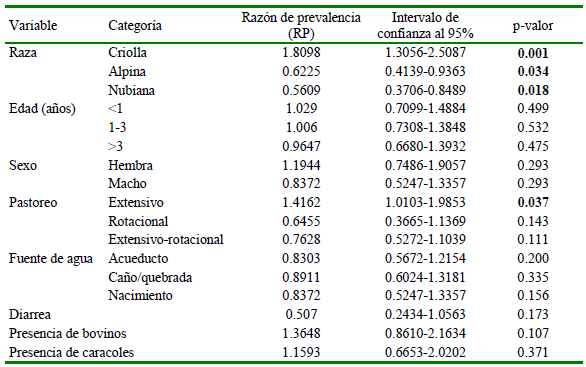
En cuanto los caprinos, la raza criolla (RP = 1.8098, p=0.001) es un posible factor de riesgo, mientras que las razas Alpina (RP = 0.6225, p=0.034) y Nubiana (RP = 0.5609, p=0.018) son posibles factores de protección. Respecto al pastoreo, el pastoreo extensivo (RP = 1.4162, p=0.037) se identificó como un posible factor de riesgo (Cuadro 3).
Cuadro 3. Posibles factores de riesgo asociados con las infecciones de fasciolosis en caprinos de Boavita (Boyacá, Colombia)
Los posibles factores de riesgo se analizaron mediante regresión logística, estableciéndose como factores de riesgo los ovinos >3 años y los caprinos de raza criolla y aquellos bajo pastoreo extensivo (Cuadro 4).
DISCUSIÓN
Los resultados indican una mayor prevalencia de fasciolosis en ovinos que en caprinos, datos que concuerdan con el estudio de Oljira et al. (2022) en Etiopía quienes encontraron más ovejas con el parásito en el hígado que en cabras (Oljira et al., 2022), así como en los estudios de Khanjari et al. (2014) y Ezatpour et al. (2015) en animales beneficiados en Irán. No obstante, en un estudio en México realizado por serología se encontraron seroprevalencias inferiores a las del presente estudio, siendo ligeramente mayores en caprinos (40.4%) que en ovinos (32.3%) (Munguía-Xóchihua et al., 2007).
La diferencia en las tasas de prevalencia entre ovinos y caprinos puede deberse al diferente comportamiento alimentario. Las metacercarias se ubican en las puntas de las hierbas (Mohammed et al., 2020), lo que hace más probable que el ganado ovino en pastoreo ingiera metacercarias de trematodos que las cabras, especie que prefieren ramonear en lugar de pastar (Jacquiet et al., 1992; Alstedt et al., 2022). Esto además explica que la infección crónica es más común en cabras que en ovejas, ya que la fasciolosis crónica se desarrolla más lentamente después de la ingestión de un bajo número de metacercarias durante periodos largos, en tanto que los ovinos tienden a ingerir altas cantidades de metacercarias por el tipo de comportamiento alimentario, lo cual genera una infección aguda (Kahl et al., 2021).
Si bien no hay muchos reportes de trabajos de fasciolosis mediante serología en pequeños rumiantes, los resultados de seroprevalencia del presente estudio fueron superiores al 50%, lo cual es bastante mayor a las presentadas en otros trabajos donde se usó también ELISA indirecto como diagnóstico. Así, Pinilla et al. (2019) reportaron seroprevalencias del 29.9% en ovejas en Colombia, Pérez-Creo et al. (2016) de 25.3% en España, y Utuk et al. (2012) de 16.2% en Turquía.
Los machos fueron los más sero-positivos en este trabajo; sin embargo, el sexo no se estableció como factor de riesgo. Si bien algunos estudios indican que los machos son más susceptibles en comparación con las hembras, posiblemente por diferencias en el manejo de estos en las producciones de pequeños rumiantes (Mir et al., 2013; Raza et al., 2013), en general se acepta que las hembras suelen ser más susceptibles por el estrés de la preñez, donde se compromete su sistema inmune, haciéndolas más susceptibles a infecciones parasitarias (Magaji et al., 2014; Najib et al., 2020). Es importante destacar que, en este estudio, la población de machos era considerablemente más pequeña en comparación con el número de hembras muestreadas, lo que podría haber influido en la tasa de seroprevalencia y en la detección de un posible factor de riesgo asociado al sexo.
El grupo etario en ovinos >3 años fue identificado como factor de riesgo, lo que concuerda con Rizwan et al. (2022) quienes encontraron una mayor incidencia de fasciolosis en animales adultos que en animales jóvenes, explicado por un mayor compromiso inmunitario del huésped, el contacto prolongado con los agentes infecciosos y la larga etapa inactiva en el huésped final (alrededor de 5 a 6 meses) (Hassan et al., 2019). No obstante, en los caprinos ocurrió algo diferente, y es que los animales <1 año fueron los más seropositivos, aunque sin llegar a identificar la edad como factor de riesgo. En este caso, es posible que una mayor tasa de infección en los animales más jóvenes podría deberse al bajo nivel de desarrollo de la inmunidad en esa etapa de vida (Rizwan et al., 2016).
Por otro lado, Boavita es una zona propicia con factores ambientales como la temperatura, la luz, la vegetación, la profundidad del agua, y la composición del suelo que permite la supervivencia de grandes poblaciones de caracoles competentes, facilitando el ciclo de vida del parásito, lo cual explicaría que se haya encontrado un alto nivel de seroprevalencia (Zerna et al., 2021). Es importante recordar que la dinámica de este parásito depende de tres factores principales para completar su ciclo epidemiológico: disponibilidad de hábitat adecuado para los caracoles, condiciones de temperatura y humedad ambiental para el crecimiento y desarrollo de formas evolutivas, y la presencia del caracol (Munguía-Xóchihua et al., 2007; Pinilla et al., 2019).
En esta investigación el pastoreo extensivo fue establecido como factor de riesgo en caprinos y ovinos, lo cual es interesante, si se considera que las cabras tienden a ramonear en lugar de pastorear. No obstante, se dispone de estudios que cabras al pastoreo tienden a infectarse con F. hepatica , especialmente cuando no se realiza una adecuada rotación de las praderas (Olsen et al., 2015; Pilarczyk et al., 2021).
En cuanto a los caprinos la raza criolla se identificó como factor de riesgo, lo cual concuerda con otros estudios que han evidenciado diferencias en la susceptibilidad a la infección por Fasciola hepatica entre diferentes razas de animales. Sin embargo, algunas investigaciones han sugerido que las razas autóctonas pueden manifestar una cierta resistencia natural al parásito, lo que se refleja en una menor carga parasitaria. En particular, se ha observado que la raza Cabra Galega presenta valores de seroprevalencia más bajos en comparación con otras razas (Pérez-Creo et al., 2016). A pesar de esto, la raza criolla es más predominante en la zona lo que podría haber aumentado la probabilidad de detectar seropositivos, influyendo posiblemente en su identificación como factor de riesgo. Es por esto que se requieren investigaciones adicionales para comprender la asociación observada en este estudio y su aplicabilidad en otras poblaciones o condiciones ambientales.
CONCLUSIONES
La seroprevalencia general de F. hepatica fue de 67.34% (200/297) en ovinos y de 59.94% (202/337) en caprinos.
La seroprevalencia fue mayor en los machos (ovinos: 77.78%. 21/27; caprinos: 63.89%, 23/36), en ovinos mayores de 3 años (83.33%, 50/60) y en caprinos menores de 1 año (69.77%, 60/86), así como en los de raza criolla (ovinos: 69.84%; caprinos: 61.79%)
Los ovinos mayores de 3 años se determinaron como factor de riesgo mientras que en las cabras la variable de raza criolla se identificó como factor de riesgo.












 uBio
uBio