INTRODUCCIÓN
El dimorfismo sexual representa una fuente importante, aunque a veces pasada por alto, de variación intraespecífica, sobre la cual pueden actuar tanto la selección sexual como la natural (Lande 1980). Las implicaciones de la divergencia morfológica basada en el sexo son aún más importantes cuando los rasgos involucrados son funcionalmente importantes (Shaffer et al., 2001; McGee y Wainwright, 2013). Las evaluaciones comparativas del dimorfismo de forma son menores en número, pero enfatizan cómo la diferenciación específica del sexo y las características morfológicas pueden servir como un componente integral para patrones más grandes de diversidad (Sanger et al., 2013; Kaliontzopoulou et al., 2015).
El dimorfismo sexual de las aletas pectorales de las rayas se ha documentado en varias especies (Oddone y Vooren, 2004; Ebert y Bizzarro, 2007; Orlov y Cotton, 2011; Martinez et al., 2016b). Actualmente no hay evidencia de que el dimorfismo pectoral esté asociado con factores ecológicos como la utilización del hábitat específica del sexo o las diferencias en la movilidad. Más bien, se sugiere que es causado por el desarrollo de claspers (Martinez et al., 2016b).
Los claspers evolucionaron a partir de modificaciones en las aletas pélvicas y se consideran una de las principales sinapomorfias que caracterizan a los peces condrictios (Grogan y Lund, 2004). Sin embargo, existe una variación considerable en el tamaño relativo y la morfología de los órganos entre clados. Se han identificado dos morfotipos de clasper en batoideos, una forma alargada que tiene forma deprimida distalmente y se encuentra principalmente en Rayiformes y una forma acortada y más cilíndrica que ocurre principalmente en rayas del orden Myliobatiformes (McEachran y Aschliman, 2004).
La investigación sobre el dimorfismo presente en los batoideos sugiere que la variación morfológica en las rayas podría estar subestimada, lo que sugiere una mayor diversidad de estilos de vida de lo que se conoce actualmente (Martinez et al., 2016a). La presencia de dimorfismo en una parte funcionalmente vital del plan corporal de la raya, pues sus aletas pectorales la convierten en un recurso prometedor para mejorar la comprensión de la diversidad del grupo. Estudios anatómicos comparativos de claspers en rayas se limitan principalmente al orden Rayiformes, ya que la estructura esquelética y externa del clasper es muy útil en su identificación y ayuda a aclarar sus interrelaciones (Weigmann et al., 2014). Recientemente, se ha publicado una cantidad considerable de artículos que describen nuevos taxones de potamotrygonides, muchos de los cuales incluyen descripciones de sus claspers, pero sin una investigación descriptiva más exhaustiva (Silva y Carvalho, 2015; Carvalho y Araújo, 2016; Fontenelle y Carvalho, 2017).
Los Potamotrygonidae son un grupo de rayas de agua dulce que consta de cuatro géneros (Heliotrygon, Paratrygon, Plesiotrygon y Potamotrygon) y al menos 25 especies (Lasso et al., 2014). Si bien se desconocen descripciones detalladas sobre el desarrollo y la morfología de los clasper en especies de esta familia, los conocimientos sobre el dimorfismo sexual de las aletas pélvicas en ejemplares juveniles y adultos son escasos en la región del Nordeste Argentino. Ante esto, el objetivo del presente trabajo fue la descripción y caracterización de la morfología externa y los componentes esqueléticos del clasper de Potamotrygon motoro a fin de comprender su variación morfológica y su utilidad como herramienta en la determinación del dimorfismo sexual a partir de un análisis morfológico en diafanizaciones de aletas pélvicas de individuos juveniles y adultos.
MATERIALES Y MÉTODOS
Los muestreos fueron realizados quincenalmente entre septiembre a diciembre de 2021 en cuerpos de aguas lóticos cercanos a la ciudad de Corrientes, 10 km en dirección NE (Paraje Perichón: 27° 26' 36.6" S -58° 45' 14.0" W), Argentina. Fitogeográficamente, el sitio de muestreo se ubica en el Chaco Húmedo (Cabrera, 1976). El clima es subtropical o mesotermal (Carnevali, 1994), con un gradiente de temperatura media anual que oscila de norte a sur entre los 21 y 19.5 ºC, siendo enero el mes más cálido (media anual: 27 ºC) y julio el mes más frío (media anual; 14 ºC).
Se efectuó la captura manual de tres individuos juveniles (2 machos y 1 hembra) y dos adultos (1 macho y 1 hembra) de Potamotrygon motoro, provenientes del rio Paraná, provincia de Corrientes. Para el sexado se tuvo en cuenta la presencia de claspers en los machos. Los animales fueron traslados al laboratorio en bolsas plásticas, donde se procedió a la eutanasia con sobredosis de lidocaína al 0.2%, siguiendo el protocolo establecido en la Guía para la Eutanasia Animal propuesta por la IACUC (The Institutional Animal Care and Use Committee) bajo las normas del Comité de Ética de la Facultad de Ciencias Veterinarias de la Universidad Nacional del Nordeste (UNNE) (Underwood et al., 2013), Resolución N.° 471/2009-CD.
Para el análisis macroscópico de las aletas pélvicas de los ejemplares capturados se procedió a su disección y observación bajo microscopio estereoscópico, aislando las aletas pélvicas y región caudal. Los ejemplares juveniles y las aletas y región caudal de los ejemplares adultos fueron fijados en formol al 10% con pH 7.4. Se siguió la técnica convencional de diafanización (Figura 3B, D), para lo cual se retiró piel y órganos internos de las muestras, sin afectar el material, seguido de inmersión en una solución de Azul Alcián por dos días para la coloración de los elementos cartilaginosos. Luego se realizó un baño en alcohol al 96% durante no menos de 4 h, y tinción por dos días con una solución de Rojo de Alizarina para evidenciar los elementos óseos. Para la transparentación se dejó los ejemplares en una solución de hidróxido de potasio hasta observar las estructuras óseas y cartilaginosas. Finalmente, el material fue conservado en glicerol para su observación y fotografiado en microscopio estereoscópico.
RESULTADOS
En las hembras juveniles se pueden observar aletas pélvicas sin presencia de claspers (Figura 1 A,C). Por otro lado, en el caso de los machos juveniles se pudo observar un pequeño par de lóbulos laterales a la cola y posteriores a las aletas pélvicas, que corresponden a los claspers (Figura 1 B,D). Asimismo, mediante la tinción con azul alcián fue posible diferenciar la formación de los segmentos intermedios que se originan posteriores al basipterigio y que son seguidos por el cartílago axial (Figura 2 B,D). En las hembras, esta estructura no está presente, y suele desarrollarse el eje del basipterigio con una segmentación en la zona posterior (Figura 2 A,C). Sin embargo, en los machos, los claspers muestran un desarrollo más significativo de los cartílagos (Figura 2D), donde el basipterigio se modifica en su extremo posterior, originando el mixopterigio o clasper.
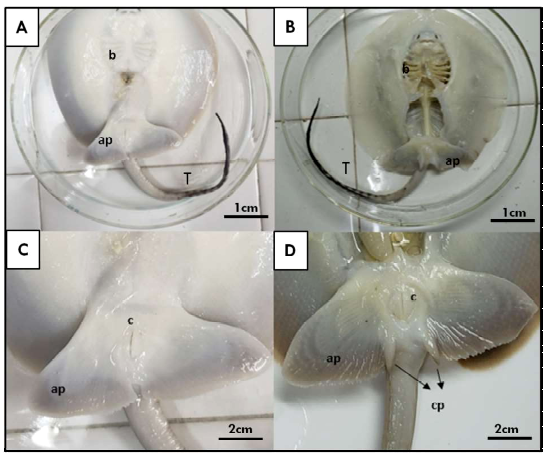
Figura 1. Imagen macroscópica panorámica de ejemplares Potamotrygon motoro. A) Juvenil hembra con (C) detalle a nivel de la región caudal; B) Juvenil macho con (D) detalle de la región caudal y el clasper. ap: aleta pélvica; b: branquias; c: cloaca; cp: clasper; rc: región cefálica
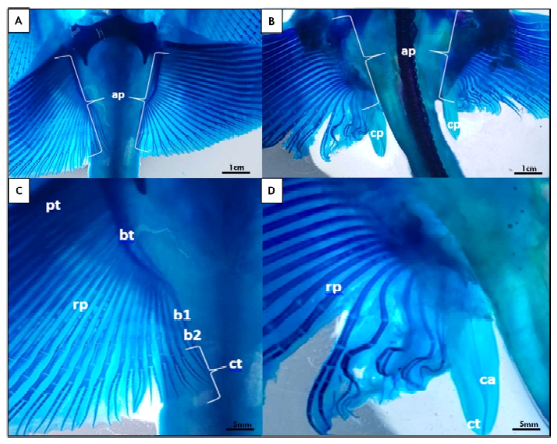
Figura 2. Imagen macroscópica panorámica diafanizada de ejemplares Potamotrygon motoro. A) Juvenil hembra con detalle (C) a nivel de la región caudal; B) Juvenil macho con detalle (D) de la región caudal y el clasper. ap: aleta pélvica; bt: basipterigio; b1: primer segmento basal; b2: segundo segmento basal; cp: clasper; ct: cartílago terminal; pt: propterigio; rp: radiales pélvicos
La conformación de la aleta pélvica en las hembras adultas no mostró modificaciones respecto a la observada en los juveniles (Figura 3 A,B), mientras que en los machos se observaron los claspers completamente desarrollados, sobrepasando el borde posterior de la aleta pélvica con lóbulos conspicuos y prominentes (Figura 3C,D). En el esqueleto diafanizado se pudo evidenciar que el cartílago axial se ubica medialmente a lo largo del clasper, extendiéndose hasta el cartílago terminal, con un extremo distal no calcificado con una punta delgada (Figura 3D). Los cartílagos marginales dorsal y ventral forman el surco espermático lateral y se extienden casi en toda la longitud del cartílago axial. El cartílago marginal dorsal es una estructura plana en forma de varilla (Figura 3D).
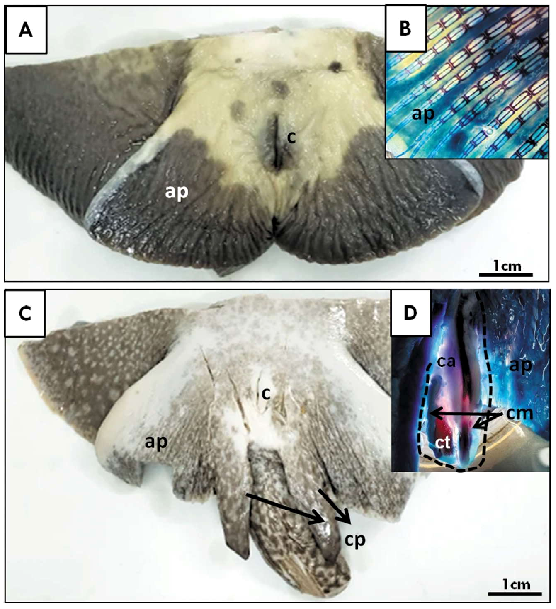
Figura 3. Imagen macroscópica panorámica de ejemplares Potamotrygon motoro. A) Adulto hembra con detalle diafanizado a nivel de la región caudal (B); C) Adulto macho con detalle diafanizado de la región caudal y el clasper (D). ap: aleta pélvica; ca: cartílago anterior; cm: cartílago medial; cp: clasper; ct: cartílago terminal
Los clasper tienen un cartílago axial alargado, delgado y ligeramente curvado distalmente. El segmento basal 1 conecta el cartílago axial con el basipterigio y el segmento basal 2 se articula con la parte proximal del cartílago axial. El cartílago beta es alargado, se estrecha distalmente y se extiende desde el segmento basal 1 hasta cerca de la mitad de la longitud del cartílago axial. El cartílago dorsal terminal 2 es rectangular y aplanado, con un surco en la región proximal. Los bordes exteriores de los cartílagos dorsal marginal y dorsal terminal 2 delimitan externamente el surco del clasper. El margen interno de la parte posterior del cartílago marginal dorsal delimita externamente el pseudosifón. El cartílago ventral terminal es grande y de forma rectangular a ovalado. El cartílago marginal ventral es largo y estrecho con un extremo posterior puntiagudo. El cartílago terminal accesorio es arqueado y fusiforme, delimitando su borde exterior externamente el pseudosifón ventral (Figura 4 A,B).
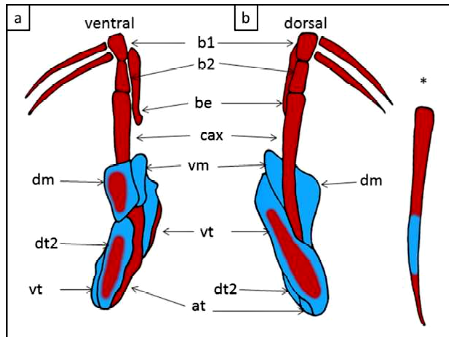
Figura 4. Potamotrygon motoro. Vistas dorsal y ventral de estructuras esqueléticas clasper. La coloración diferencial muestra elementos cartilaginosos (azul) y óseos (rojo). at: terminal de accesorios; ax: cartílago axial; be: â-cartílago; b1: segmento basal 1; b2, segmento basal 2; dm: cartílago marginal dorsal; dt2: cartílago dorsal terminal 2; vm: cartílago marginal ventral; vt: cartílago terminal ventral
DISCUSIÓN
El presente trabajo aporta información sobre el vínculo entre la presencia de dimorfismo sexual en Potamotrygon motoro desde el estadio juvenil hasta los individuos adultos, brindando información de este patrón morfológico con un evento importante en la evolución de la biología reproductiva de los batoideos.
Los resultados permiten inferir que los claspers de P. motoro son similares a algunos myliobatiformes al tener una morfología externa corta, robusta y cilíndrica (Aschliman et al., 2012). El cartílago marginal dorsal con un reborde medial y el cartílago terminal dorsal en la superficie del cierre ventral descrito aquí, también se informan en rinopristiformes y myliobatiformes (Aschliman et al., 2012, Moreira et al., 2018). El cartílago terminal ventral situado dorsolateralmente en el clasper de todas las rayas eléctricas es identificado como terminal 3 por Jungersen (1899), Ishiyama (1958) y Hulley (1972) como terminal accesorio 1 y por McEachran y Aschliman (2004). En el presente trabajo se pudieron identificar dichos elementos en los individuos adultos, mientras que en los juveniles solo se logró diferenciar el cartílago terminal dorsal.
Se ha propuesto que el rápido alargamiento de los cartílagos del clasper en las rayas machos y, en particular, sus efectos en el desarrollo de otras características esqueléticas, es el factor subyacente del dimorfismo de la aleta pectoral (Martinez et al., 2016b). De acuerdo con otros trabajos, los individuos inmaduros de Fenestraja plutonia son similares en morfologías de aletas, pero divergen en la maduración debido principalmente al cambio de forma del macho (Figura 3C). Esto mismo fue observado en los ejemplares de P. motoro del presente estudio.
Si bien existe una creciente evidencia de que la aparición del dimorfismo sexual a partir de las aletas pélvicas en las rayas está relacionada con la presencia de cartílagos alargados que conforman el clasper, no está completamente claro la causa de variación en la magnitud de las diferencias de forma entre hembras y machos entre especies. Un estudio sobre los perfiles de crecimiento de clasper en siete especies de rayas mostró diferencias sustanciales en las tasas de crecimiento de clasper con el tamaño corporal (Sosebee, 2005). Si bien fue notorio el alargamiento del clasper en la especie en estudio, dichas diferencias no pudieron ser evidenciadas en el presente trabajo entre juveniles y adultos.
Si bien se ha publicado un número considerable de artículos sobre la morfología del clasper en condrictios (Carvalho, 2016; Fontenelle y de Carvalho, 2017; Moreira et al., 2017, 2018), datos sobre las estructuras de los claspers en especies de batoideos en individuos juveniles y adultos son escasos, por lo que el presente trabajo es un aporte a la historia natural de los batoideos de agua dulce.
CONCLUSIONES
Los claspers de Potamotrigon. motoro son similares a algunos myliobatiformes en tener una morfología externa corta, robusta y cilíndrica.
En especímenes juveniles solo se logró diferenciar el cartílago terminal dorsal, mientras que en los adultos se diferenciaron todos los elementos encontrados en otras especies de rayas.












 uBio
uBio 


