INTRODUCCIÓN
Cuniculus paca es un roedor terrestre que habita los bosques neotrópicos de centro y Suramérica, con características territoriales, solitario y de vida nocturna, que se alimenta principalmente de frutas (Ramírez y Hernandez, 2012). Esta especie es conocida vulgarmente como la guagua, lapa, paca, boruga, tepezcuintle, entre otros (Asprilla-Perea et al., 2011). Se encuentra en riberas de los ríos, zonas de bosques húmedos y páramos; pero también se le puede encontrar en pastizales, manglares y áreas agrícolas (Aquino et al., 2009).
Es un roedor con gran importancia en aspectos económicos, ya que es una de las especies más comercializadas y codiciadas debido a la calidad de su carne (Cirignoli y Varela, 2019), siendo parte de las denominadas «carnes de monte» (Quiceno et al., 2015; Gómez y Van Vliet, 2018). Asimismo, este mamífero tiene un gran valor ecológico y científico al ser dispersor de semillas, estabilizador del suelo (Silva et al., 2011) y un modelo experimental en investigaciones científicas, debido especialmente a su adaptación al cautiverio (Castelo, 2015).
Debido a su importancia nutricional y ambiental, se hace necesario proteger y conservar esta especie, que, aunque su población no se considera en peligro crítico (Emmons y Reid, 2016), su número se ha reducido debido a la caza ilegal y la deforestación de su hábitat (Ferreguetti et al., 2018). En este sentido, los bancos de germoplasma animal se convierten en un soporte y herramienta para la conservación de material germinal (semen y embriones), bajo condiciones de ultracongelación (Martínez et al., 2005). Dichos bancos contribuyen al uso de las biotecnologías reproductivas como una buena herramienta para el manejo y preservación de animales domésticos y silvestres, en especial en aquellos cuya recolección de semen es un procedimiento exigente que no siempre tiene éxito (Assumpção, 2017). En muchas ocasiones, la baja calidad del semen criopreservado limita su utilización (Ball,2008) por factores como el tipo de diluyente o el crioprotector (Rivera, 2020). En estas situaciones, se suelen utilizar técnicas de separación o selección seminal para mejorar la calidad del esperma, al eliminar espermatozoides muertos o con alteraciones que tienden a reducir la viabilidad del semen (Johannisson et al., 2009).
Al parecer, no se han reportado investigaciones previas relacionadas con la separación de espermatozoides de Cuniculus paca. En consecuencia, se hace necesario el desarrollo de estudios en este campo, que permitan mejorar e implementar procesos de reproducción asistida, con miras a aumentar las tasas de fertilización para la especie, permitiendo la exploración de su potencial zootécnico (Gurgel et al., 2018). Con base en lo anterior, el objetivo de este estudio fue evaluar el efecto de la separación espermática sobre la calidad de semen criopreservado de Cuniculus paca.
MATERIALES Y MÉTODOS
Se utilizaron 60 pajillas con 0.5 mL de semen criopreservado en un medio tris-yema de huevo-glicerol de Cuniculus paca, provenientes del banco de germoplasma del Laboratorio de Reproducción Animal de la Universidad Nacional de Colombia Sede Medellín. Las pajillas fueron descongeladas en un baño de agua a 37 °C durante 60 segundos, y el semen recuperado fue sometido a los procedimientos de separación y evaluación espermática que se describen a continuación:
Separación Espermática
Para este proceso se descongelaron simultáneamente tres pajillas de semen, cuyo volumen fue distribuido en dos alícuotas. La primera alícuota se utilizó para un tratamiento de separación espermática por centrifugación con gradiente de densidad de una capa (SLC). El semen descongelado se depositó en un tubo falcón de 15 mL y se agregó en el fondo del tubo 0.5 mL de CushionFluidTM (Minitube, Alemania). El tubo se llevó a centrifugación a 600 g durante 20 min (Sorvall ST 16R, Thermo Scientific, USA). Luego, se eliminó el sobrenadante y los espermatozoides fueron suspendidos con 500 µL de Triladyl (Minitube, Tiefenbach, Alemania). La segunda alícuota no fue sometida al proceso de separación a modo de tratamiento control. Todos los procedimientos se realizaron a temperatura ambiente (~20 °C).
Evaluación de la Calidad Seminal
Movilidad y cinética espermática CASA
La movilidad espermática se evaluó mediante un sistema computarizado de análisis de semen (CASA, IVOS - Hamilton Thorne, USA), en el cual se analizaron la movilidad total (MT), movilidad progresiva (MP), velocidad rectilínea (VSL), velocidad curvilínea (VCL), velocidad media (VAP), amplitud del desplazamiento lateral de la cabeza (ALH), frecuencia de batida (BCF), índice de rectitud, linealidad (LIN) y espermatozoides rápidos (RAP). Para ello, se depositó una gota de 5 µL de la muestra en un portaobjetos, la configuración de análisis del sistema fue 45 cuadros a 60 Hz a temperatura de 37 °C y la especie elegida fue cerdo, debido a la similitud en el tamaño de los espermatozoides, y a que el sistema CASA no tiene una configuración específica para Cuniculus paca. Sin embargo, se verificó que las partículas analizadas correspondieran a células espermáticas. Se analizó un mínimo de 500 espermatozoides por muestra.
Integridad funcional de la membrana plasmática
La evaluación de la integridad funcional de la membrana plasmática se realizó por la metodología modificada de la prueba hiposmótica (HOST) reportada por Neild et al. (1999). Para ello se mezcló 20 µL de semen con 200 µL de solución hiposmótica, y se incubó a 37 °C durante 30 min. Posteriormente, se colocó 20 µL de la mezcla en un portaobjetos y se evaluó la reacción de 100 espermatozoides (enrollamiento de la cola), en al menos 5 campos de observación (400X) de un microscopio (Axiostar Plus, Zeiss, Alemania).
Vitalidad espermática
La vitalidad espermática (VE) se determinó por microscopía de fluorescencia mediante el procedimiento descrito por Gamboa et al. (2010), con el kit Live/Dead (Molecular Probes Inc, USA). Para ello, 50 µL de semen se depositaron en un tubo Eppendorf para 1.5 ml, se adicionó 0.3 µL de SYBR-14 y se incubó a 37 °C por 8 min. Luego, se agregó 0.3 µL de yoduro de propidio y la muestra se incubó nuevamente a 37 °C durante 8 min. Después de la incubación, la VE se analizó mediante microscopía de fluorescencia (400X) a longitudes de onda entre 550 y 595 nm (T670Q-PL-FL, AmScope, USA). Se tomó 5 µL de la muestra y se evaluaron 100 espermatozoides que fueron clasificados como vivos (fluorescencia verde) o como muertos (fluorescencia roja).
Evaluación de la morfología
La morfología espermática se evaluó mediante la metodología de Cabrera y Pantoja (2012). Sobre un portaobjetos atemperado a 37 °C en una platina térmica, se depositó una gota de semen y una gota de eosina-nigrosina (Merck KGaA, Alemania). Ambas gotas se mezclaron durante 30 s y se realizó un extendido el cual se secó sobre una platina térmica a 37 °C. Posteriormente, se evaluó la morfología individual de 100 espermatozoides a 1000X en un microscopio (Axiostar Plus, Zeiss, Alemania). Los espermatozoides se clasificaron como normales o anormales, estableciéndose las proporciones de alteraciones morfológicas de la cabeza, pieza intermedia y cola (Santos et al., 2020).
Integridad del acrosoma
Para la evaluación de la integridad del acrosoma se usó la sonda fluorescente FITCPNA (Sigma-Aldrich, USA), mediante el procedimiento descrito por Mendoza et al. (1992). Se realizó un extendido con 20 µL de semen sobre un portaobjetos, para su fijación se utilizó alcohol etílico al 70% dejándolos secar por 5 min a temperatura ambiente (~20 °C). Posteriormente, se adicionó 10 µL de FITC-PNA sobre el extendido, y se incubó en la oscuridad durante 30 min. Finalmente, se evaluó el acrosoma de 100 espermatozoides en un microscopio de fluorescencia (T670Q-PL-FL, AmScope, USA). Se clasificaron como intactos los acrosomas completamente fluorescentes de color verde, mientras que la ausencia de fluorescencia en la región acrosomal o la presencia de una banda fluorescente verde en el límite entre el acrosoma y la cubierta pos-acrosomal se clasificaron como acrosomas no intactos.
Diseño Experimental y Análisis Estadístico
Se utilizó un diseño completamente al azar. Se utilizaron 60 pajillas de semen congelado. Para cada repetición se usaron tres pajillas, por lo que cada tratamiento contó con 20 unidades experimentales Se ajustó un modelo lineal para cada variable dependiente, donde se incluyeron los efectos fijos del tratamiento y de la muestra. Se evaluó la normalidad de las variables mediante la prueba de Shapiro-Wilk. Se compararon las medias por la prueba de Tukey. Se estableció un valor p<0.05. Todos los análisis se realizaron mediante el software SAS v. 9.2 (SAS Inst. Inc., USA).
RESULTADOS
Los resultados obtenidos para la movilidad y cinética espermática se presentan en el Cuadro 1. Se observa que la separación espermática (SLC) influye sobre las características de movilidad y cinética de los espermatozoides congelados y descongelados de C. paca, dado que SLC produjo mayor proporción de espermatozoides móviles totales y lineales, mientras que el control mostró un valor superior para la velocidad curvilínea (p<0.05).
Cuadro 1. Movilidad y cinética de espermatozoides de Cuniculus paca (n=20)
| Variable | Control | Centrifugación con gradiente de densidad de una capa (SLC) |
|---|---|---|
| Movilidad total | 30.40 ± 2.63 b | 53.30 ± 6.97 a |
| Movilidad progresiva | 18.25 ± 1.40 | 16.25 ± 2.04 |
| Velocidad media | 54.96 ± 3.17 | 46.05 ± 4.49 |
| Velocidad rectilínea | 50.55 ± 2.94 | 43.07 ± 4.12 |
| Velocidad curvilínea | 82.14 ± 4.74 a | 65.11 ± 6.72 b |
| Amplitud lateral de la cabeza | 3.70 ± 0.19 | 3.29 ± 0.13 |
| Frecuencia de batida | 36.92 ± 0.70 | 37.47 ± 0.79 |
| Índice de rectitud | 90.8 ± 1.11 | 93.20 ± 0.86 |
| Linealidad | 62.05 ± 1.86 b | 68.90 ± 1.90 a |
| Espermatozoides rápidos | 18.95 ± 1.41 | 16.85 ± 2.13 |
Los resultados se presentan como media ± error estándar. Las medias con diferentes superíndices dentro de una misma fila presentaron diferencias significativas (p˂0.05)
La Figura 1 muestra los resultados de la evaluación de los parámetros asociados con la integridad y funcionalidad de la membrana plasmática y acrosomal. Se encontró una mejora significativa en la proporción de espermatozoides viables con el tratamiento SLC, así como un incremento en la proporción de espermatozoides con membrana funcional en comparación con el control. Por otro lado, la separación espermática no influyó sobre la proporción de espermatozoides con acrosoma estructuralmente intacto.
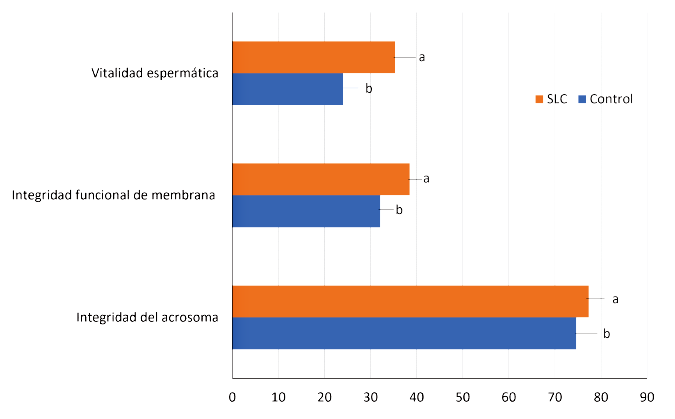
Figura 1. Evaluación de la membrana plasmática de espermatozoides de Cuniculus paca (n=20). SLC: Centrifugación con gradiente de densidad de una capa. Los resultados se presentan como media ± error estándar. Las medias con diferentes superíndices dentro de una misma fila indican diferencias significativas (p<0.05)
Los resultados para la morfología espermática del semen congelado y descongelado no indican una influencia significativa del método SLC sobre la proporción de espermatozoides de C. paca con alteraciones morfológicas de la cabeza, pieza intermedia y cola, o sobre el total de espermatozoides con morfología normal (Cuadro 2).
Cuadro 2. Evaluación morfológica de los espermatozoides de Cuniculus paca (n=20)
| Variable | Control | Centrifugación con gradiente de densidad de una capa (SLC) |
|---|---|---|
| Anormalidades de cabeza | 6.10 ± 0.47 | 6.90 ± 0.67 |
| Anormalidades de pieza intermedia | 1.90 ± 0.40 | 2.80 ± 0.38 |
| Anormalidades de cola | 3.15 ± 0.46 | 3.50 ± 0.63 |
| Morfología normal | 88.85 ± 0.96 | 86.80 ± 1.13 |
Los resultados se presentan como media ± error estándar. No se hallaron diferencias significativas (p>0.05)
DISCUSIÓN
Los métodos de separación espermática se utilizan para eliminar el plasma seminal, el crioprotector, los espermatozoides indeseables y los desechos con el fin de mejorar las características de calidad del esperma (Rodríguez et al., 1997). En la presente investigación se halló un incremento de la movilidad total de los espermatozoides de C. paca después del uso de un método de separación SLC. Otros investigadores han realizado estudios con semen fresco y criopreservado de esta especie, y otras especies del género Cuniculus (también denominado Agouti) (Hoyos et al., 2001; Mollineau et al., 2008; Silva et al., 2011). Sin embargo, no se pudo encontrar estudios equivalentes con la implementación de separación espermática o el uso de sistemas computarizados para la evaluación de la movilidad y la cinética espermática.
Los resultados obtenidos en el presente estudio muestran la capacidad del método SLC para separar células móviles de las inmóviles, siendo la movilidad un parámetro que se ha asociado con la criotolerancia y la fertilidad del semen de otras especies (Davila et al., 2016; Wasilewska y Fraser, 2017). Sin embargo, la progresividad de los espermatozoides no se vio influenciada por el método de separación; aunque puede considerarse que los valores para este parámetro en semen descongelado de C. paca fueron satisfactorios, tomando como referencia el resultado de MP del 12%, reportado en un estudio previo de Mollineau et al. (2010).
El efecto favorable observado en la linealidad de los espermatozoides por la separación SLC, genera interés considerando que dicho parámetro se ha asociado con la progresión de los espermatozoides a través del tracto reproductivo de la hembra (Grieblová et al., 2017); así como con la capacitación espermática y la penetración de las barreras de fertilización que rodean al ovocito, como las capas de células del cúmulo y la zona pelúcida (Gadea, 2005). Sin embargo, la reducción observada en VCL es contraria al mejoramiento esperado en la cinética espermática posterior al desarrollo de procesos de separación con coloides (Macías-García et al., 2009). Respecto al método de separación seleccionado, se ha encontrado en estudios con semen de otras especies, que el uso de Cushion Fluid para la separación SLC, produce mejores resultados en la movilidad y cinética espermática, que otros productos para SLC y métodos alternativos de separación por centrifugación con gradientes de densidad (DGC) (Nicolás et al., 2012; Varela et al., 2015).
El método de separación permitió obtener muestras de semen con mayor proporción de espermatozoides con membrana plasmática íntegra a nivel funcional y estructural (vitalidad) (Figura 1). Resultados similares han sido reportados en bovinos (Arias et al., 2017) y búfalos (Abbel-Razek et al., 2017) con otros métodos de separación espermática. Dicho efecto se atribuye a la capacidad de la separación con coloides para eliminar aquellos espermatozoides muertos o con alteraciones que pueden afectar a los demás espermatozoides, reduciendo su viabilidad (Johannisson et al., 2009). Sin embargo, se conoce que los espermatozoides reducen su viabilidad e integridad funcional de membrana durante la criopreservación (Kozdrowski et al., 2006). En el presente estudio estos parámetros estuvieron por debajo del 40%, en comparación con estudios con semen fresco, con resultados de vitalidad de 73.7% (Mollineau et al., 2008), de 66.0% (Ferraz et al., 2011) y de 83.8% (Santos et al., 2020); así como de integridad funcional de membrana de 42.0% (Ferraz et al., 2011).
Solo los espermatozoides con acrosomas intactos normales pueden sufrir la reacción acrosómica, que es esencial para que los espermatozoides penetren en la zona pelúcida (Abbel-Razek et al., 2017). Una muestra de esperma normal debe contener una alta proporción de espermatozoides con acrosomas intactos capaces de sufrir reacción acrosómica después de la incubación en condiciones de capacitación (Takahashi et al., 1992). En el presente estudio se encontró un alto porcentaje de espermatozoides con acrosoma intacto, sin diferencias entre las muestras sometidas a separación SLC respecto al control. De forma contraria, se ha reportado que al seleccionar espermatozoides bovinos en una columna de Percoll se acelera el proceso de reacción acrosómica (Gardón et al., 2001), mientras que, en equinos se reportó que el método SLC con Cushion Fluid es superior a otros métodos de separación para la obtención de espermatozoides con acrosomas intactos (Varela et al., 2015).
La centrifugación utilizada en los métodos de separación puede ocasionar daños en los espermatozoides (Johannisson et al., 2009). Así mismo, se conoce que los espermatozoides de los roedores son muy sensibles a las fuerzas centrífugas, que pueden causar o promover daños mecánicos, estructurales, cambios en el acrosoma, y una reducción sustancial de la motilidad (Silva et al., 2011). El Cuadro 2 muestra que en el presente estudio no se presentaron alteraciones en la morfología espermática, pero tampoco hubo una mejora en la proporción de espermatozoides morfológicamente normales obtenidos a través del método de separación SLC, como se ha reportado en otros estudios (Cunha dos Santos et al., 2017). Sin embargo, los resultados obtenidos en este estudio fueron mayores a los reportados por Santos et al. (2020) con 73% de espermatozoides normales en semen epididimal de C. paca. En ambos estudios, la mayor proporción de anormalidades se presentó en la cabeza de los espermatozoides.
CONCLUSIONES
La centrifugación con gradiente de densidad de una capa (SLC) de semen congelado-descongelado de Cuniculus paca permite obtener muestras con características de calidad espermática superiores (movilidad, linealidad e integridad estructural y funcional de membrana plasmática), lo que podría favorecer su utilización en procesos de conservación de la especie mediante métodos de reproducción asistida.












 uBio
uBio 

