INTRODUCCIÓN
El acopio total de leche en Colombia en 2018 fue de 3.146 millones de litros, lo que sitúa al país como el cuarto productor en América Latina (Asoleche, 2019). La leche es un producto esencial en la alimentación humana debido a su alto contenido nutricional, pero requiere estar libre de microorganismos por su impacto en la salud pública. La pasteurización de la leche cruda inactiva estos agentes microbianos contaminantes (Machado et al., 2017).
El aumento de la carga microbiana en la leche cruda está asociada a diversas variables geográficas y ambientales. La temperatura, humedad, calidad del aire y del agua, tipo de forraje, tamaño del hato, el sistema de ordeño y las condiciones de almacenamiento pueden generar cambios en la morfología de la ubre y en la microbiota de la glándula mamaria del bovino (Ouamba et al., 2022).
Los microorganismos asociados a la leche cruda que se encuentran con mayor frecuencia son: Enterococcus spp, Staphylococcus coagulasa negativa, Aerococcus spp, Streptococcus spp, Acinetobacter spp, Bacillus spp, Enterobacter spp, Corynebacterium spp, Kocurias spp, Pseudomonas spp, Listeria spp, Salmonella spp, Escherichia coli (Quigley et al., 2013). El desarrollo de estas bacterias se convierte en un factor nocivo en la salud de la ubre, dada la capacidad de crear resistencia a diferentes agentes antimicrobianos o formar biopelículas. Esta última se define como una comunidad bacteriana englobada en una matriz de exopolisacáridos con capacidad de adherirse a una superficie viva o inerte (Carniello et al., 2018).
Nuevas moléculas naturales con propiedades terapéuticas, conocidas como péptidos antimicrobianos (AMPs), pueden favorecer la erradicación de la formación de biopelícula, como lo son los péptidos derivados de la catelecidina humana LL-37 y sus análogos con modificaciones estructurales en el grupo amino terminal denominado (ACLL-37), y un enantiómero (DLL-37), con dos fenilalaninas en los extremos de la secuencia del péptido (Kusaka et al., 2018; Torres et al., 2019). Los D-péptidos son resistentes a la degradación proteolítica debido a una barrera energética libre extremadamente alta, dada por una incompatibilidad estérica y por un estado de transición del complejo enzima-sustrato, siendo menos inmunogénicos. La modificación de N-terminales y C-terminales mediante la acetilación intensifican la estabilidad de la acción proteolítica (Lander et al., 2022).
Ante esto, se planteó determinar los microorganismos presentes en leche cruda bovina y su capacidad de formación de biopelícula con el propósito de evaluar cuatro péptidos derivados de la catelecidina humana LL-37, como una posible alternativa profiláctica y terapéutica y de esta forma contribuir en la disminución de infecciones bovinas en el área rural de Colombia.
MATERIALES Y MÉTODOS
Animales y Tamaño Muestral
El estudio se realizó en dos hatos del trópico alto colombiano (municipio de Caldas, Boyacá) con una población total de 55 vacas adultas. El tamaño mínimo muestral fue determinado mediante el muestreo basado en la detección de enfermedad (Schmoor et al., 2000), con una prevalencia esperada mínima del 18% y con un nivel de confianza del 95%, suponiendo encontrar al menos una vaca con mastitis. Se determinó una muestra de 14 vacas para las dos fincas, y tomando en cuenta la fracción de muestreo del 25.45% previo con relación a la proporción de vacas por raza en las dos fincas se llegó a seleccionar 6 vacas Holstein Friesian, 6 Jersey y 2 Normando.
Se consideraron vacas con al menos un parto, que estuvieran en el segundo tercio de lactancia, y con la misma alimentación del hato (pastoreo en Cenchrus clandestinus y concentrado comercial con 18% de proteína) y clínicamente sanas. Se excluyeron vacas con tratamientos con antibióticos o con historia de mastitis al inicio de la lactancia.
Toma de Muestras
Se hizo un chequeo de mastitis subclínica mediante la prueba de California Mastitis Test (Gómez-Quispe et al., 2015), y se procedió con la toma de la muestra de cada cuarto mamario (total 56 muestras) previa limpieza y desinfección del pezón. Las muestras fueron colectadas en tubos Falcon estériles de 50 mL y se llevaron a 4 °C en neveras portátiles hasta el laboratorio de microbiología de la Universidad Colegio Mayor de Cundinamarca en menos de 10 horas para el análisis microbiológico. Asimismo, se entrevistó a los productores sobre la edad, producción de leche, raza, nutrición, número de partos, abortos, tipo de alimentación, infecciones presentadas y tratamientos antimicrobianos.
Caracterización Microbiológica
Se realizó la búsqueda y caracterización de microrganismos en las muestras colectadas. Se sembró 20 µl de leche cruda en los medios de cultivo MacConkey, BHI (Infusión Cerebro Corazón), bilis esculina y CHROMagarTM para Staphylococcus, que fueron incubados por 24 h a 37 °C. La identificación microbiana se hizo por el método VITEK®2 de Biomeriux.
Determinación de la Formación de Biopelícula
La adherencia de los aislamientos en las cepas estudiadas y controles por triplicado fue evaluada según la técnica descrita por Christensen et al. (1985). Para esto, en microplacas de 96 pozos se inocularon 195 µL de caldo LB con glucosa al 1% y 5 µL de suspensión bacteriana a escala de Mac Farland 0.5. Las placas fueron incubadas por 24 h a 37 °C. Posteriormente, el contenido de cada pozo fue descartado y el sedimento adherido a la placa se fijó con paraformaldehido 4% durante 10 min. Después de retirarlo se adicionó 200 µL de cristal violeta al 0.4% en cada pozo por 10 min; luego se descartó el exceso de colorante y las placas fueron secadas a temperatura ambiente por 10-15 min. Finalmente, el colorante adherido se solubilizó con 200 µL de ácido acético al 30% y las placas fueron leídas a una densidad óptica de 450 nm y 620 nm en un lector de MicroElisa (Multiskan EX, Thermo Scientific). Se realizó clasificación de los aislamientos según la densidad óptica obtenida: no adherentes (0.120), débilmente adherentes (>0.120 <0.240) y fuertemente adherentes (>0.240).
Determinación de Factores de Adhesión
Se observó la presencia de los factores de adhesión clfA, clfB, fnbA, fbe, Sdrc y SdrE en seis aislamientos de Staphylococcus coagulasa negativa y un aislamiento de S. aureus que mostraron ser fuertemente adherentes por el método de cristal violeta. Se extrajo el ADN bacteriano con el Wizard Genomic DNA purification kit (Promega) siguiendo el protocolo del fabricante. Para la amplificación se realizó PCR múltiple, con las siguientes condiciones: 25 ciclos de amplificación con una desnaturalización inicial de 94 °C, desnaturalización por 1 min, hibridación a 55 °C por 1 min, extensión a 72 °C por 1 min y una extensión final de 72 ºC por 10 min. Se utilizó una mezcla con un volumen final de 25 µL y concentración final: buffer 1X, MgCl2 de 3 µM, dNTPs 100Mm, cebadores F y R de 0.5 µM y la Taq polimerasa a 0.05 U/µL. Como controles positivos se usaron las cepas USA 300, ATCC 35984 y como control negativo la cepa ATCC 12228. La secuencia de los cebadores utilizados se muestra en el Cuadro 1.
Efecto de los Péptidos en la Cinética de Crecimiento Bacteriano
Los aislamientos bacterianos y las cepas control formadoras de biopelícula Staphylococcus aureus USA 300, S. epidermidis ATCC 35984 y no formadora S. epidermidis ATCC 12228 fueron inoculadas por triplicado, adicionando 30 µL de microorganismo a escala de Mac Farland 0.5 en 270 µL de caldo LB por pozo, sin tratamiento con péptido y con péptido ACLL37-1, ACLL37-2, DLL37-1 o LL37-1 a una concentración final de 5 µM en placas de 96 pozos en agitación continua a 37 °C. Las lecturas de absorbancia se hicieron a una densidad óptica de 600 nm en el equipo Bioscreen C.
Efecto Inhibitorio de los Péptidos en la Formación de Biopelícula
Fueron elegidos tres aislamientos fuertemente adherentes y se evaluó el efecto inhibitorio de los péptidosACLL37-1,ACLL372, DLL37-1 y LL37-1 a una concentración final de 5 µM en el proceso de formación de biopelícula, siguiendo el protocolo anteriormente mencionado realizando lecturas a las 24 h de incubación (Christensen et al., 1985).
Análisis Estadístico
Los análisis estadísticos fueron realizados en el programa GraphPrism 8. Los valores de p<0.05 fueron considerados estadísticamente significativos. Inicialmente se realizó el test de normalidad y el test de comparaciones múltiples Two-way ANOVA con post test de Tukey para las curvas de crecimiento y porcentajes de inhibición de biopelícula por péptido.
RESULTADOS
La rutina de ordeño fue similar en ambos sistemas productivos. El ordeño es manual haciendo el lavado, despunte, preselle y selle de manera adecuada. El resultado de la prueba de CMT fue negativa (0) para 53/54 cuartos y presencia de trazas en solo un cuarto (1/54). Ninguno de los animales presentó signos de mastitis clínica. Los productores reportaron solo una vaca Holstein Friesian había presentado un aborto espontáneo y una Jersey presentó una lesión pequeña en el cuarto mamario anterior derecho; sin embargo, ninguna vaca presentó signos de mastitis clínica o subclínica.
Se obtuvieron 41 aislamientos de las 56 muestras de leche analizadas. De estas, 27 cepas (65.9%) correspondieron a Staphylococcus coagulasa negativo (SCN), siendo S. epidermidis el microorganismo predominante con 12 aislamientos (29.3%); 1 aislamiento (2.4%) correspondió a S. aureus y otro (2.4%) a S. agalactiae. Además, 8 (19.5%) aislamientos pertenecieron a otros cocos Gram positivos y 4 (9.8%) a cepas de S. liquefaciens (Cuadro 2). (19.5%) aislamientos pertenecieron a otros cocos Grampositivos y4 (9.8%) a cepas de Serratias liquefaciens (Cuadro 2).
Cuadro 2. Caracterización microbiana y formación de biopelícula en aislamientos de bacterias de muestras de leche cruda

a Identificación del aislamiento; b. porcentaje de identidad dado por el sistema VITEK2 de Biomeriux; DO: densidad óptica
NA: no adherente; DA: débilmente adherente; FA: fuertemente adherente
De los 41 aislamientos bacterianos, 30 (73.2%) fueron clasificados por el método de Cristal Violeta como fuertemente adherentes, 7 (17.1%) como débilmente adherentes y 4 (9.8%) como no adherentes (Cuadro 2).
De los 8 asilamientos de Staphylococcus spp analizados, se encontró en el aislamiento 1.3B correspondiente a S. aureus el factor de adhesión FnbA (Figura 1).
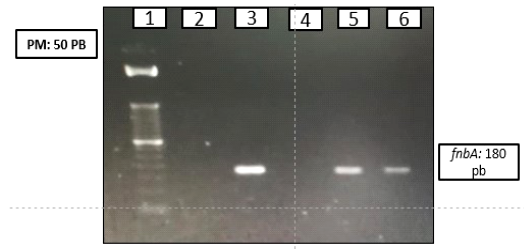
Figura 1. Detección molecular del factor de adhesión fnbA (180pb) mediante PCR múltiple. 1. Marcador de peso molecular (50 pb). 2. control negativo S. epidermidis ATCC 12228. 3. control positivo S. aureus USA 300. 5 Control positivo S. epidermidis ATCC 35984. 6.Aislamiento microbiano 1.3B
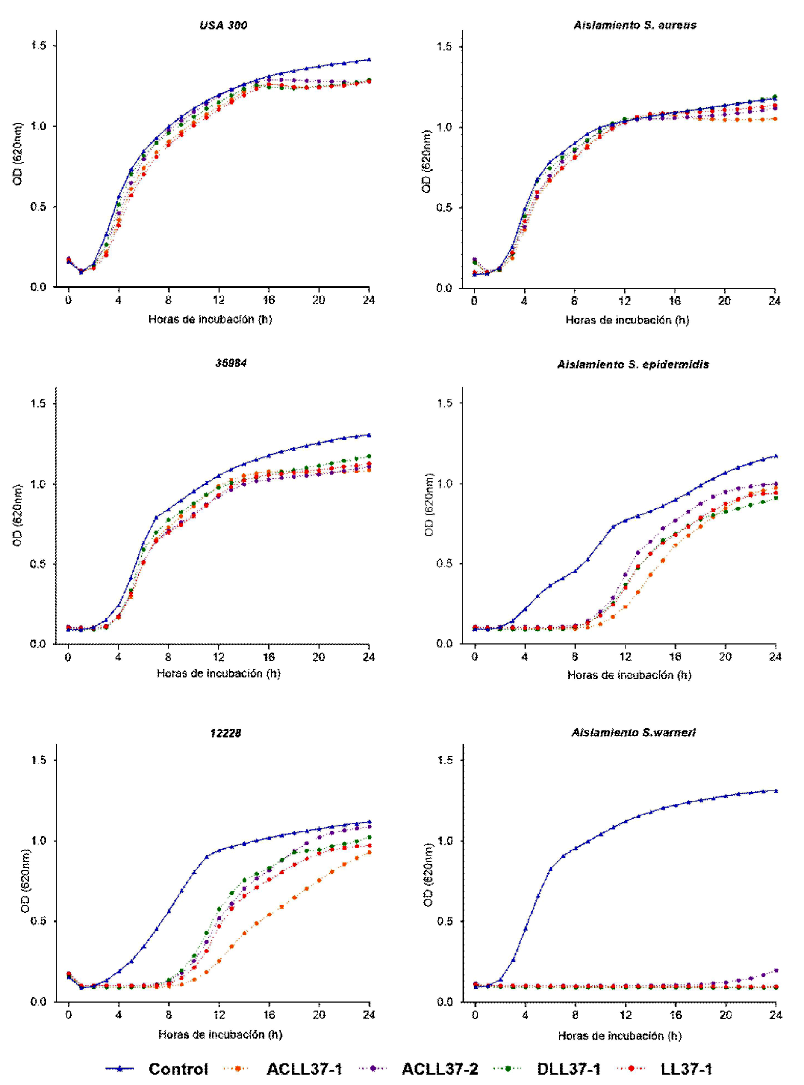
Figura 2. Efecto de los péptidos sintéticos a una concentración de 5 µM en las curvas de crecimiento bacteriano de aislamientos bacterianos de leche cruda y controles en 24 horas de incubación. Los datos mostrados corresponden a la media de la densidad óptica de ensayos realizados por triplicado de mediciones realizadas cada hora durante 24 h
Los péptidos antimicrobianos mostraron prolongación de la fase de latencia (lac), principalmente en el aislamiento de S. epider-midis y la cepa 12228. De forma interesante, el aislamiento de S. warneri sometido a tratamiento mostró inhibición total del crecimiento.
En la Figura 3 se observa que los péptidos evaluados poseen un considerable porcentaje de inhibición de biopelícula en tres aislamientos caracterizados como fuertemente adherentes. El efecto biológico fue más evidente en el Staphylococcus coagulasa negativo S. hominis y en el aislamiento de tipo ambiental Kocuria rhizophila. En con-traste, en el aislamiento perteneciente a S. aureus no hubo inhibición de biopelícula en formación cuando fue tratado con esta concentración de péptido y en el tiempo de incubación evaluado.
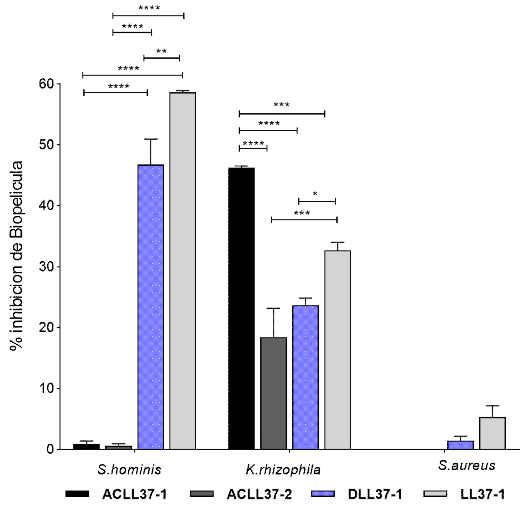
Figura 3. Inhibición de biopelícula en 24 horas de los péptidos análogos a una concentración de 5 µM en aislamientos de S. hominis, K. rhizophila y S. aureus. Los datos mostrados corresponden a la media de los porcentajes de inhibición de los aislamientos clínicos por especie realizados por triplicado. Test Two-wayAnova, post test Tukey’s. * p<0.05, ** p<0.01, *** p<0.001, ****p<0.0001
Frente a S. hominis los péptidos LL371 y DLL37-1 mostraron buenos porcentajes de inhibición; sin embargo, se encontró diferencia estadística entre estos dos tratamientos, siendo el péptido LL37-1 quien mostró un mejor resultado. En K. rhizophila el péptido ACLL37-1 presentó diferencia estadística en relación a los otros péptidos, siendo el mejor candidato para este tipo de microorganismo.
DISCUSIÓN
Uno de los principales factores que afectan la calidad de la leche cruda es la diversidad o composición de la microbiota bacteriana. Se reportan bacterias de los géneros Aerococcus, Streptococcus, Staphylococcus, Kocuria, Enterococcus, Bacillus, Lactococcus, Lactobacillus, Pseudomonas y Corynebacterium (Quigley et al., 2013). En este estudio se encontraron bacterias de los cinco primeros géneros mencionados, además de Serratia liquefaciens. Sobre este último se ha demostrado su capacidad para producir proteasas estables al calor resistiendo los procesos de pasteurización (Machado et al., 2015); sin embargo, la gran mayoría de microorganismos correspondieron a Staphylococcus coagulasa negativo (SCN) con 27 cepas (65.9%). Todos estos microorganismos, bajo condiciones específicas, pueden favorecer la inflamación del tejido mamario del animal sin signos clínicos, lo que se conoce como mastitis subclínica (De Visscher et al., 2015; Isaac et al., 2017; Khazandi et al., 2018), ocasionando reducción en la producción de la leche y pérdidas económicas en la industria lechera. Asimismo, los casos subclínicos se convierten en reservorios que favorecen la transmisión de la infección a otros animales (Valero-Leal et al., 2017).
Se reporta la capacidad de diversos microorganismos aislados en leche cruda de organizarse en consorcios bacterianos y formar biopelícula gracias a la expresión genética de ciertos factores de virulencia (Valero-Leal et al., 2017; Naushad et al., 2019). En el presente estudio se confirmó que 73.2% de los aislamientos son formadores de biopelícula y que los péptidos LL37-1, DLL37-1 y el ACLL37-1 (péptidos análogos derivados de la catelecidina humana LL-37) fueron los de mayor porcentaje de inhibición (p<0.0001). Estos péptidos podrían estar actuando sobre los componentes de la biopelícula al inhibir la adhesión y colonización gracias a que a su naturaleza catiónica suelen mostrar un equilibrio entre los residuos de aminoácidos hidrófobos y al estar cargados positivamente adoptan una conformación anfipática que les permite una mayor interacción con las membranas bacterianas con carga negativa, inhibir el plegamiento de proteínas, la actividad enzimática, o actuar intracelularmente (Hell et al., 2010; Bechinger y Gorr, 2017). Los resultados obtenidos concuerdan con el estudio de Shahid et al. (2020) al inhibir el crecimiento in vitro de Prototheca bovis con el empleo de la catelecidina humana LL-37.
La gran mayoría de los aislamientos obtenidos correspondieron a microorganismos de tipo ambiental que generalmente se encuentran presentes en el bovino; no obstante, se destaca la presencia de Staphylococcus aureus, formador de biopelícula, que puede llegar a expresar genes de resistencia a βlactámicos y macrólidos (Sharun et al., 2021). Adicionalmente tiene la capacidad de colonizar el canal del pezón y penetrar hasta los tejidos secretores del animal aumentando las infecciones y la ocurrencia de mastitis clínica (Marques et al., 2017; Algharib et al., 2020). S. aureus se propaga principalmente por contacto, por lo que la bioseguridad del rebaño puede considerarse como una medida preventiva para la reducción y eliminación de los reservorios (Keefe, 2012; Sharun et al., 2021).
Los péptidos antimicrobianos ensayados no inhibieron la biopelícula correspondiente a S. aureus, al que adicionalmente se le identificó molecularmente el factor de adhesión FnbA. Este microorganismo se une a componentes de la matriz extracelular e invade las células epiteliales de la glándula mamaria bovina por medio de las proteínas de unión a la fibronectina (FnBP), codificadas por los genes FnbA y FnbB, que permiten la interacción entre las células bacterianas con los receptores de fibronectina de células de mamíferos específicamente a través de las integrinas α5β1 (Pereyra et al., 2016). La presencia de alguna de estas adhesinas favorece la acumulación y proliferación bacteriana, constituyéndose como factores de virulencia (Pinilla et al., 2017).
La terapia antibiótica sigue siendo la principal herramienta para infecciones bovinas como la mastitis; sin embargo, los microrganismos que forman biopelícula han demostrado resistencia parcial o completa a diferentes antimicrobianos (Sánchez Bonilla et al., 2018), por lo que el estudio de las catelecidinas cada vez cobra más importancia en el campo veterinario, ya que están presentes en las células epiteliales mamarias de bovinos que presentan inflamación intramamaria, pero no en animales sanos, por lo que podrían llegar a ser un marcador de mastitis sensible y específico (Cubeddu et al., 2017). Adicionalmente las catelecidinas bovinas BMAP-27 y BMAP-28 han mostrado resultados satisfactorios frente aislamientos de S. aureus y E. coli, obtenidos de bovinos con mastitis subclínica (Langer et al., 2017).
La utilidad de este tipo de estudios piloto es que permite conocer la composición microbiana presente en leche cruda, la capacidad de estos microorganismos de formar biopelícula y el efecto de los péptidos antimicrobianos sobre los mismos. Sin embargo, a futuro se debe realizar un mayor muestreo, con el fin de evaluar el efecto de los péptidos frente a bacterias Gram negativas, así como ensayos de citotoxicidad.
CONCLUSIÓN
Se demuestra la importancia del estudio de péptidos antimicrobianos derivados de la catelecidina humana en el desarrollo de nuevas estrategias terapéuticas para la intervención de las infecciones y enfermedades inflamatorias en bovinos, gracias a sus características biológicas y propiedades inmunomoduladoras.












 uBio
uBio 



