INTRODUCCIÓN
En la avicultura a nivel mundial existe un creciente interés por el uso de aditivos alternativos a los antibióticos promotores de crecimiento (APC), los cuales se siguen utilizando en la avicultura comercial en Perú, debido principalmente a que estos antibióticos evitan el surgimiento de enfermedades y mejoran la respuesta productiva. No obstante, la sinergia de los APC con otros aditivos en este contexto amerita ser estudiado, de tal forma que se viene estudiando el uso combinado de antibióticos con aditivos tales como probióticos, prebióticos o ácidos orgánicos (Jiménez, 2022). Se ha demostrado que el empleo en la dieta de ácidos orgánicos (AO) mejora la digestibilidad de los nutrientes al aumentar la población de la microflora beneficiosa (Lactobacillus spp), reduciendo el recuento de bacterias dañinas (Clostridium perfringens, Eschericihia coli y Salmonella spp), además de mejorar la salud ósea (Polycarpo et al., 2017).
Existe una variedad de AO en el mercado y su eficacia en el crecimiento de los pollos y la salud intestinal está influenciada por factores tales como la estructura, la composición, el recubrimiento y el nivel de inclusión de los AO, así como el estado de salud del pollo, la composición de la dieta y el medioambiente de la crianza (Pham et al., 2021). Con relación al recubrimiento se dispone de ácidos orgánicos protegidos y no protegidos, cuyo efecto y lugar de acción genera controversia por lo que es importante llevar a cabo estudios al respecto (Khan et al., 2022). De esta forma, algunos autores señalan que el tracto gastrointestinal anterior, que incluye la molleja y el buche, son los principales objetivos de estos aditivos (Hume et al., 1993; Dittoe et al., 2018), mientras que otros autores señalan al tracto gastrointestinal (TGI) posterior como su objetivo principal (Nourmohammadi et al., 2011).
La determinación del pH en segmentos del TGI podría dar indicios de su uso estratégico. Ante esto, el objetivo del presente trabajo fue evaluar el efecto de los ácidos grasos volátiles protegidos y no protegidos sobre los parámetros productivos, la morfometría intestinal y ósea y el pH de los segmentos del TGI en dietas de pollos de carne que reciben APV en la dieta.
MATERIALES Y MÉTODOS
El estudio se desarrolló en la Unidad Experimental Avícola de la Granja de Aves de la Universidad Nacional Agraria La Molina (UNALM), en Lima, Perú, durante abril y mayo de 2019 con una duración de 42 días. Se utilizaron 200 pollos de engorde machos, de la línea Cobb 500 de un día de edad. Las aves se distribuyeron aleatoriamente en 5 tratamientos y 4 repeticiones con 10 aves por réplica. El suministro de agua y alimento fue ad libitum desde el día 1 de edad hasta el día 42. El alimento fue en forma de harina. Los parámetros productivos evaluados fueron: peso corporal, consumo de alimento, ganancia diaria de peso, conversión alimenticia y mortalidad.
Se registró semanalmente el peso vivo, consumo de alimento y conversión alimenticia. El peso vivo y el consumo de alimento se midieron utilizando una balanza digital de plataforma con precisión de 0.01 g. El consumo voluntario de alimento se determinó restando la cantidad de alimento ofrecido de la suma del residuo del alimento y su desperdicio. La conversión alimenticia se determinó dividiendo el consumo del alimento entre la ganancia de peso.
Los tratamientos fueron: T1: dieta control; T2: T1 + zinc bacitracina (50 ppm); T3: T2 + acidificante no protegido - AONP (500 g/t); T4: T2 + acidificante protegido - AOP (500 g/t); T5: T2 + acidificante protegido (1000 g/t). El acidificante protegido fue Butytec Plus de Tecnovit (T&V) y el antibiótico Zinc Bacitracina fue Baczin® (Montana). La composición y valor nutricional de las dietas se presenta en el Cuadro 1. Se siguieron las recomendaciones de la línea Cobb 500 (2008).
Cuadro 1. Composición y valor nutricional de las dietas en pollos en las fases de inicio y crecimiento1
| Inicio | Crecimiento 1 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| T1 | T2 | T3 | T4 | T5 | T1 | T2 | T3 | T4 | T5 | |
| Composición | ||||||||||
| Maíz, % | 56.47 | 56.36 | 56.16 | 56.26 | 56.16 | 58.79 | 58.68 | 58.48 | 58.58 | 58.48 |
| Torta de soya, % | 36.58 | 36.60 | 36.63 | 36.61 | 36,63 | 34.26 | 34.28 | 34.30 | 34.29 | 34.30 |
| Aceite vegetal, % | 2.34 | 2.39 | 2.46 | 2.43 | 2.46 | 2.71 | 2.76 | 2.83 | 2.79 | 2.83 |
| Núcleo 12, % | 4.50 | 4.50 | 4.50 | 4.50 | 4.50 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 |
| Núcleo 2, % | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 4.15 | 4.15 | 4.15 | 4.15 | 4.15 |
| Antibiótico, % | 0.00 | 0.05 | 0.05 | 0.05 | 0.05 | 0.00 | 0.05 | 0.05 | 0.05 | 0.05 |
| Premezcla de vitaminas + minerales** | 0.10 | 0.10 | 0.10 | 0.10 | 0.10 | 0.10 | 0.10 | 0.10 | 0.10 | 0.10 |
| Ácido orgánico no protegido, % | 0.00 | 0.00 | 0.10 | 0.00 | 0.00 | 0.00 | 0.00 | 0.10 | 0.00 | 0.00 |
| Ácido orgánico protegido, % | 0.00 | 0.00 | 0.00 | 0.05 | 0.10 | 0.00 | 0.00 | 0.00 | 0.05 | 0.10 |
| Total, % | 100 | 100 | 100 | 100 | 100 | 100 | 100 | 100 | 100 | 100 |
| Valor nutricional (calculado) | ||||||||||
| Energía metabolizable, kcal kg-1 | 2975 | 2975 | 2975 | 2975 | 2975 | 3025 | 3025 | 3025 | 3025 | 3025 |
| Proteína bruta, % | 22.00 | 22.00 | 22.00 | 22.00 | 22.00 | 21.00 | 21.00 | 21.00 | 21.00 | 21.00 |
| Calcio, % | 0.90 | 0.90 | 0.90 | 0.90 | 0.90 | 0.84 | 0.84 | 0.84 | 0.84 | 0.84 |
| Fósforo disponible, % | 0.45 | 0.45 | 0.45 | 0.45 | 0.45 | 0.42 | 0.42 | 0.42 | 0.42 | 0.42 |
| Lisina disponible, % | 1.22 | 1.22 | 1.22 | 1.22 | 1.22 | 1.12 | 1.12 | 1.12 | 1.12 | 1.12 |
| Metionina disponible, % | 0.61 | 0.61 | 0.61 | 0.61 | 0.61 | 0.56 | 0.56 | 0.56 | 0.56 | 0.56 |
| Met + Cis, disponible, % | 0.91 | 0.91 | 0.91 | 0.91 | 0.91 | 0.85 | 0.85 | 0.85 | 0.85 | 0.85 |
| Treonina disponible, % | 0.83 | 0.83 | 0.83 | 0.83 | 0.83 | 0.73 | 0.73 | 0.73 | 0.73 | 0.73 |
| Triptófano disponible, % | 0.25 | 0.25 | 0.25 | 0.25 | 0.25 | 0.24 | 0.24 | 0.24 | 0.24 | 0.24 |
| Sodio, % | 0.20 | 0.20 | 0.20 | 0.20 | 0.20 | 0.20 | 0.20 | 0.20 | 0.20 | 0.20 |
T1: dieta basal, T2: dieta basal + zinc bacitracina, T3: dieta basal + zinc bacitracina y acidificante no protegido (500 g/t), T4: dieta basal + zinc bacitracina y acidificante protegido (500 g/t), T5: dieta basal + zinc bacitracina y acidificante protegido (1000 g/t)
** Vitamina A, 12 000 000 UI; Vitamina D, 2 500 000 UI; Vitamina E, 30 000 UI; Vitamina B2, 5 500 g; Vitamina B6, 3 000; Vitamina B12, 0.015 g; Vitamina K3, 3 g; Vitamina B9, 1g; Vitamina B3, 30 g; Vitamina B5, 11 g; Vitamina B8, 0.15 g; Zinc, 45g; Hierro, 80 g; Manganeso, 65 g; Cobre, 8 g; Yodo, 1 g; Selenio, 0.15 g; excipientes 1 000 g
Núcleo 1: Carbonato de calcio 1%; fosfato dicálcico; 1.73%; DL metionina, 0.32; HCL Lisina, 0.18%; L-treonina, 0.09; cloruro de colina, 0.20%; bicarbonato de sodio, 0.30%; sal común, 0.27%; premezcla, 0.15, coccidiostato, 0.08; antioxidante, 0.08; secuestrante, 0.10
Núcleo 2: Carbonato de calcio 0.94%; fosfato dicálcico; 1.59%; DL metionina, 0.29; HCL Lisina, 0.13%; L-treonina, 0.02; cloruro de colina, 0.20%; bicarbonato de sodio, 0.30%; sal común, 0.27%; premezcla, 0.15, coccidiostato, 0.08; antioxidante, 0.08; secuestrante, 0.10
El último día de evaluación se sacrificaron dos aves por unidad. Se extrajeron las porciones de yeyuno e íleon del intestino delgado. La muestra del yeyuno fue de 2 cm de largo, tomada 8 cm antes del divertículo de Meckel. La muestra del íleon se tomó 5 cm después de dicho divertículo. Las muestras en formol al 10% fueron remitidas al Laboratorio de Histomorfometría Aviar de la UNALM. Las mediciones se realizaron siguiendo una adaptación del protocolo de evaluación utilizado por Oliveira et al. (2000), que consistió en colocar tres cortes seriados en lugar de cuatro por segmento y en realizar 15 mediciones morfométricas como mínimo por lámina histológica (en lugar de 30) midiendo la altura, ancho, área de vellosidades, profundidad de cripta y relación altura: profundidad de cripta.
La altura de vellosidad fue la distancia tomada a partir de la región basal, que coincide con la porción superior de las criptas hasta el ápice de la vellosidad. El grosor de las vellosidades fue medido en el punto medio de cada vellosidad. La medida profundidad de cripta es la distancia tomada desde la región basal de cada vellosidad hasta la parte basal superior de la musculatura lisa del intestino. La relación altura de vellosidad y profundidad de cripta resultó de la división de ambas magnitudes. El área de la vellosidad fue calculada usando el software Leica.
Cuadro 2. Composición y valor nutricional de las dietas en pollos en las fases de crecimiento 2 y acabado
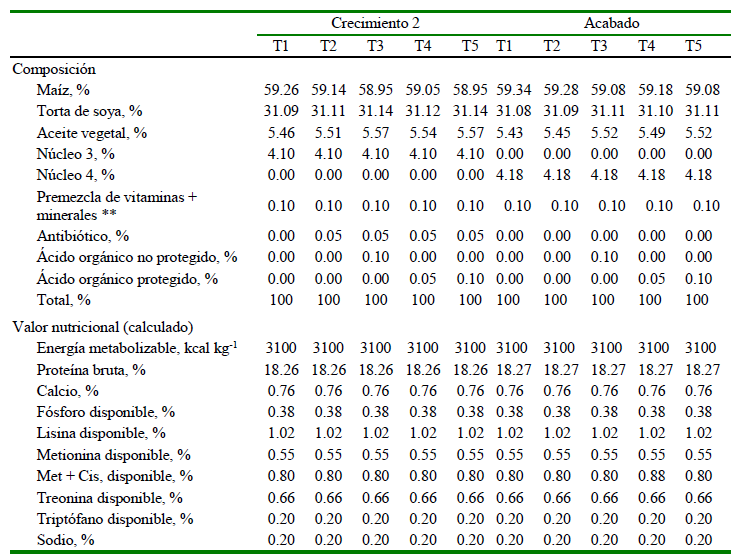
T1: dieta basal, T2: dieta basal + zinc bacitracina, T3: dieta basal + zinc bacitracina y acidificante no protegido (500 g/t), T4: dieta basal + zinc bacitracina y acidificante protegido (500 g/t), T5: dieta basal + zinc bacitracina y acidificante protegido (1000 g/t)
** Vitamina A, 12 000 000 UI; Vitamina D, 2 500 000 UI; Vitamina E, 30 000 UI; Vitamina B2, 5 500 g; Vitamina B6, 3 000; Vitamina B12, 0.015 g; Vitamina K3, 3 g; Vitamina B9, 1g; Vitamina B3, 30 g; Vitamina B5, 11 g; Vitamina B8, 0.15 g; Zinc, 45g; Hierro, 80 g; Manganeso, 65 g; Cobre, 8 g; Yodo, 1 g; Selenio, 0.15 g; excipientes 1 000 g
Núcleo 3: Carbonato de calcio 0.95%; fosfato dicálcico; 1.43%; DL metionina, 0.30; HCL Lisina, 0.19%; L-treonina, 0.05; cloruro de colina, 0.20%; bicarbonato de sodio, 0.30%; sal común, 0.27%; premezcla, 0.15, coccidiostato, 0.08; antioxidante, 0.08; secuestrante, 0.10
Núcleo 4: Carbonato de calcio 0.95%; fosfato dicálcico; 1.43%; DL metionina, 0.39; HCL Lisina, 0.19%; L-treonina, 0.05; cloruro de colina, 0.25%; bicarbonato de sodio, 0.20%; sal común, 0.34%; premezcla, 0.20; antioxidante, 0.08; secuestrante, 0.10
Al mismo tiempo, se extrajeron los tibiotarsos, que fueron colocados en agua hirviendo por 15 min. Luego se retiró manualmente el tejido y el cartílago presente y se registró el peso, densidad, volumen, largo y ancho del tibiotarso. El peso de la tibia (mg) se midió en una balanza analítica (± 0.1 mg). Las densidades óseas de la tibia de las aves se determinaron mediante la volumetría del hueso (Quarantelli et al., 2007), considerándose como densidad ósea a la masa de material orgánico e inorgánico en el hueso por unidad de volumen de este (Zhou et al., 2011). Se calculó dividiendo el peso del hueso (mg) entre el volumen (cm3). Para la determinación del volumen de los huesos se emplearon probetas graduadas con capacidad de 10 y 25 cm3 y con una aproximación de 0.2 y 0.5 cm3, respectivamente. El largo (mm), diámetro de diáfisis (mm) e índice de forma (mm) de las tibias fueron medidos empleando un vernier Uyustools profesional con una capacidad para 15 cm y con una aproximación de 0.05 mm.
Para determinar el pH del tracto gastrointestinal se tomó asépticamente 0.6 g de una muestra del contenido del buche, proventrículo, molleja, duodeno, yeyuno, íleon y ciego y se diluyó en 2.6 ml de agua destilada desionizada. El pH de la suspensión se midió dentro de los 45 minutos posteriores al sacrificio de las aves siguiendo las recomendaciones de Hinton et al. (1990).
Se calculó el tamaño muestral para una diferencia de medias en muestras independientes mediante al paquete estadístico R-Studio (RStudio Team, 2020) con un poder de la prueba de 80% y un nivel de significancia de 5%, resultando en al menos cuatro unidades experimentales (repeticiones) por tratamiento. Los datos obtenidos se analizaron mediante análisis de varianza con las pruebas de comparación múltiple post hoc de Duncan, utilizando el software R. Un valor de probabilidad de p<0.05 fue considerado estadísticamente significativo. Se realizó un análisis de correlación de Pearson para establecer las relaciones entre las variables estudiadas.
RESULTADOS Y DISCUSIÓN
Los efectos de AONP o AOP en el rendimiento del crecimiento de los pollos se muestran en el Cuadro 3. Estos efectos pueden verse influenciadas por el tipo y dosis de los ácidos orgánicos, la composición de las dietas, el medio ambiente, y el manejo de las aves (Zeng et al., 2015). En el presente estudio el consumo de alimentos fue significativamente menor (p<0.05) en T2 (dieta basal + zinc bacitracina) en comparación con T1, T4 y T5, no habiendo diferencias significativas para peso vivo ni en conversión alimenticia (p>0.05).
Cuadro 3. Efecto de los ácidos orgánicos protegidos y no protegidos sobre el desarrollo productivo de los pollos de carne
| Parámetros productivos | Tratamientos1 | p-value | ||||
|---|---|---|---|---|---|---|
| T1 | T2 | T3 | T4 | T5 | ||
| Consumo de alimento (g/ave) | 5151a | 4943b | 5068ab | 5109a | 5086a | 0.02 |
| Peso vivo (g) | 3320a | 3262ª | 3312a | 3370a | 3390a | 0.45 |
| Conversión alimenticia (g/g) | 1.55a | 1.52a | 1.53a | 1.52a | 1.50a | 0.54 |
T1: dieta basal, T2: dieta basal + zinc bacitracina, T3: dieta basal + zinc bacitracina y acidificante no protegido (500 g/t), T4: dieta basal + zinc bacitracina y acidificante protegido (500 g/t), T5: dieta basal + zinc bacitracina y acidificante protegido (1000 g/t)
Los valores son el promedio y desviación estándar de 4 repeticiones (10 aves por repetición) por tratamiento
a,b,c Superíndices diferentes dentro de las filas indican diferencia estadística (p<0.05)
La adición de antibióticos (T2) redujo el consumo de alimento, resultado que coincide con Polycarpo et al. (2017) quienes a través de un metaanálisis determinaron que los ácidos orgánicos se pueden utilizar para mejorar el rendimiento, pero que el rendimiento productivo puede ser menor si las aves se encuentran frente a un desafío microbiano. En algunos trabajos los tratamientos que usaban antibióticos han presentado efectos diferentes a los esperados donde el grupo control negativo sin antibióticos obtenía mejores resultados que el control positivo con antibióticos. Según Forbes y Park (1959), en un entorno microbiano «bajo», como ocurre en una cama fresca, los APC pueden afectar negativamente a las bacterias comensales necesarias para una digestión adecuada, lo que resulta en una disminución del crecimiento. Asimismo, Wise y Siragusa (2007) notaron que las poblaciones ileales de lactobacilos y enterobacterias eran más numerosas en las aves libres de antibióticos en comparación con las criadas con una dieta convencional.
Por otro lado, se ha demostrado la influencia de la edad del animal y del aditivo empleado sobre la microbiota del TGI (Gong et al., 2008; Liao et al., 2020; Jijón et al., 2023). Al respecto, Gong et al. (2008) señalan que el tratamiento con bacitracina a razón de 50 mg kg-1 no cambian la riqueza, pero alteran la composición de la microbiota, con un efecto más acentuado en los primeros 3 días de edad.
No hubo diferencias estadísticas en el pH de la digesta, excepto a nivel del ciego, donde el pH en T2 fue significativamente menor al T4, siendo igual a T1, T3 y T5 (Cuadro 4). En otro estudio, Engberg et al. (2000), alimentando aves con zinc bacitracina tuvieron un pH más alto en el ciego (9.26) que consalinomicina, donde se obtuvo un bajo nivel de pH (8.47). Esta alcalinización también fue encontrada en otro trabajo realizado por Shimizu et al. (2021). en ratones de 25 a 30 semanas de edad a los que se les administró ampicilina. De acuerdo con estos autores, el pH intestinal incrementado se pudo deber a las aminas generadas de la proteína de la dieta por las bacterias que colonizan el ciego y el colon. Es interesante señalar que según estos resultados un pH alcalino en el ciego sería favorable en relación a la salud intestinal o parámetros productivos a diferencia de otros segmentos donde el pH debería ser más ácido. Por otro lado, se encontró una relación regular y positiva entre el pH del ciego y el peso vivo del animal (r=0.31), debido a la tendencia que mostraron T4 y T5 de presentar la mejor conversión y al mismo tiempo el pH del ciego más alcalino.
Cuadro 4. Efectos de acidificantes no protegidos o acidificantes protegidos sobre el pH del tracto gastrointestinal de pollos de carne
| Tratamiento | pH del tracto gastrointestinal | ||||||
|---|---|---|---|---|---|---|---|
| Buche | Proventrículo | Molleja | Duodeno | Yeyuno | Íleon | Ciego | |
| T1 | 4.98a | 2.80a | 3.22a | 6.15a | 5.66a | 6.41a | 6.66ab |
| T2 | 4.79a | 3.44a | 3.02a | 6.04a | 5.71a | 6.32a | 6.47b |
| T3 | 4.45a | 2.84a | 2.66a | 6.18a | 5.80a | 6.51a | 6.75ab |
| T4 | 4.52a | 3.00a | 3.11a | 6.16a | 5.67a | 6.50a | 7.12a |
| T5 | 4.42a | 2.67a | 3.01a | 6.12a | 5.75a | 6.59a | 6.76ab |
| p-Value | 0.13 | 0.34 | 0.27 | 0.28 | 0.98 | 0.99 | 0.03 |
T1: dieta basal, T2: dieta basal + zinc bacitracina, T3: dieta basal + zinc bacitracina y acidificante no protegido (500 g/t), T4: dieta basal + zinc bacitracina y acidificante protegido (500 g/t), T5: dieta basal + zinc bacitracina y acidificante protegido (1000 g/t)
Los valores son el promedio y desviación estándar de 4 repeticiones (10 aves por repetición) por tratamiento
a,b,c Superíndices diferentes dentro de las filas indican diferencia estadística (p<0.05)
En un estudio realizado por Tsiouris et al. (2020) se encontró una reducción en el pH del ciego por la inclusión en la dieta de suero al 5% y un ligero aumento en los valores de pH en las partes proximales del intestino. Además, Boroojeni et al. (2014) demostraron que los efectos directos de la AO sobre el recuento de células bacterianas en las aves de corral solo se pueden suponer en el buche y el intestino delgado proximal.
Los resultados de pH también están de acuerdo con Banday et al. (2015), quienes al trabajar con ácido fumárico (0.5, 1.0 y 1.5%) no encontraron cambios en el pH del buche, proventrículo y molleja (p>0.05).Así mismo, Paul et al. (2007), al realizar su investigación con ácidos orgánicos combinados indicaron que los ácidos formiato de amonio más propionato de calcio y propionato de calcio más formiato de calcio y lactato de calcio no influyeron en el pH del TGI (p>0.05) en los diferentes segmentos del tracto gastrointestinal de los pollos de engorde. No obstante, Olukosi y Dono (2014) demostraron que el pH del TGI se puede manipular. Así, por ejemplo, encontraron que la suplementación con harina de cúrcuma, sola o en combinación con harina de ajo a una tasa de 10 g/kg redujo (p<0.05) el pH en el buche, proventrículo y ciego, pero no en el yeyuno. Salgado et al. (2011), tampoco encontraron diferencias significativas al evaluar el pH del proventrículo, molleja, duodeno, yeyuno eíleon TGI en pollos de 28 días con la adición de ácido cítrico (AC), a varios niveles (6.25, 12.5, 25 y 50 g/kg),
No se encontraron diferencias significativas en las variables de la morfometría intestinal del yeyuno y del íleo (Cuadro 5), excepto en la relación altura: profundidad del yeyuno, donde T2 (con antibiótico), el valor es significativamente inferior que T3, T4 y T5. Este resultado favorable en la relación altura: profundidad de yeyuno coincide con Elnesr et al. (2020), quienes mencionan que el ácido butírico estimula el crecimiento de las vellosidades intestinales. Por otro lado, Mustafa et al. (2021) tampoco encontraron diferencias significativas luego de la inclusión de ácidos orgánicos en la dieta de pollos, posiblemente debido a lo que señala Dittoe et al. (2018) que la mayoría de los ácidos orgánicos se disocian antes de alcanzar la parte final del TGI y, por tanto, tienen poco o ningún efecto sobre el intestino. En el presente estudio, incluso en las dietas con ácidos orgánicos protegidos.
Cuadro 5. Efecto de los ácidos orgánicos protegidos y no protegidos sobre la morfometría del yeyuno e íleon en pollos de carne
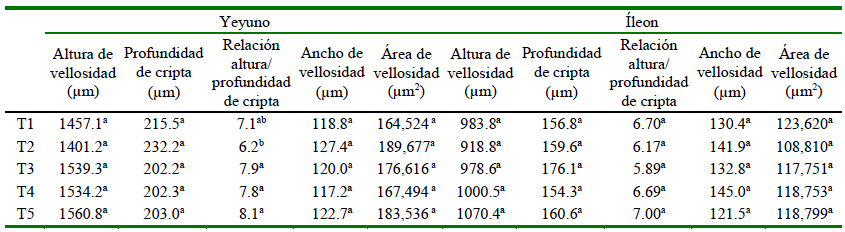
Tratamientos: T1: dieta control; T2: T1+ zinc bacitracina; T3: T2 + acidificante no protegido (500 g/t); T4: T2+acidificante protegido (500 g/t); T5: T2+acidificante protegido (1000 g/t)
2 Valores son el promedio de 4 repeticiones (diez aves por repetición) por tratamiento
a,b,c superíndices diferentes dentro de columnas indican diferencia estadística (p<0.05)
En el Cuadro 6 se observan los resultados del efecto de los tratamientos sobre la morfometría de la tibia. El diámetro interno del hueso en T5 fue significativamente mayor (p<0.05) al de T2 y T3, en tanto que el ancho del hueso de T5 fue mayor al de T2. Al respecto, se conoce que algunos aditivos, tales como prebióticos, probióticos o ácidos orgánicos que se usan en reemplazo de los antibióticos pueden tener efecto sobre la salud ósea actuando sobre la absorción del calcio y la modulación de la microbiota (Whisner y Castillo, 2018).
Cuadro 6. Efecto de los ácidos orgánicos protegidos y no protegidos sobre la morfometría ósea de la tibia en pollos de carne
| Tratamiento1 | Peso de hueso | Largo de hueso | Diámetro lateral del hueso | Diámetro interno del hueso | Ancho del hueso | Volumen del hueso | Densidad |
|---|---|---|---|---|---|---|---|
| T1 | 7.82a | 103.96a | 9.92a | 8.56ab | 9.24ab | 12.25a | 0.64a |
| T2 | 7.55a | 102.65a | 9.69a | 8.09b | 8.89b | 10.43a | 0.73a |
| T3 | 7.69a | 101.92a | 9.87a | 8.28b | 9.08ab | 11.67a | 0.67a |
| T4 | 8.47a | 104.48a | 10.47a | 8.91ab | 9.69ab | 12.57a | 0.69a |
| T5 | 8.31a | 102.36a | 10.36a | 9.27a | 9.81a | 12.00a | 0.70a |
T1: dieta basal, T2: dieta basal + zinc bacitracina, T3: dieta basal + zinc bacitracina y acidificante no protegido (500 g/t), T4: dieta basal + zinc bacitracina y acidificante protegido (500 g/t), T5: dieta basal + zinc bacitracina y acidificante protegido (1000 g/t)
Los valores son el promedio y desviación estándar de 4 repeticiones (10 aves por repetición) por tratamiento
a,b,c Superíndices diferentes dentro de columnas indican diferencia estadística (p<0.05)
El pH del TGI estuvo asociado tanto con la morfometría intestinal como con la morfometría ósea (Cuadro 7), convirtiéndose en un indicador interesante para la salud ósea e intestinal pudiendo reflejarse en la respuesta productiva. Trabajando en ratas, Weaver et al. (2010) encontraron una relación alta (r=0.59) entre el peso del ciego y la producción de ácidos grasos de cadena corta (AGCC). En este sentido, la relación encontrada en el presente estudio fue positiva entre el peso vivo y el pH del ciego (r=0.31). Por otro lado, es de suponer que los AGCC reducen el pH del ciego, lo que conllevaría a una relación inversa. En este estudio se cumplen algunas relaciones inversas entre el pH de diferentes segmentos con variables de interés. Así, se observa una relación moderada inversa entre el peso vivo del animal, el peso de pechuga y el peso del hueso con el pH del buche y el pH del yeyuno. Además, el pH del buche tuvo una relación negativa y regular con el peso y el ancho del hueso respectivamente (-0.36 para ambos casos). Esto estaría indicando que a medida que el pH se hace más ácido en el buche y en yeyuno, el peso vivo, el peso de la pechuga y el peso del hueso se incrementarían. De igual forma se puede observar una relación inversa entre el pH de la molleja con la altura de vellosidad del íleo y con el área de vellosidad (r=-0.34 y r=0.35, respectivamente).
Cuadro 7. Relación entre el pH del tracto gastrointestinal con variables de morfometría ósea, morfometría intestinal del íleo y del yeyuno en pollos de 42 días de edad
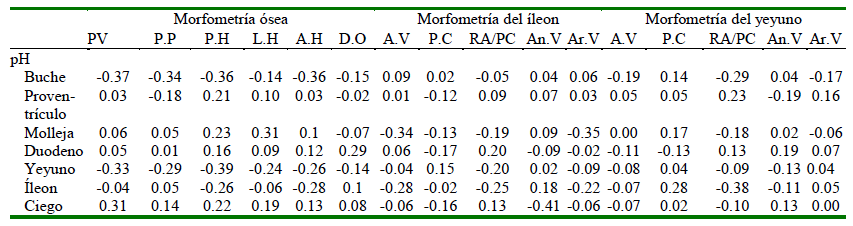
P.V: Peso vivo, P.P: Peso de pechuga, P.H: Peso del hueso, L.H: Longitud de la tibia, A.H: Ancho de la tibia, D.O: densidad ósea, A.V: Altura de vellosidad, P.C: Profundidad de cripta, RA/PC: Relación altura/profundidad de cripta, An.V; Ancho de vellosidad, Ar.V: área de vellosidad
Se concluye que los antibióticos y ácidos orgánicos protegidos o no protegidos en combinación con antibióticos no influyen de forma significativa en los parámetros productivos, morfometría ósea e intestinal del yeyuno, pH del TGI en pollos de engorde. Así mismo, existe una relación regular de sentido negativo entre el pH del buche y el pH del yeyuno con el peso vivo, el peso de pechuga y el peso y ancho de la tibia y entre el pH de la molleja con morfometría intestinal del íleo.












 uBio
uBio 


