INTRODUCCIÓN
En el contexto actual de cambio climático y avance de la desertificación de sectores de secano en Chile (Emanuelli et al., 2016), el ovino es una especie que debe ser protegida y multiplicada, dada su habilidad para transformar forraje natural de baja calidad en proteína de alto valor (Khan et al., 2022). Como parte de las acciones a tomarse, es relevante hacer más eficientes las tecnologías reproductivas, como la superovulación y la transferencia embrionaria, ya que la variabilidad de la respuesta superovulatoria, además de su alto costo, ha sido una de las mayores limitantes para su uso confiable a nivel comercial (Bartlewski et al., 2016).
La respuesta ovulatoria está influenciada por factores extrínsecos e intrínsecos, incluyendo la raza, edad, estación, ubicación, nutrición, estado reproductivo y la salud de la donante. Se ha demostrado en tratamientos superovulatorios una disminución en la respuesta ovárica tanto en intervalos cortos como largos (Khan et al., 2022). Algunos estudios han demostrado que tratamientos superovulatorios repetidos durante la misma temporada reproductiva disminuyen significativamente la tasa media de ovulación en ovejas (Cordeiro et al., 2003; Forcada et al., 2011; Pinto et al., 2020). Sin embargo, otros estudios realizados en intervalos anuales no han evidenciado cambios significativos en el número de embriones recuperados (Bari et al., 2001).
Los protocolos hormonales se basan principalmente en la inserción de esponjas intravaginales de progesterona durante un máximo de 12-14 días, así como en la estimulación del desarrollo folicular con gonadotropinas exógenas (Khan et al., 2022; Días et al., 2023). La variabilidad en la tasa de ovulación entre animales similares en iguales condiciones se debe mayormente a las dosis utilizadas y al número y frecuencia de las inyecciones de hormonas exógenas (González-Bulnes et al., 2004). Una correcta respuesta superovulatoria sucesiva está asociada al tiempo transcurrido entre una superovulación y otra, y a la menor presencia de formación de adherencias fibrosas en el tracto reproductivo (King et al., 2022). El presente estudio evaluó la repetibilidad de la respuesta superovulatoria con un protocolo modificado, con dosis decrecientes de pFSH y con estrategias de soporte asociadas, utilizando un procedimiento quirúrgico de recuperación embrionaria.
MATERIALES Y MÉTODOS
Animales y Tratamientos
El estudio se realizó en un predio comercial ubicado en el sector del secano costero de la provincia de Cardenal Caro (S34°6’26.57", W71°44’1.03"), en el centro de Chile. Todos los procedimientos de manejo animal y muestreo se realizaron de acuerdo con las directrices aprobadas por el Comité de Ética Científica de la Universidad Santo Tomás, Chile (22-73).
El grupo experimental estuvo compuesto por 12 ovejas Merino Australiano, considerando un número mínimo que permitiera obtener resultados estadísticamente significativos en un contexto de baja disponibilidad de individuos de raza pura en la región, y el costo de implementar el ensayo durante 4 años. Se trabajó con animales de 2-3 años de edad y en aparente buen estado de salud. Tenían historia de parto y condición corporal media de 3.5. No estaban preñadas ni lactantes y se mantuvieron alejadas de los machos. El estudio se llevó a cabo durante cuatro años consecutivos, durante la época reproductiva y con temperatura ambiental comprendida entre 3 y 31 ºC. Todas las ovejas disponían de agua y pastoreaban ad libitum en régimen de descanso-rotación en pradera natural.
Protocolos de Sincronización y Superovulación
Los tratamientos superovulatorios se realizaron una vez al año. Los animales se dividieron aleatoriamente en tres grupos: (G1) como grupo control durante una temporada, (G2) durante tres temporadas consecutivas y (G3) durante cuatro temporadas consecutivas. Cada año se aplicó un protocolo de ovulación múltiple modificado (OCFlock Management Inc., Bowden, Canadá; Figura 1). Todas las ovejas se sincronizaron con dispositivos intravaginales CIDR (día 0), que contenían 0.3 g de progesterona (CIDR, inter Ag, Nueva Zelanda) durante 12 días, que se sustituyeron el día 7 para mantener niveles altos de progesterona en sangre. La super-ovulación se indujo con la aplicación intra intramuscular (IM) de 200 mg de FSH porcina (pFSH, Folltropin®-V, Bioniche Animal Health, USA) dos veces al día (intervalos de 12 h) en ocho dosis decrecientes (36-32-2824-22-20-16 mg), comenzando el día 10 hasta el día 13 (Figura 1).
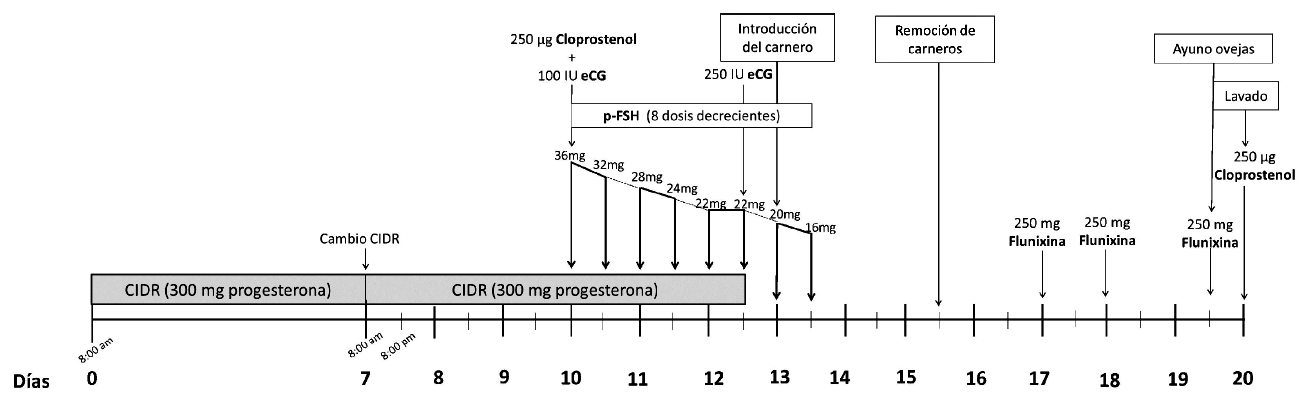
Figura 1. Representación esquemática de los procedimientos experimentales, incluidos los protocolos de sincronización del estro, tratamientos superovulatorios y protocolo de lavado en ovejas Merino Australiano. eCG: gonadotropina coriónica equina; pFSH: FSH porcina; Flunixina: flunixina Meglumine
El día 10, las ovejas fueron tratadas con 100 UI (0.5 mL) de eCG, gonadotropina coriónica equina (Novormon®, Zoetis, España) IM y 250 µg (1 mL) de cloprostenol (Estrumate®, Merck Animal Health, USA) IM como agente luteolítico. El día 12 se retiraron los dispositivos CIDR ylos animales recibieron una inyección de 200 UI de eCG IM.
Los días 13 y 14 se introdujeron carneros, evaluados andrológicamente, para realizar la monta natural en la mañana y en la tarde, utilizando un macho por grupo. Los carneros fueron retirados el día 15 y las hembras fueron tratadas los días 17 a 19 con 3 mL del inhibidor de prostaglandina Flunixin Meglumine (Finadyne, Schering-Plough Animal Health, USA) IM para prevenir pérdidas embrionarias tempranas debidas a factores de estrés (Karasahin et al., 2021). Los animales ayunaron durante el día 19 y fueron sometidos a lavado uterino el día 20.
Recuperación Embrionaria y Respuesta Superovulatoria
La respuesta superovulatoria en cada ovario se observó mediante laparoscopía, contando los cuerpos lúteos (CL). Los embriones se recuperaron mediante técnicas quirúrgicas, según el método descrito por Bruno-Galarraga et al., 2014). Los animales fueron anestesiados con xilacina (0.10 mg/kg, Xila-10®, Drag pharma, Chile) y ketamina (3.5mg/kg; Ketostop®, Drag pharma, Chile) por vía intravenosa. La recuperación embrionaria se realizó al día 7 de la monta natural. Para esto, se hizo una incisión de 5 cm contigua a la línea media para permitir lavados consecutivos. Se localizó el útero mediante técnica laparoscópica (Wolf 4015 lichtprojektor), Alemania y, con la ayuda de una pinza Babcock para reducir el trauma en el útero, se exteriorizaron los cuernos y el cuerpo sobre la cavidad abdominal. Durante este procedimiento, los cuernos uterinos se rociaron permanentemente con solución salina fisiológica con heparina (1000 UI/L a 38 °C) para evitar adherencias y permitir futuros lavados (Ramón-Ugalde et al., 2008). Cada cuerno se enjuagó con 40 mL de medio de lavado comercial (ViGro complete Flush®, Bioniche, USA) precalentado a 38 °C.
Tras la recuperación, se evaluó la morfología embrionaria con un microscopio estereoscópico binocular (Olimphia 60x) y se clasificaron según las directrices de la International Embryo Technology Society (IETS), tanto por su estado de desarrollo como por su calidad (Robertson y Nelson, 2010). Posterior al lavado, la oveja recibió 1 mL de cloprostenol (250 µg) IM para inducir la luteólisis. Catorce días después del lavado uterino, las ovejas fueron expuestas a carneros para realizar la monta natural.
Análisis Estadísticos
En este estudio se registraron variables como la tasa de ovulación (número de CL/ oveja), el número de estructuras recuperadas y de embriones transferibles y degenerados y la tasa de respuesta superovulatoria (número de estructuras recuperadas/número de CL) de todas las ovejas de los tres grupos. Se utilizó la prueba de Kolmogorov-Smirnov para verificar la normalidad de los datos. A continuación, se compararon las variables mediante el análisis de varianza. La repetibilidad de la respuesta superovulatoria se expresó como coeficiente de correlación intraclase y se calculó a partir de la estimación de los componentes de la varianza entre las ovejas y dentro de ellas. Las diferencias entre grupos se consideraron significativas cuando p<0.05. Los resultados se expresan como media ± D.E. Los datos se analizaron utilizando el software Statgraphics Centurion 16.1.15 (Statgraphics Technologies, USA).
RESULTADOS
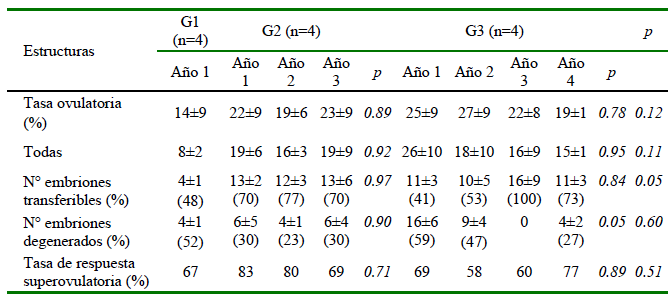
Los valores medios de las estructuras recuperadas y de los embriones transferibles y degenerados se presentan en el Cuadro 1. El número medio de estructuras recuperadas para G1, G2 y G3 en los periodos en estudio fue de 8±2, 18±3 y 19±4, sin diferencias significativas entre grupos (p>0.05). El número medio de embriones transferibles para G1, G2 y G3 fue de 4±1, 13±2 y 12±2, respectivamente (p<0.05), en tanto que el de embriones degenerados fue de 4±1, 5±2 y 7±2, respectivamente (p>0.05). Se observó una alta repetibilidad para el número total de embriones en G2 y G3, y en el número de embriones transferibles en G2 (Cuadro 2).
Cuadro 1. Efecto del número de tratamientos superovulatorios sucesivos con pFSH sobre la recuperación de estructuras y embriones en ovejas Merino Australiano
Cuadro 2. Repetibilidad estimada para el número total de embriones y número total de embriones transferibles en ovejas Merino Australiano en grupos sometidas a sucesivos tratamientos superovulatorios
| Grupo | Variables analizadas | Repetibilidad | Error estándar | p |
|---|---|---|---|---|
| G2 | N° total de embriones | 0.84 | 0.08 | 0.06 |
| (n=4) | N° de embriones transferibles | 0.89 | 0.08 | 0.03 |
| G3 | N° total de embriones | 0.84 | 0.16 | 0.03 |
| (n=4) | N° de embriones transferibles | 0.54 | 0.12 | 0.19 |
DISCUSIÓN
Los resultados del estudio contribuyen a una mejor comprensión sobre los efectos de tratamientos superovulatorios repetidos durante años consecutivos en ovejas Merino Australiano, sobre la producción de embriones in vivo. Es importante destacar que los sujetos de estudio fueron mantenidos en un entorno productivo de características naturales, lo que confiere a los resultados una alta relevancia en cuanto a su aplicabilidad en el contexto del mundo real. Estos resultados proporcionan una valiosa perspectiva para los productores de ovinos en el sector del secano costero de Chile, donde se enfrentan a desafíos específicos en la gestión de sus rebaños.
El protocolo de superovulación y recuperación de embriones in vivo usado en este estudio en cuatro años sucesivos no afectó, tanto en cantidad como en calidad, de las estructuras de recuperación. Los resultados mostraron un aumento en el número de embriones recuperados en tratamientos hormonales aplicados en años consecutivos (Cuadro 1), además se observó una elevada repetibilidad del número total de embriones recuperados para el G2 y del número de embriones transferibles para el G3 (Cuadro 2).
Estudios anteriores han demostrado que la eficacia y el éxito en la producción de embriones depende principalmente de la repetibilidad de la respuesta ovárica individual al tratamiento de superovulación, cuando las ovejas se someten a protocolos hormonales sucesivos. De acuerdo con investigaciones donde se emplearon protocolos sucesivos con intervalos de corta duración (27 a 50 días), se pudo observar que la tasa ovulatoria y la formación de estructuras estuvieron influenciadas por el número de tratamientos superovulatorios, lo que conlleva a una disminución en la producción de embriones (Forcada et al., 2011; Bruno-Galarraga et al., 2014).
La capacidad de respuesta de las ovejas no fue influenciada por la repetición del tratamiento de superovulación, el cual fue realizado en forma anual, durante cuatro años consecutivos. Estos resultados coinciden con Bari et al. (2001) quienes determinaron que con tratamientos anuales no hubo cambios en la tasa media de ovulación o en la duración del embrión. También coincide con lo reportado por Cordeiro et al. (2003), donde la respuesta ovulatoria se mantuvo constante en tratamientos de superovulación con intervalos de 90 días. Se nota que el lapso entre tratamientos repetidos ejerce un efecto significativo en la respuesta ovárica. Esta variabilidad en los resultados en tratamientos superovulatorios repetidos pueden ser atribuibles a la secuencia temporal y dinámica de desarrollo de los folículos, que se extiende desde la reserva folicular hasta el proceso de ovulación, un período que abarca aproximadamente 40 días en el caso de las ovejas.
El efecto positivo de los protocolos de disminución de dosis de FSH en ovejas también fue descrito por Menchaca et al. (2009), obteniendo una mayor respuesta ovárica y producción de embriones. Ribeiro et al. (2022) compararon dos dosis de pFSH (133 y 200 mg), encontrando un aumento significativo del número de estructuras recuperadas (4.8±1.1 vs. 7.5±1.7) y de embriones viables (2.29±0.67 vs. 6.47±1.60, respectivamente). En el presente estudio se observó un mayor número de embriones en comparación con los reportados en la literatura, con dosis decrecientes de 200 mg de pFSH para G2 y G3, posiblemente debido a que en el presente estudio las dosis decrecientes se aplicaron en el curso de cuatro días.
Entre las estrategias de apoyo utilizadas estuvo la aplicación de Flunixin Meglumine, que es un fármaco antiinfla-matorio no esteroideo y un potente inhibidor de la síntesis de prostaglandinas, y favorece la prolongación de la vida útil del cuerpo lúteo (Bergstein-Galan et al., 2020). Por otro lado, el dispositivo CIDR se reemplazó en el día 7 para mejorar el estímulo de la progesterona. En este sentido, Bari et al. (2001) determinaron el efecto de la cantidad de progestágeno (30 vs. 45 mg) encontrando un aumento de la calidad embrionaria al utilizar altas dosis de progestágenos. Además, Taira et al. (2022) establecieron que la suplementación con 0.33 g de progestágeno durante la primera onda folicular del ciclo estral mejoraba la viabilidad embrionaria.
CONCLUSIONES
El protocolo de pFSH modificado y estrategias de soporte usados en este trabajo pueden ser una buena herramienta para tratamientos de superovulación repetidos en diferentes años en ovejas Merino Australiano, ya que permitió obtener una alta cantidad y repetibilidad para el número total de embriones recuperados y transferibles en tres y cuatro años sucesivos.












 uBio
uBio 


