INTRODUCCIÓN
La producción alpaquera es una de las actividades más importantes que se realizan a nivel de la región altoandina, principalmente por la producción de fibra de alta finura y carne con bajos porcentajes de grasa, en comparación con otras especies (Fernández-Baca, 1991; Gutiérrez et al., 2018). Como consecuencia de ello, se han realizado diversos estudios incluyendo el uso de biotecnologías reproductivas para la evaluación del semen de alpaca. En este contexto, Villanueva et al. (2018) evaluaron la influencia del verano e invierno sobre la motilidad y concentración espermáticas, en tanto que Cheuqueman et al. (2013), empleando las sondas SYBR- 14 y ioduro de propidio (PI), evaluaron tanto la viabilidad espermática como la integridad de la membrana plasmática. Por otro lado, Allauca et al. (2019) evaluaron el potencial de membrana mitocondrial (PMM) utilizando el fluorocromo MitoTracker Deep Red. Asimismo, Anzar et al. (2002) evaluaron la apoptosis y su vinculación con la motilidad y fertilidad empleando semen fresco y criopreservado de bovinos.
La palabra apoptosis, al igual que las características morfológicas que se logran apreciar durante el desarrollo celular, fueron inicialmente incorporadas y descritas por Kerr et al. (1972). Se define apoptosis, como una serie de fases que mantienen un orden determinado, donde ocurre un gasto de energía, y se ven involucradas un grupo de cisteínas aspartato proteasas, denominadas caspasas; cuyo principal objetivo es la eliminación completa de la célula (Elmore, 2007). En este sentido, Martí et al. (2008) evaluaron caspasas 3/7 activadas en células espermáticas de carnero, mediante las técnicas de inmunofluorescencia y western blot, mientras que Mendoza et al. (2009) reportaron células espermáticas de ovino con activación de caspasas 3/7 que aumentaron durante la refrigeración, siendo detectadas mediante citometría de flujo, técnica que permite evaluar un gran número de células y marcadores de manera exacta y breve (Omran et al., 2013; Ahlering et al., 2015).
Por otro lado, se ha observado que en los espermatozoides de porcino en contacto con óxido nítrico existe un incremento en la activación de caspasas 3/7 (Moran et al., 2008). En humanos, ovinos y porcinos, se han detectado, una relación entre espermatozoides con caspasas 3/7 de forma activada y la condición del semen (Marchetti P y Marchetti C, 2007; Pichardo et al., 2010); además Weng et al. (2002), también en humanos, observaron una relación negativa entre espermatozoides marcados con caspasas 3/7 y motilidad espermática. Sin embargo, no han encontrado reportes similares sobre la activación de caspasas 3/7 u otro marcador de apoptosis en espermatozoides de alpaca. Por lo tanto, el objetivo del estudio fue establecer la proporción de espermatozoides de alpaca con caspasas 3/7 en su forma activada mediante citometría de flujo.
MATERIALES Y MÉTODOS
Lugar de Estudio
El estudio se llevó a cabo en el Laboratorio de Reproducción Animal de la Facultad de Medicina Veterinaria de la Universidad Nacional Mayor de San Marcos. Lima, Perú.
Obtención de la Muestra
Los testículos de alpaca fueron conseguidos en el camal municipal de Huacavelica, Perú. Los órganos fueron limpiados y sumergidos en pares en bolsas herméticas con suero fisiológico al 0.9%, y transportados a 5 ºC al laboratorio en un lapso de 18 a 20 horas. Se consideró que los testículos tengan un peso mayor a 10 g y una longitud superior o igual a 3 cm. Se calculó el volumen de los órganos (altura x ancho), siendo estos datos indicadores de madurez sexual en la alpaca (Abraham et al., 2015).
Recuperación de Espermatozoides
Se extrajo la túnica parietal y vaginal de cada testículo y se separó la cola del epidídimo. Estas fueron lavadas para retirar el fluido sanguinolento y se colocaron en placas Petri. Se agregó 1 mL de la mezcla de dilución (0.970 g de fructuosa, 1 mL de yema de huevo y 19 mL de leche descremada). Se recuperaron los espermatozoides mediante presión y varios cortes en los epidídimos. Los espermatozoides fueron colectados en microtubos graduados de 1.5 mL.
Concentración y Motilidad Espermática
Se empleó 10 µL de cada muestra seminal para su observación individual sobre una lámina portaobjeto y cubiertas por una lámina cubreobjeto, ambas temperadas (37.5 °C) en un microscopio óptico a 40x para determinar la motilidad.
Para determinar la concentración espermática se tomaron 10 µL de cada muestra, se colocaron en microtubos de 1.5 mL. Se agregó 190 µL de agua (dilución de 1:20), dando como resultado final, un volumen a 200 µL. En una cámara de Neubauer se colocaron 10 µL de cada dilución y se observaron en el microscopio óptico a 40x contabilizando los espermatozoides de los cuadrantes extremos y medio de ambas cámaras para luego hacer un promedio.
Preparación de la Muestra
Se agregó 1 mL de PBS a cada 100 µL de las muestras en cada microtubo individual, en dos oportunidades, para realizar dos lavados por centrifugación (600 G durante 8 min). Luego se eliminó el sobrenadante y se agregó 100 µL a cada microtubo de la solución diluida CellEvent™ Caspasa-3/7 Green Detection Reagent (C10723, Invitrogen), se homogenizó y se incubó a 37.5 °C durante 30 min. A los 20 min de iniciada la incubación se adicionó 0.5 µL de ioduro de propidio (2.4 mM); dando como resultado final una concentración de 12 µM.
Evaluación por Citometría de Flujo
Al término del proceso de incubación se empleó el citómetro de flujo FlowSight (Amnis, USA), para evaluar las muestras dentro de los microtubos. Para excitar las Caspasas 3/7 y el ioduro de propidio se empleó un láser a 488 nm y la emisión de fluorescencia fue detectada utilizando una longitud de onda 505 a 560 nm (Canal 2, Ch02) para Caspasas 3/7 y de 642 a 740 nm (Canal 5, Ch05) para ioduro de propidio.
Análisis Estadístico
Se empleó el programa Graphpad Prim v. 3.0 para el análisis de los datos, obteniendo los principales parámetros de estadística descriptiva. Se hizo uso de la prueba de Kolmogorov-Smirnov (Test K-S), para establecer el tipo de distribución. Por último, los resultados fueron correlacionados con el peso y volumen testicular; así como con la concentración y motilidad seminal.
RESULTADOS
El volumen y peso de los testículos fue de 22.5 ± 6.1 cm3 y 17.1 ± 3.3 g, respectivamente, en tanto que la concentración y motilidad espermática fue de 123.8 ± 101.7x106 y 35.6 ± 22.3%, respectivamente (media ± desviación estándar). Asimismo, el 36.21 ± 11.25% (media ± desviación estándar) de los espermatozoides presentaron activación de caspasas, con un rango del intervalo de confianza de 31.34 a 41.08% y un coeficiente de variación de 31.07%. Los datos siguieron una distribución normal.
En el Cuadro 1 se observa la correlación entre los porcentajes de espermatozoides caspasas 3/7 activadas con las características testiculares y seminales. Solo se encontró una correlación significativa y fuerte al enfrentar los espermatozoides con caspasas 3/7 de forma activada y la suma de las células espermáticas apoptóticas con células muertas.
Cuadro 1. Correlación del porcentaje de células espermáticas caspasas 3/7 activadas con parámetros testiculares y seminales
| Espermatozoides caspasa 3/7 positivos | r | Valor p |
|---|---|---|
| Espermatozoides muertos + apoptóticos | 0.94 | <0.0001 |
| Peso del testículo | 0.20 | 0.36 |
| Volumen del testículo | 0.09 | 0.67 |
| Concentración espermática | 0.26 | 0.23 |
| Motilidad | 0.30 | 0.15 |
En la Figura 1 se aprecia dos Dot Plots (módulos de gráficos) elaborados a partir del análisis de las muestras analizadas. En el modelo A se aprecia inicialmente una viabilidad cercana al 70% y cerca del 30% de espermatozoides en apoptosis; sin embargo, en el modelo B se observa un elevado número de espermatozoides muertos (73%) y una baja cantidad de espermatozoides en apoptosis (2%).
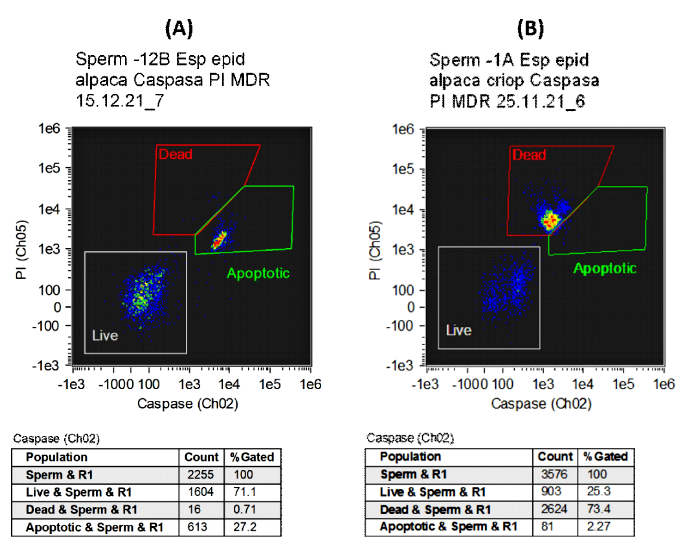
Figura 1. Gráficos de controles luego del análisis de las muestras de espermatozoides epididimarios de alpaca haciendo uso de las sondas fluorescentes Caspasa 3/7 green (Ch02) y Ioduro de Propidio (PI) (Ch05) analizados mediante citometría de flujo. (A) Muestra espermática con elevada proporción de células vivas y moderada proporción de células apoptóticas. (B) Muestra espermática con baja proporción de células vivas y elevada proporción de células apoptóticas
DISCUSIÓN
Este es el primer estudio sobre apoptosis en espermatozoides de alpaca, encontrando un 36.21 ± 11.25% de células apoptóticas. Los valores del intervalo de confianza y del coeficiente de variación indican el nivel de dispersión de los resultados obtenidos.
El proceso de activación de las caspasas 3/7 es un suceso representativo del desarrollo de la apoptosis. La presencia de estas enzimas de forma activa desencadena la cascada de señales celulares que responden a ciertos eventos que favorecen la apoptosis, dando como resultado, una alteración en el mantenimiento del equilibrio necesarios para la sobrevivencia de la célula (Elmore, 2007).
Los resultados indican que los espermatozoides de epidídimo (Caspasas 3/7 positivos), antes de acabar su desarrollo, sufren de alteraciones, ya sea en su ADN o cromosomas, de tal manera que serían depurados o desechados mediante el proceso de la apoptosis. Los resultados obtenidos, por lo tanto, indican que más de un tercio de las células espermáticas de la alpaca, provenientes del epidídimo, están en proceso de apoptosis, estando su capacidad fecundante reducida o limitada.
Si bien no se han encontrado reportes semejantes en espermatozoides de alpaca, Kotwicka et al. (2008) reportan 19.7% de células espermáticas positivas a caspasas 3/7 en humanos, en tanto que Mendoza et al. (2009) encontraron 2.82% de estas células en ovinos, valores inferiores a los del presente estudio. No obstante, en equinos se reportó 31.7% de espermatozoides positivos a caspasas 3/7 (Martin et al., 2017), especie filogenéticamente más cercana a las alpacas, en comparación a humanos o rumiantes.
Es importante mencionar que esta diferencia de resultados podría justificarse por la alta presencia de células espermáticas anormales observadas usualmente en el semen de alpaca (Bravo et al., 1997), como también por el tiempo y condiciones de transporte de los testículos al laboratorio, e incluso por la forma de recolección de los espermatozoides. Se reconoce que las células espermáticas no normales en el epidídimo son eliminadas y reabsorbidas, pues esto es una de las funciones del epidídimo (Oehninger et al., 2003). En consecuencia, se puede asumir que en el eyaculado se debería encontrar un porcentaje inferior de apoptosis en relación con lo encontrado en espermatozoides epididimarios. En ese sentido, en espermatozoides epididimarios de ratón, Zacchini et al. (2021) observaron porcentajes de espermatozoides apoptóticos entre 25 a 45%.
No se encontraron correlaciones significativas entre espermatozoides con caspasas 3/7 y los parámetros testiculares y seminales básicos, tal y como tampoco fue encontrado en porcinos (Morales et al., 2012) y en humanos (Perticarari et al., 2007; Kotwicka et al., 2008). No obstante, en el presente estudio se detectó una correlación significante entre las células espermáticas caspasa 3/7 positivas y la sumatoria de las células espermáticas apoptóticas y muertas. Esto permite inferir que las poblaciones identificadas como apoptóticas y muertas son bastante similares en cuanto a características de fluorescencia, tal y como se reporta en equinos (Martin et al., 2017). Por otro lado, se reporta una relación entre actividad de caspasas 3/7 con fragmentación del ADN y translocación de la fosfatidilserina en espermatozoides humanos (Weng et al., 2002), disfunción mitocondrial y la fragmentación nuclear (Marchetti et al. 2004).
Los resultados indicarían que antes de utilizar muestras aparentemente aceptables de espermatozoides epididimarios para inseminación artificial, criopreservación o fecundación in vitro sería aconsejable evaluar los parámetros de apoptosis en espermatozoides de alpaca como indicador del posible éxito de la técnica a emplearse.












 uBio
uBio 


