INTRODUCCIÓN
La fauna parasitaria juega un rol importante en la estructura de los ecosistemas, interaccionando con sus diversos hospedadores (definitivos, paraténicos e intermediarios), influenciando la dinámica poblacional y comunitaria, inclusive en la relación depre-dador-presa en un hábitat determinado, evitando la sobrepoblación de especies. La fauna parasitaria tiene además un posible rol en el control de especies plaga o invasoras, por lo que se torna importante conocer la diversidad y abundancia de estos organismos en el medio ambiente (Hernández, 2008; Wey-Fabrizius, et al., 2014).
Los helmintos parásitos de organismos acuáticos son capaces de mantener su tasa de infección, virulencia y viabilidad frente a parámetros ambientales extremos y oscilantes, por lo que pueden adaptarse fácilmente a cambios en los factores bióticos y abióticos propios de un nuevo entorno durante un proceso de colonización. No obstante, se ha reportado que este grupo de parásitos puede ser susceptible a contaminantes asociados a químicos de uso agrícola, minero, urbano e industrial o al aumento de radiación solar, lo que permite indicar que ciertos helmintos tienen las cualidades para ser bioindicadores de perturbación en ecosistemas alterados por actividades antropogénicas o por cambios en los patrones climáticos (Brooks y McLennan, 1991; Bhuthimethee et al., 2002; Nhi et al., 2012).
En Ecuador existe escasa información publicada sobre los parásitos en peces de agua dulce (Santos, 2011; Rodríguez2016; Villamar 2017; Ortega, 2019; Intriago, 2021) y en particular de los organismos objetivos en la pesca continental, la cual ocurre principalmente en las regiones de la Costa y Amazonía. Según FAO (2023), la pesca continental en el país no tiene importancia económica, dada la poca información sobre esta actividad y al bajo control por parte de los organismos reguladores en el país. Hasta 2020 se reportó una pesca de 150 t entre las regiones Costa y Amazonía, pero en la actualidad no se encuentran datos certeros de la pesca continental en el país.
El estudio de parásitos en peces es importante por su relevancia socioeconómica y por su impacto en la salud pública, debido a que algunos parásitos que se encuentran en peces dulceacuícolas de consumo humano pueden llegar a causar enfermedades de origen zoonótico. Además, también es necesario conocer el patrimonio natural de este grupo de organismos pues algunos pueden ser bioindicadores de salud ambiental (Vargas et al., 2016). El objetivo de este estudio fue evaluar la helmintofauna gastrointestinal presente en peces comerciales dulceacuícolas de dos provincias de la Costa Ecuatoriana, y caracterizar sus patrones ecológicos y potencial zoonótico.
MATERIALES Y MÉTODOS
El estudio se realizó en sectores comerciales de peces dulceacuícolas de la provincia de Los Ríos (Cantones de Babahoyo-Río Babahoyo [1°47´49.11´´S - 79°31´51.39´´W] y Vinces-Rio Vinces [1°33´21.10´´S - 79°45´08.32´´W]) y en la provincia del Guayas (Cantones Daule-Río Daule [1°51´42.15´´S - 79°58´41.82´´W] y Salitre-Río Salitre [1°49’44"S - 79°48'41"W]).
Se eligió un sitio de expendio de peces dulceacuícolas por cada ciudad. Se colectó un promedio de 80 peces por muestreo, los cuales se realizaron una vez por mes para cada sitio durante la estación seca y lluviosa, siendo entre junio de 2019 a enero de 2020. Las especies ícticas muestreadas fueron: Andinoacara rivulatus (vieja azul), Brycon alburnus (dama), Mesoheros festae (vieja roja), Elotris picta (chalaco), Gobiomorus maculatus (guabina), Hoplias microlepis (guanchiche), Ichthyoelephas humeralis (bocachico), Leporinus ecuadorensis (ratón), Paracetopsis bleekeri (bagre ciego), Pseudocurimata boulengeri (dica) y Rhamdia cinerascens (barbudo). Las muestras de Eleotris picta solo se obtuvieron en la localidad de Babahoyo.
Los peces fueron colocados de forma individual en recipientes plásticos dentro de una hielera con el fin de disminuir la probabilidad de confusión de parásitos externos entre peces. Los peces fueron llevados al Laboratorio de Acuacultura de la Facultad de Ciencias Naturales de la Universidad de Guayaquil, en Guayaquil, Ecuador. En el laboratorio fueron almacenados en congelación (-20 °C) hasta su análisis. La identificación de los individuos se hizo mediante la Guía de peces para aguas continentales en la vertiente Occidental del Ecuador (Jiménez-Prado et al., 2015). Para esto, mediante el uso de un ictiómetro se tomó la longitud total de los peces midiendo desde la cavidad bucal hasta el extremo de la aleta caudal, así como el peso total utilizando una balanza Camry EK5056.
Para el análisis de los endoparásitos, se realizó un corte longitudinal ventral desde el ano hacia la cavidad bucal; y se analizaron los siguientes órganos y estructuras: boca, esófago, intestino, estómago, hígado, corazón y gónadas. Cada porción fue colocada en una placa Petri con una solución salina al 4%, para observar los parásitos bajo el estereomicroscopio Motic SMZ 161.
Para la fijación de cestodos, digeneos y nematodos se colocaron en placas Petri con formol caliente basado en el método de Andersen y Kennedy (1983). Los acantocéfalos se colocaron en agua helada para la eversión de la probóscide y posteriormente se utilizó la metodología propuesta por Brown et al. (1986), se los preservó en alcohol etílico al 75% para su posterior identificación, y después se les colocó en lactofenol durante 2448 h según Petrochenko (1971). Para facilitar la identificación de helmintos se utilizó la técnica de tinción con hematoxilina y verde de malaquita. Para esto, los parásitos fueron hidratados con alcohol al 50 y 30% durante 15 min, se aplicó la tinción y se lavó de inmediato con agua destilada. Luego se procedió a oxidarlos con agua potable por 15 min, y se les deshidrató con alcohol al 50 y 75% por 15 min (Eiras et al., 2006). Los helmintos fueron identificados utilizando como guía los trabajos de Caspeta et al., (2009) y Caspeta (2010). Todas las muestras fueron colocadas en la colección del Laboratorio de Acuacultura de la Facultad de Ciencias Naturales de la Universidad de Guayaquil.
Se determinó la prevalencia, abundancia e intensidad media de los parásitos registrados en cada especie de pez y localidad. Además, se calculó la diversidad de Shannon-Weaver (H´max) según la ecuación H= Σ(Pi’»log2 Pi), la equitatividad de Pielou (J´) con la ecuación J´=H´/H´max . También se calculó la dominancia Simpson (λ) cuya ecuación es λ= Σpi2 y por último el índice de dispersión de los parásitos utilizando la dispersión propuesta por Von Zuben (1997) (Id<1: Distribución aleatoria; Id=1 Distribución uniforme; Id>1 Distribución agregada). Para determinar las diferencias intraanuales se utilizó la disimilitud de Bray Curtis debido a que se quiere determinar la diferencia composicional e interanual de las especies de las localidades muestreadas observando si las especies comparten la misma distribución.Además, se utilizó la curva de acumulación de especies para determinar el número de especies acumuladas a lo largo del esfuerzo de muestreo. La curva de acumulación de especies mostrará la tasa a la que nuevas especies se encuentran, mas no la riqueza total. Todos los cálculos se realizaron mediante el software Past.
RESULTADOS
Se analizaron 2317 individuos de 11 especies de peces para las cuatro localidades, reportándose 15 especies de parásitos. De estos, siete son trematodos digeneos (Clinostomum complanatum, Clinostomum sp1, Clinostomum sp2, Clinostomum sp3, Cladorchiidae sp1, Cladorchiidae sp2 y Cladorchiidae sp3), cinco nematodos (Contracaecum sp, Cucullanus sp, Procamallanus sp 1, Procamallanus sp2 y Rhabdochona sp), dos cestodos (Nominoscolex sp y Proteocephalus sp) y un acantocéfalo (Acanthocephalus sp) (Figura 1). Las metacercarias del género Clinostomum se encontraron enquistadas en el peritoneo y las larvas L3 del género Contracaecum se hallaron enquistadas en la pared intestinal, mientras los demás helmintos fueron colectados en estadio adulto del tracto gastrointestinal de los hospederos.
Para determinar si los muestreos realizados a los helmintos fueron efectivos durante el estudio, la curva de acumulación de especies evidenció que en todas las zonas donde se colectaron las muestras la tendencia es a que se puedan encontrar más especies de helmintos debido a que la curva no llegó a la asíntota respectiva. Es así que durante los muestreos, Vinces presentó el valor más alto con una efectividad de 100%, seguido de Salitre y Daule con 94 y 93%, respectivamente, y Babahoyo con 89%. A pesar de tener valores altos en efectividad como ha sido indicado, se evidencia que se pueden encontrar nuevas especies en las zonas de estudio (Figura 2).

Figura 1. Helmintos reportados en peces de las provincias de Los Ríos y del Guayas (Ecuador). Acanthocephalus sp (a) Clinostomun complanatum (b), Clinostomun sp1 (c), Clinostomun sp2 (d), Clinostomun sp3 (e), Contracaecum sp (f), Cucullanus sp (g), Cladorchiidae sp1 (h), Cladorchiidae sp2 (i), Cladorchiidae sp3 (j) Nominoscolex sp. (k), Procamallanus sp1 (l), Procamallanus sp2 (m), Proteocephalus sp (n) y Rhabdochona sp (o). (2019-2020)
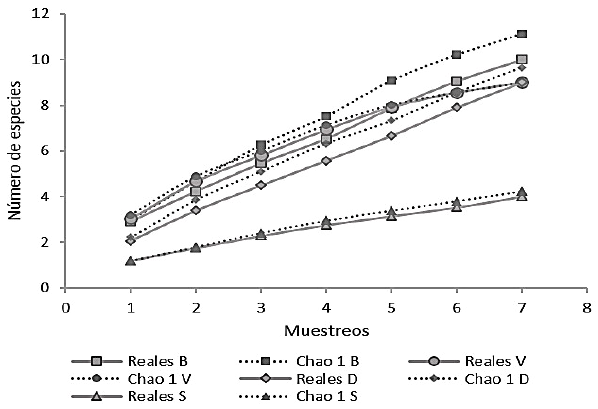
Figura 2. Curva de acumulación de especies en peces en las localidades de las provincias de Los Ríos y del Guayas (Ecuador) durante los ocho meses de muestreo (2019-2020). B (Babahoyo), V (Vinces), S (Salitre) y D (Daule)
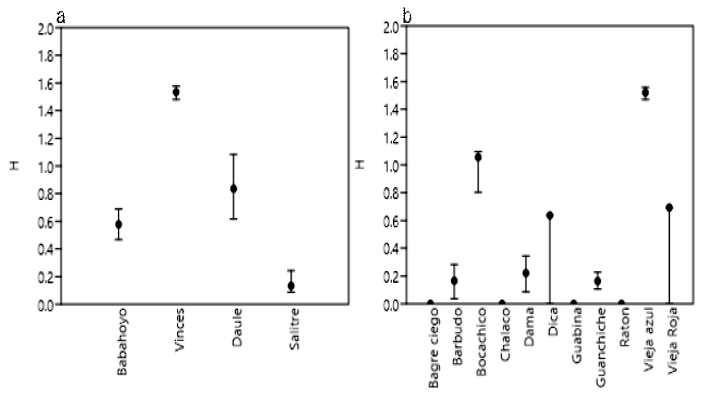
Figura 3. Índice de Shannon para determinar la diversidad de peces de las provincias de Los Ríos y del Guayas (Ecuador) (2019-2020). (a) por localidad y (b) por especie de peces
El mayor número de especies de parásitos se presentó en la localidad de Babahoyo (n=10), seguida de Vinces y Daule (n=9) y Salitre (n=4). En el caso de la ictiofauna, A. rivulatus presentó la mayor cantidad de especies de parásitos (n=6), seguidas de R. cinerascens y H. microlepis (n=4) (Cuadros 1 y 2)
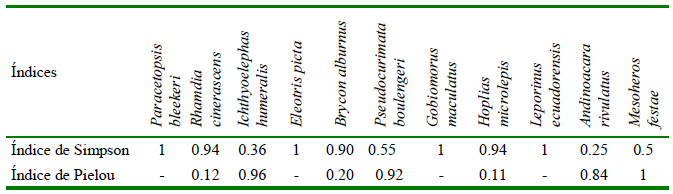
Con relación a la diversidad, el índice de Shannon indica una baja diversidad en las cuatro localidades, siendo Vinces el sitio con mayor diversidad y Salitre la de menor diversidad. Asimismo, el índice de Simpson señala que la dominancia es alta a excepción de Vinces, en tanto que el índice de equidad de Pielou mostró que Vinces fue la localidad con el valor más alto (Cuadro 3, Figura 3). Por otra parte, A. rivulatus presentó la mayor diversidad, el menor valor de dominancia y el cuarto valor más alto de equidad después de I. humeralis, P. boulengeri y M. festae con 0.96, 0.92 y 1.00, respectivamente (Cuadro 4; Figura 3).
En cuanto a los índices parasitarios, de manera general Contracaecum sp obtuvo los mayores valores para los índices de prevalencia, abundancia media e intensidad media en las cuatro localidades (Cuadro 5).
El parásito con los mayores valores en los índices parasitarios fue Contracaecum sp, a excepción de I. humeralis y M. festae que no presentaron este parásito y A. rivulatus que reportó a Clinostomun sp1 como el parásito con mayores valores en los índices parasitarios (Cuadro 6).
Cuadro 2. Especies de parásitos reportadas en peces en las provincias de Los Ríos y del Guayas (Ecuador) (2019-2020)
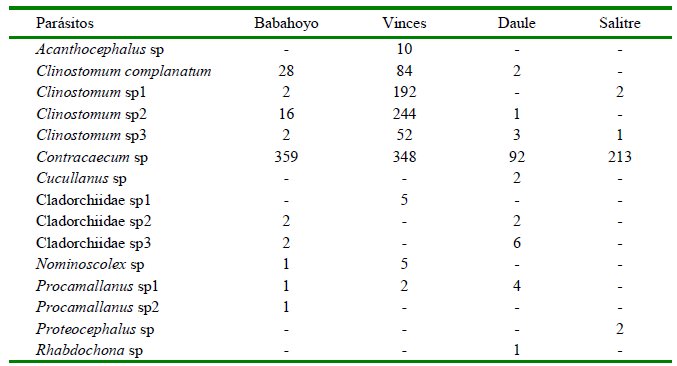
Cuadro 3. Especies de parásitos reportadas en peces de las provincias de Los Ríos y del Guayas (Ecuador) (2019-2020)
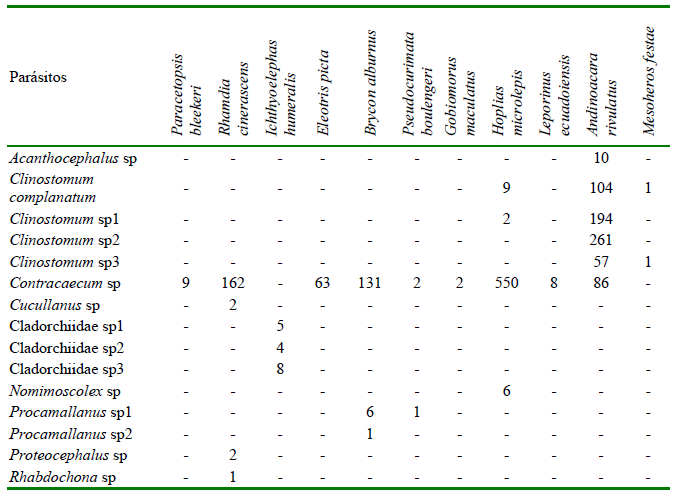
Cuadro 4. Índices de diversidad de peces de las provincias de Los Ríos y del Guayas (Ecuador) (20192020)
| Índices | Babahoyo | Vinces | Daule | Salitre |
|---|---|---|---|---|
| Índice de Simpson | 0.76 | 0.26 | 0.67 | 0.95 |
| Índice de Pielou | 0.25 | 0.69 | 0.38 | 0.1 |
Cuadro 5. Índices de diversidad para peces de las provincias de Los Ríos y del Guayas (Ecuador) (2019-2020)
Cuadro 6. Índices parasitarios para de prevalencia (P), abundancia media (AM), intensidad media (IM) e índice de dispersión (ID) de peces de cuatro localidades de las provincias de Los Ríos y del Guayas (Ecuador) (2019-2020)
| Localidad | Especies de helmintos | P | AM | IM | ID |
|---|---|---|---|---|---|
| Babahoyo | Clinostomum complanatum | 0.018 | 0.045 | 2.54 | a0.26 |
| Clinostomum sp1 | 0.003 | 0.003 | 1 | a0.19 | |
| Clinostomum sp2 | 0.024 | 0.002 | 1 | a0 | |
| Clinostomum sp3 | 0.003 | 0.003 | 1 | a0 | |
| Contracaecum sp | 0.234 | 0.629 | 2.68 | a0.45 | |
| Cladorchiidae sp1 | 0.002 | 0.003 | 2 | a0 | |
| Cladorchiidae sp2 | 0.002 | 0.003 | 2 | a0 | |
| Nomimoscolex sp | 0.002 | 0.003 | 2 | a0 | |
| Procamallanus sp1 | 0.002 | 0.002 | 1 | a0 | |
| Procamallanus sp2 | 0.002 | 0.002 | 1 | a0 | |
| Vinces | Acanthocephalus sp | 0.009 | 0.018 | 2 | a0.07 |
| Clinostomum complanatum | 0.025 | 0.160 | 6.36 | a0.80 | |
| Clinostomum sp1 | 0.013 | 0.346 | 27.58 | c26.91 | |
| Clinostomum sp2 | 0.029 | 0.445 | 15.5 | c20.25 | |
| Clinostomum sp3 | 0.009 | 0.093 | 10.4 | a0 | |
| Contracaecum sp | 0.212 | 0.677 | 3.19 | a0.49 | |
| Cladorchiidae sp1 | 0.002 | 0.009 | 5 | a0 | |
| Nomimoscolex sp | 0.007 | 0.009 | 1.25 | a0 | |
| Procamallanus sp1 | 0.004 | 0.004 | 1 | a0 | |
| Salitre | Clinostomum sp1 | 0.004 | 0.004 | 2 | a0 |
| Clinostomum sp3 | 0.002 | 0.002 | 1 | a0 | |
| Contracaecum sp | 0.160 | 0.424 | 2.64 | a0.36 | |
| Proteocephalus sp | 0.002 | 0.004 | 2 | a0 | |
| Daule | Clinostomum complanatum | 0.003 | 0.005 | 2 | a0 |
| Clinostomum sp2 | 0.003 | 0.003 | 1 | a0 | |
| Clinostomum sp3 | 0.005 | 0.008 | 1.50 | a0.02 | |
| Contracaecum sp | 0.175 | 0.342 | 1.95 | a0.16 | |
| Cucullanus sp | 0.003 | 0.005 | 2 | a0 | |
| Cladorchiidae sp2 | 0.005 | 0.005 | 1 | a0 | |
| Cladorchiidae sp3 | 0.003 | 0.016 | 6 | a0 | |
| Procamallanus sp1 | 0.011 | 0.011 | 4 | a0.09 | |
| Rhabdochona sp | 0.003 | 0.003 | 1 | a0 |
a distribución aleatoria; c distribución agregada
Cuadro 7. Índices parasitarios para peces de cuatro localidades de las provincias de Los Ríos y del Guayas (Ecuador) (2019-2020). Prevalencia (P), abundancia media (AM), intensidad media (IM) e índice de dispersión (ID)
| Especies de peces | Especies de helmintos | P | AM | IM | ID |
|---|---|---|---|---|---|
| Paracetopsis bleekeri | Contracaecum sp | 0.156 | 0.222 | 1.43 | a0.01 |
| Rhamdia cinerascens | Contracaecum sp | 0.328 | 0.915 | 2.79 | a0.46 |
| Cucullanus sp | 0.005 | 0.011 | 2 | a0 | |
| Proteocephalus sp | 0.005 | 0.011 | 2 | a0 | |
| Rhabdochona sp | 0.005 | 0.005 | 1 | a0 | |
| Ichthyoelephas humeralis | Cladorchiidae sp1 | 0.008 | 0.04 | 5 | a0 |
| Cladorchiidae sp2 | 0.032 | 0.048 | 1.5 | a0.01 | |
| Cladorchiidae sp3 | 0.024 | 0.08 | 3.33 | a0.22 | |
| Eleotris picta | Contracaecum sp | 0.545 | 2.864 | 2.86 | a0.71 |
| Brycon alburnus | Contracaecum sp | 0.341 | 0.602 | 1.76 | a0.12 |
| Procamallanus sp1 | 0.023 | 0.033 | 1.43 | a0.046 | |
| Procamallanus sp2 | 0.003 | 0.003 | 1 | a0 | |
| Pseudocurimata boulengeri | Contracaecum sp | 0.004 | 0.004 | 1 | a0 |
| Procamallanus sp1 | 0.002 | 0.002 | 1 | a0 | |
| Gobiomorus maculatus | Contracaecum sp | 0.069 | 0.069 | 1 | a0 |
| Hoplias microlepis | Clinostomum complanatum | 0.003 | 0.027 | 9 | a0 |
| Contracaecum sp | 0.506 | 2.015 | 3.99 | a0.43 | |
| Nomimoscolex sp | 0.015 | 0.018 | 1.2 | a0.005 | |
| Leporinus ecuadorensis | Contracaecum sp | 0.013 | 0.022 | 1.67 | a0.01 |
| Andinoacara rivulatus | Acanthocephalus sp | 0.02 | 0.044 | 2.17 | a0.03 |
| Clinostomum complanatum | 0.081 | 0.367 | 4.54 | c1.23 | |
| Clinostomum sp1 | 0.377 | 0.714 | 1.89 | c13.72 | |
| Clinostomum sp2 | 0.061 | 0.842 | 13.89 | c7.27 | |
| Clinostomum sp3 | 0.03 | 0.192 | 6.33 | c11.49 | |
| Contracaecum sp | 0.205 | 0.306 | 1.49 | a0.08 | |
| Mesoheros festae | Clinostomum sp1 | 0.026 | 0.026 | 1 | a0 |
| Clinostomum sp3 | 0.026 | 0.026 | 1 | a0 |
a distribución aleatoria; c distribución agregada
DISCUSIÓN
Los índices parasitarios variaron tanto en localidades como en las especies ícticas, teniendo así que a pesar de presentar valores superiores a los mostrados en otros trabajos, como el realizado por Santos (2011) en Babahoyo con 0.30 bits de diversidad de Shannon, 0.19 para la equitatividad de Pielou y 0.90 de dominancia de Simpson, la diversidad para las localidades y peces muestreados es baja siendo todas menores a dos bits, aunque la equitatividad para la localidad deVinces presentó un valor de 0.69, que corresponde a un valor moderado en lo que se refiere a la distribución de especies para esa zona. Ese resultado está vinculado a la baja dominancia presente en ese lugar, contrario a las demás localidades que presentan valores altos de dominancia y bajos de equitatividad, lo que muestra un desequilibrio en la población, debido a que todas las muestras de Vinces provienen de un área natural protegida; es decir, un ecosistema probablemente menos expuesto a contaminación antropogénica y, por ende, con mayor equilibrio poblacional, lo cual también es descrito por Madanire-Moyo y Barson. (2010).
La diversidad en peces y localidades se considera baja; no obstante, los peces I. humeralis, P. boulengeri y A. rivulatus fueron los únicos que presentaron valores con una dominancia bajayun equilibriopoblacional alto. Los valores de P. boulengeri se deben a que presentaron solo dos especies de nematodos con una abundancia igual o menor a dos individuos para cada una, lo que hace que la presencia de dichos helmintos probablemente sea una infestación oportunista. Esto se asume debido a que esta especie presentó el mayor número de individuos muestreados y aun así el reporte de parásitos encontrados fue el más bajo. Por otro lado, podrían ser especies generalistas y, por lo tanto, con tendencia a ser poco específicas en lo que se refiere a sus hospederos paraténicos y definitivos.
El parásito con mayor prevalencia en todas las localidades y peces en los que se lo reportó fue la larva L3 del anisákido Contracaecum sp. La localidad de Babahoyo y la especie H. microlepis presentaron la mayor cantidad de registros para este nematodo, mostrando ser una especie generalista en lo referente a sus hospederos paraténicos. Se observó que estas larvas poseen una amplia plasticidad para infectar peces de diferentes niveles tróficos y una gran capacidad de adaptabilidad a un amplio rango de ambientes dulceacuícolas (Mancini et al., 2014), aunque también habría que evaluar la susceptibilidad del pez hospedero, la abundancia de hospedadores definitivos, el sexo y el tamaño (edad) entre otros parámetros que pueden influenciar en la prevalencia de la infección (Mancini et al. 2014).
Santos (2011) encontró que la especie con mayor cantidad de reportes para Contracaecum sp fue B. dentex con una prevalencia de 31%, mientras Villamar (2017) registró prevalencias de 59.3% de este nematodo para A. rivulatus y de 33.3% para B. alburnus; resultado que podría estar asociado al tipo de alimentación, ya que los peces carnívoros fueron los que presentaron mayor concentración de estas especies de parásitos, toda vez que este nematodo utiliza microcrustáceos como copépodos y peces como hospedadores intermediarios (Moravec, 2009). Esto se torna relevante debido a que varios de los helmintos reportados en este estudio presentan ciclo de vida indirecto y la infección se produce por medio de la depredación del hospedero intermediario o paraténico.
Algunos de estos helmintos poseen potencial zoonótico, como Contracaecum sp, que ha sido reportado infectando diversos peces de agua dulce de la Región Neotropical (Luque et al., 2011; Monroy, 2019). Asimismo, diversas especies de Clinostomum reportadas en este estudio se encuentran ampliamente distribuidos en ambientes dulceacuícolas, y que han sido reportados en peces amazónicos de Brasil y Perú, usados para el consumo humano (Murrieta-Morey et al., 2022). La infección humana de tipo accidental puede ocurrir al consumir carne de pescado cruda o semicruda infectada con la metacercaria para el digeneo o la larva L3 para el nematodo, pues, aunque se les suele encontrar infectando las vísceras, las larvas anisakidas tienen la capacidad de migrar tanto intra vitam como post mortem, fenómenos influenciados por el tipo de técnicas de manipulación y almacenamiento empleadas durante la actividad pesquera (Sutili et al., 2014; Mattiucci et al., 2018).
Los hábitos gastronómicos de la población ecuatoriana estarían relacionados al riesgo de infección por estas ictiozoonosis, que, aunque dentro de su cultura gastronómica no suelen consumir pescado crudo, fruto de los procesos migratorios, motivados por la globalización comercial y los conflictos sociopolíticos regionales, se han introducido platos foráneos preparados en base a pescado crudo sin previa congelación como cebiche, sushi y sashimi, entre otros, donde las larvas permanecen viables (Apt, 2013), e incluso pueden sobrevivir a un amplio rango de tratamientos térmicos y sustancias químicas que suelen ser usadas como medidas de inocuidad para los productos de origen pesquero y acuícola (Osanz-Mur, 2001).
La presencia de estadios larvales de helmintos de importancia zoonótica ha sido reportada en varias especies de peces ecuatorianos. Así, Contracaecum sp fue observado en Brycon dentex, Aequidens rivulatus, Hoplias microlepis, Rhamdia cinerascens y Leporinus ecuadorensis (Santos, 2011); además de Contracaecum sp y Clinostomum complanatum en Andinoacara rivulatus y B. alburnus (Villamar, 2017) y de Contracaecum sp en Oreochromis sp, H. microlepis e Ichthyoe-lephas humeralis en los ríos Vinces y Mocache (Ortega, 2019). No obstante, no se conocen casos humanos vinculados a estos grupos parasitarios, pero se reportó gnatosto-miosis en personas por primera vez en Ecuador entre 1981 y 1984 a partir de las especies intermediarias de Gnathostoma sp en H. microlepis e Isosthistus remiser (Ollague et al., 1981, 1984, 1988).
CONCLUSIONES
La diversidad de especies parasitarias fue baja para en las cuatro localidades y en los peces colectados, donde la localidad de Vinces y el pez Andinoacara rivulatus presentaron los valores de diversidad de Shannon más altos.
Los valores de dominancia y equitatividad mostraron que solo la localidad de Vinces tiene una población equilibrada de parásitos, como es el caso de los peces Ichthyoelephas humeralis, Leporinus ecuadorensis y A. rivulatus.
Contracaecum sp fue la especie con mayor prevalencia para todas las localidades y la mayoría de peces muestreados, a excepción de A. rivulatus cuyo parásito con mayor prevalencia fue Clinostomum sp 1.












 uBio
uBio 


