INTRODUCCIÓN
La neosporosis, cuyo agente etiológico es el protozoario aplicomplexo Neospora caninum, es una enfermedad de amplia distribución mundial que afecta a múltiples especies de animales domésticos con daños a nivel reproductivo y neuromuscular (Dubey et al., 2017) generando grandes pérdidas económicas al sector pecuario (Blanco et al., 2015). El parásito posee un ciclo de vida indirecto, siendo los cánidos domésticos, coyote, dingo y lobo gris sus hospederos definitivos (Dubey et al., 2005) y la transmisión en los rumiantes puede ocurrir por transmisión vertical y horizontal (Dubey, 2003; De Barros et al., 2018). Asimismo, las aves y roedores pueden cumplir un rol de diseminación; debido a que los caninos silvestres y domésticos ingieren los quistes tisulares al cazarlos (Gondim, 2006; De Barros et al., 2018).
En Perú, la producción caprina se encuentra concentrada en la costa y sierra (MIDAGRI, 2008), siendo Piura la región de mayor población con 260 221 cabezas de ganado según el IV Censo Nacional Agropecuario de 2012 (INEI, 2012). Estos animales se encuentran mayormente en manos de ganaderos de bajos recursos, constituyendo una de sus principales actividades económicas a través de su producción cárnica y/o láctea (Arroyo, 2007; Hassan et al., 2011).
La neosporosis está ampliamente descrita en los bovinos y se le señala como una de las principales causas de aborto y de nacimiento de terneros con alteraciones neuromusculares y bajo peso (Vargas y Cortés, 2001); sin embargo, su presencia en la producción caprina ha sido poco estudiada con reportes de nacimientos de crías débiles, mortinatos y abortos, pero sin cuantificar las mermas económicas (Unzaga et al, 2014; Blanco et al., 2015).
La transmisión vertical constituye la principal forma de transmisión dentro del rebaño, favoreciendo su pasaje a través de generaciones (De Oliveira et al, 2020). Asimismo, la presencia de perros en zonas de pastoreo favorece la transmisión horizontal debido a la liberación de ooquistes al medio ambiente que en condiciones climáticas favorables se vuelven infectivos (Puray et al., 2006; Vega et al., 2010). No se dispone de estudios sobre la seroprevalencia de N. caninum en caprinos del país. Los estudios realizados en bovinos lecheros de Lima y Arequipa reportan seroprevalencias entre 10.5 y 69.9% y en ceja de selva de Oxapampa, Pasco, de 18.8% (Rivera et al., 2004; Gamarra et al., 2009; Portocarrero et al., 2015). En ovinos se cuenta con un estudio en Junín con una seroprevalencia del 0.82% (Chilge, 2018). En llamas y alpacas del Altiplano se reportaron prevalencias de 32.9 y 35.9%, respectivamente (Chávez-Velásquez et al., 2004).
No existe un tratamiento eficaz contra la neosporosis, de allí que los animales positivos solo queda pasarlos a descarte (camal) para evitar la transmisión vertical (Hall et al., 2005). Por lo tanto, la principal estrategia para controlar esta enfermedad es el desarrollo de medidas sanitarias adecuadas que ayuden a reducir la probabilidad de exposición a los ooquistes en las pasturas (Radostis, 2002), además de la eliminación de los animales infectados para evitar la transmisión vertical y horizontal (Álvarez, 2016).
La falta de información sobre la seroprevalencia de N. caninum en caprinos en Piura, principal región productora de esta especie y los diferentes factores de riesgo, ameritan la ejecución de estudios epidemiológicos que determinen la presencia de anticuerpos contra este protozoario y los posibles factores que contribuyen a su permanencia en las explotaciones caprinas. Ante esto, el objetivo del estudio fue determinar la seroprevalencia de Neospora caninum en caprinos de la región Piura, Perú.
MATERIALES Y MÉTODOS
Lugar de Estudio
Se evaluaron caprinos mayores a seis meses de edad procedentes de la región Piura que fueron muestreados durante los meses de setiembre, octubre y noviembre de 2017. El análisis serológico se realizó en el Laboratorio de Parasitología de la Facultad de Medicina Veterinaria (FMV) de la Universidad Nacional Mayor de San Marcos (UNMSM), en Lima, Perú.
Muestras Serológicas
Las muestras de sangre fueron colectadas a nivel nacional por el Servicio Nacional de Sanidad Animal (SENASA), dentro del marco del programa de control sanitario de brucelosis caprina en 2017. Los sueros resultantes de la región Piura fueron donados a la FMV-UNMSM por el SENASA, así como los datos epidemiológicos (edad, sexo, altitud, sistema de crianza, provincia y distrito de procedencia) de cada animal.
Prueba Diagnóstica
Se procesaron 361 sueros caprinos utilizando el kit de diagnóstico ID Screen Neospora caninum competition siguiendo el protocolo indicado por el fabricante (Innovative Diagnostics). La prueba es un ELISA competitivo basado en la detección de anticuerpos o inmunoglobulinas IgG contra N. caninum en suero o plasma de varias especies de rumiantes, perros y otras especies susceptibles (ID.vet, 2021).
Se calculó el porcentaje de competición (S/N %) de cada muestra y para la interpretación de los resultados se consideró como animales positivos valores de S/N % d» 50%), dudosos (entre 50 a d»60%) y negativos valores de S/N % >60%; según las indicaciones del inserto del kit (IDvet, 2017).
Análisis Estadístico
Se calculó la seroprevalencia general de la región y de cada una de las ocho provincias (Ayabaca, Huancabamba, Morropón, Paita, Piura, Sechura, Sullana,Talara), la edad (≤1-3, ≥3 años), la altitud (≤500 y entre 500 a 2500 msnm) y el sistema de crianza (extensivo, intensivo) expresadas en forma porcentual con sus respectivos intervalos de confianza al 95%.
RESULTADOS Y DISCUSIÓN
Los 361 animales muestreados fueron hembras. Se encontró una seroprevalencia de 3.32% (IC 95% 1.47-5.17%) baja de anticuerpos contra N. caninum. De todos los sueros, una cabra de dos años resultó dudoso (Cuadro 1), siendo probable que se encontrara en las fases iniciales de la infección en donde hay más presencia de IgM que IgG. No se encontraron animales positivos en las provincias de Huancabamba, Paita, Sechura y Talara; sin embargo, en las provincias de Morropón y Sullana se encontraron las mayores seroprevalencias con valores de 8.11% (IC 95% 0-16.91) y 5.83% (IC 95%: 1.3010.36), respectivamente (Cuadro 1).
Cuadro 1. Distribución de caprinos seropositivos a Neospora caninum por la prueba de ELISA de competencia según la provincia de procedencia en la región Piura-Perú (2017)
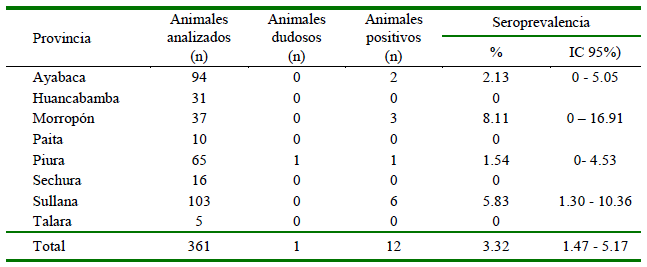
La seroprevalencia de N. caninum en caprinos a nivel mundial es muy variable. Los resultados del presente estudio son concordantes con las frecuencias de 3.27, 6.65 y 3.85% en Brasil, Argentina y México, respectivamente (Faria et al., 2007; Moore et al., 2007; Huerta-Peña et al., 2011), pero son menores a los valores hallados en Brasil de 15.1% (Uzeda et al., 2007), 17.4% (Modolo et al., 2008) y 26.1% (Braz et al., 2018).
Esta diversidad de seroprevalencias se debe a factores como la edad, sexo, clima, geografía, número de muestras y, ciertamente, las pruebas de diagnóstico empleadas (Dubey et al., 2017). No se encontró estudios que determinen los rangos exactos de temperatura y humedad necesarios para la supervivencia de sus ooquistes en el medio ambiente, aunque Quiroz et al. (2011) señala que fluctuaciones de alta y baja humedad con temperaturas bajas favorece la esporulación y viabilidad de los ooquistes; asimismo, Lindsay et al. (1999) reportan que los ooquistes son capaces de esporular dentro de las 24 h posteriores a su liberación cuando estas condiciones son óptimas.
La región Piura presenta un clima seco con temperaturas promedio de 24 °C, que llegan a superar los 35 °C en el verano y con humedad variable que en promedio está en 67% (SENAMHI, 2016; MIDAGRI, 2021); condiciones que probablemente no favorecen la supervivencia del ooquiste de N. caninum en el medio ambiente y sería la razón por la baja seroprevalencia (3.32%.) encontrada. No obstante, Pilco y Serrano-Martínez (2018) reportaron en camélidos sudamericanos de la región Huancavelica un valor de 12.2% de seroprevalencia, atribuyendo que la baja temperatura y alta humedad de la zona fueron factores favorables para la supervivencia del ooquiste.
No se pudo evaluar la asociación entre la seroprevalencia de N. caninum con las variables del estudio debido a que el número de animales dentro de cada categoría no fueron proporcionales ni comparables y al menos en una categoría de cada variable no se encontró animales seroreactivos (Cuadro 2). Así, para el caso de la edad, solo tuvieron muestras de 46 animales menores a un año, resultando todos negativos. Por otro lado, las seroprevalencias de 4.24% para animales mayores de un año y de 2.53% para cabras mayores a tres años permite concluir que entre animales adultos (1-3 años y ≥ 3 años) no hay diferencias significativas (Cuadro 2). Por otro lado, Braz et al. (2018) en Brasil tampoco encontraron asociación significativa (p=0.59) entre los animales menores y mayores a un año, justificando la poca cantidad de animales menores a un año (66 caprinos) y la gran cantidad de animales adultos (340 caprinos), valores que no son comparables ni homogéneos y que pueden interferir en el análisis estadístico.
Cuadro 2. Distribución de caprinos seropositivos a Neospora caninum por la prueba de ELISA de competencia según las variables edad, altitud y sistema de crianza en la región Piura-Perú (2017)
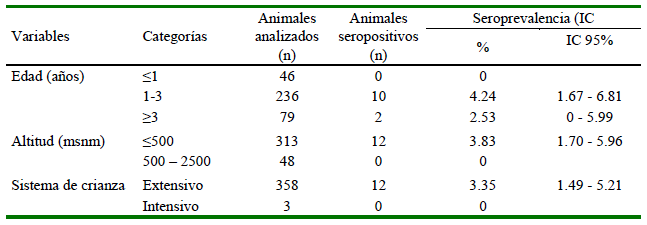
Existen estudios que reportan a la edad como posible factor de riesgo. En China, Sun et al. (2019) hallaron que animales mayores a tres años presentaron asociación significativa con la seroprevalencia en comparación con los de 1-2 años con seroprevalencias de 20.7% y 4.8%, respectivamente. Esto debido a que los animales adultos, por su mayor tiempo de vida, han tenido mayor oportunidad de exponerse a la presencia del parásito por consumo de sus ooquistes esporulados a través de las pasturas y el agua (Gamarra et al., 2009).
La presencia de pocos juveniles en los hatos se debe, principalmente, a que la saca en la producción caprina del país se realiza al mes de edad por la gran demanda de la carne de cabrito (Arroyo, 2007) y a la renuencia de los productores de permitir el muestreo en estos animales jóvenes por el temor a un mal manejo. Asimismo, la menor cantidad de hembras mayores a 3 años se debe a la disminución de sus niveles de producción de leche, de allí que son reemplazados por hembras más jóvenes (García et al., 2020).
La mayor cantidad de animales muestreados se encontraron en altitudes menores de 500 msnm (313 caprinos) en comparación de aquellos a mayor altitud (48 caprinos), sin hallar algún animal seroreactivo en estos últimos (Cuadro 2). Son escasos los estudios que evalúan la influencia del piso altitudinal en la seroprevalencia de N. caninum en caprinos. Entre estos, Gazzonis et al. (2016) en Italia reportaron que animales criados a menor altura tienen mayor riesgo de infectarse, mientras que Macias (2018), en bovinos de Colombia, no halló dicha asociación. Sin embargo, cabe resaltar que los resultados del presente estudio no son concluyentes debido a la poca cantidad de muestras de caprinos obtenidas en altitudes superiores a los 500 msnm.
La crianza caprina en el Perú está concentrada casi en su totalidad, dentro del sistema extensivo, en manos de productores de bajos recursos y con escasa tecnificación (Arroyo, 2007). Razón que explicaría, en el presente estudio, la presencia de solo tres animales criados bajo un sistema intensivo y que a la vez todos fueran seronegativos en contraposición con los del sistema extensivo (358 caprinos) quienes presentaron una seroprevalencia del 3.35% (Cuadro 2). Otros estudios reportan que el sistema extensivo presenta un mayor riesgo de infección por neosporosis ya que el pastoreo favorece la exposición al consumo de ooquistes esporulados presentes en las pasturas y agua (Moore et al., 2002). Este riesgo se ve incrementado en la crianza caprina, ya que se realiza en forma conjunta con ovinos y bovinos con mínimo control sanitario y presencia de perros (Arroyo, 2007).
Los perros al ser hospederos definitivos juegan un rol muy importante como dispersores de los ooquistes de N. caninum en el medio ambiente. En las condiciones de los criadores de caprinos en la región del estudio, el perro puede llegar a alimentarse de la placenta o de los fetos abortados, principalmente de bovinos, y con ello ingerir los quistes tisulares de N. caninum, para luego de cinco días pos-infección liberar ooquistes no esporulados en las heces que en condiciones óptimas se volverán infectivos contaminando las pasturas y el agua perpetuando la continuidad del ciclo de vida del protozoario (Bartova y Sedlak, 2012).












 uBio
uBio 


