INTRODUCCIÓN
Las aves de las granjas avícolas de producción intensiva tienen un alto riesgo de contraer enfermedades infecciosas, causando pérdidas económicas tanto en el pollo de engorde como en la gallina ponedora, amenazando la seguridad alimentaria. La producción mundial de carne de pollo fue estimada en 100 millones de toneladas (USDA, 2021) y de huevo en 73 millones de toneladas en 2020 (FAO 2018)
Virus como el de la bronquitis infecciosa aviar (VBIA) y el virus de la gripe aviar provocan riesgos significativos en la salud pública y la economía mundial (Barjesteh et al., 2020). La BIA es causada por un virus del género Gammacoronavirus, familia Coronaviridae, y es una de las enfermedades que se encuentran en el código sanitario de los animales terrestres de la OIE (2021). La patología se caracteriza por complicaciones respiratorias, renales, reproductivas y digestivas, lo que ocasiona una alta morbilidad y dependiendo de su variante genética puede variar la mortalidad (Seger et al., 2016; Karimi et al., 2019)
El VBIA es capaz de mutar y recombinarse rápidamente, lo cual genera nuevos serotipos que se tornan difíciles de diagnosticar y controlar (Bande et al., 2017) Este virus tiene afinidad por las células epiteliales del tracto respiratorio superior de las aves en donde se replica provocando cambios inmunológicos, moduladores y morfológicos (Okino et al., 2017). La infección ocasiona síntomas nefrogénicos y respiratorios en pollos de engorde y una disminución de la fertilidad y la incubabilidad en las gallinas ponedoras (Jakhesara et al., 2018), además de causar cambios en la formación de la cáscara de huevo provocadas por células citotóxicas y citocinas proinflamatorias que alteran la expresión de colágeno tipo I en el istmo y en el útero (Nii et al., 2014).
La enfermedad fue descrita por primera vez en 1931 en Estados Unidos de Norteamérica (Schalk y Haawn, 1931), siendo demostrado años más que el agente causal era un virus (Beach y Schalm, 1936), que actualmente se le conoce como VBIA. Desde esas fechas se han llevado a cabo múltiples estudios que han ido descubriendo diversas y nuevas variantes y serotipos del VBIA (Jackwood, 2012), siendo el serotipo Massachusetts (Mass) el más utilizado como cepa vacunal (Saif et al., 2009). En la presente revisión se recopiló información actualizada sobre la evolución filogenética del VBIA y se analiza el impacto en la respuesta inmunogénica en sistemas de producción avícola.
Componentes del Virus
El VBIA es un ARN capsulado, conformado por 500 a 600 aminoácidos distribuidos en cuatro proteínas estructurales, entre las cuales se encuentra en grandes cantidades la glicoproteína integral de la membrana (M), y en menores cantidades una proteína no glicosilada asociada a la membranas (E), la proteína de la nucleocápside (N) asociada con el RNA del genoma viral desempeñando un papel esencial en la replicación y traducción delARN viral, y la proteína de la espícula (S) que se encuentra aferrada a la membrana por la porción carboxiterminal de la subunidad 2 (S2) que interactúa con la región transmembrana de la proteína M (Cavanagh, 2007).
Se ha evidenciado que la proteína N puede inducir altos títulos de anticuerpos de reacción cruzada e inmunidad celular, lo que protege a los pollos de la infección aguda (Han et al., 2013). La proteína S es un dímero o trímero, cuya función es incorporar el virus a unas moléculas receptoras en la célula del huésped, activando la unión de la membrana del virón con las membranas del huésped y liberando el genoma viral en la célula. Esta proteína tiene dos subdivisiones: la S1 que es amino-terminal y la S2 que es carboxi-terminal. La subunidad S1, ubicada en el exterior del virus, es responsable de la unión entre la envoltura del virus y la membrana celular del huésped, de ahí su importancia en la respuesta inmunológica (Cavanagh, 2007; Jackwood, 2012).
La comparación de la secuencia de otros coronavirus y la secuencia del epítopo 15E2 mostraron que el epítopo está bien conservado entre los coronavirus de pollo y pavo, concluyendo que el epítopo E152 puede ser útil como herramienta en la clínica para el estudio de la estructura y función de la proteína M del virus de BIA (Xing et al., 2009). Adicionalmente, los microARN (miARN) son importantes reguladores intracelulares y juegan un papel fundamental en las infecciones virales. Un estudio demuestra que los miARN regulan la replicación del VBIA mediante la enzima desubiquitinadora (DUB) (Li et al., 2020).
Distribución de la Bronquitis Infecciosa Aviar
La BIA es de distribución global (Cavanagh, 2007). En la medida que se identifican las variantes, se ha podido describir diferencias en las manifestaciones clínicas, morbilidad y mortalidad. Estas variantes con el paso del tiempo han dado lugar a serotipos clásicos, tales como las cepas Mass, 4/91, M28 y la M41 (Chen et al., 2015). Incluso en 1960 se aislaron nuevas cepas de tipo Mass entre las que se encontraban Connecticut y SE17 (Jia et al., 2002). En 1970, en Europa se identificaron nuevas variantes del virus, serotipos designados como D274, D1466, D3896 y D3128, aislados de grupos aviares previamente vacunados con cepas de Mass (Dawson y Gough, 1971) En 1999, la cepa 793/B se identificó como el serotipo predominante en el Reino Unido (Adzhar et al., 1997). También se reportaron otros serotipos europeos del genotipo Mass en Francia, Bélgica, Italia, Polonia y España (Bande et al., 2017). En 1990, Suecia reveló en el análisis filogenético que las cepas de tipo Massachusetts fueron reemplazadas por cepas similares a D388/QX; sin embargo, no se identificó el vínculo evolutivo entre ellas (Abro et al., 2012).
Entre 2002 y 2006 se identificaron variantes del VBIA en Europa Occidental, siendo predominante el serotipo 793B, seguido de Mass, H120, M41, IBM, Italia02, y una variante cercana relacionada con el aislado chino QX, identificados previamente en Reino Unido y España (Worthington et al., 2008).
Los reportes de cepas del VBIA en el continente asiático datan de principios de la décadade1960.Así,enTailandia se identificó la cepa THA80151 con similitud a la cepa QX-like, al comparar el desafío entre pollos vacunados y no vacunados con la cepa Mass y Connecticut (Sasipreeyajan et al., 2012), en tanto que con la variante 4/91 se demostró una protección incompleta con lesiones traqueales y renales significativas (Pohuang et al., 2016).
En el norte de India se aislaron cepas provenientes de pollos de engorde, concluyendo que podrían tener una cepa reversible desarrollada a partir de las cepas de vacunas vivas atenuadas de uso común en la región (Jakhesara et al., 2018). En China, en la década del 80, se informó de un brote pudiéndose clasificar cepas de tipo A2 y QX-IBV (Li et al., 2012), en tanto que en Yunnan en 2012 se identificó la cepa YN que ocasiona lesiones renales y traqueales graves en las aves (Feng et al., 2012) y en la provincia china de Jiangsu en 2013 se identificó una nueva cepa nefro-patógena altamente virulenta llamada CK/CH/XDC-2/2013 en un lote vacunado y que presentaba signos clínicos de BIA (Leghari et al., 2016).
En Latinoamérica se comenzaron a aislar cepas de tipo Mass en Brasil (Hipólito, 1957), Chile (Hidalgo et al., 1976), Colombia (Alvarado et al., 2005) yArgentina (Rimondi et al., 2009). Los genotipos encontrados en 1964 fueron denominados Sur América I (SAI) (Marandino et al., 2015) y posteriormente se reportó la cepa Asia/SAII con alta probabilidad de provenir de cepas de China, Taiwán, Uruguay y Argentina (Marandino et al., 2015). En Colombia se reportó la circulación de genotipos nuevos donde hay existencia de riesgo de recombinación genética del virus (Cifuentes-Rincón et al., 2016). Por otro lado, los datos epidemiológicos y científicos en el continente africano son escasos y poco actualizados (Kouakou et al., 2015; Khataby et al., 2016).
Evolución Filogenética
La aparición de nuevas variantes del virus de BIA es atribuida a las mutaciones específicas y la recombinación, junto a la falta de material genético o inserciones que ocurren en el genoma (Liu et al., 2014). Pese a que el serotipo Mass se convirtió en el modelo para el diseño de vacunas a nivel mundial contra la BIA, la facilidad para recombinar y mutar en cada réplica ha generado una dinámica en cambios filogenéticos significativos que terminan en serotipos diferentes a los vacunales (Figura 1) y, por consiguiente, un desafío constante para la respuesta inmunológica.
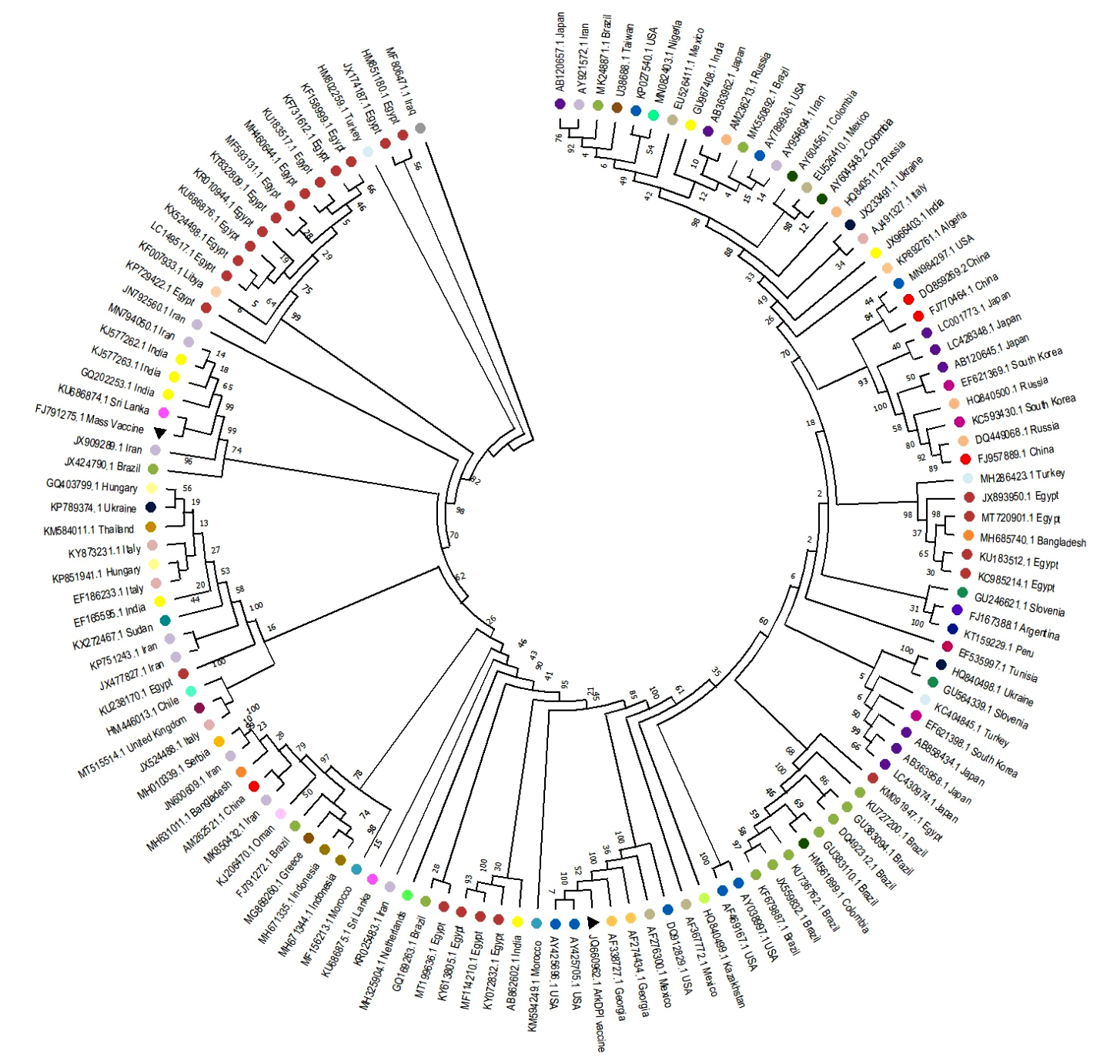
Figura 1. Árbol filogenético de secuencias de nucleótidos S1 (300-700 pb) del virus de Bronquitis Infecciosa Aviar (BIA) a partir de 129 secuencias de varios países obtenidas en el GenBank. La filogenia ilustra las relaciones evolutivas entre todos los genotipos y linajes de BIA aquí propuestos. Cada país está codificado por colores y se notifica su número de acceso al Genbank. Los serotipos vacunales están marcados con triángulos negros correspondientes a las cepas vacunales Mass y ArkDPI. Las relaciones entre los citotipos fueron planteadas usando el método de Máxima Parsimonia, conducido por el programa MEGA X (Kumar et al., 2018) e infiriendo 500 réplicas de Bootstrap. El árbol más parsimonioso se obtuvo utilizando el algoritmo SubtreePruning-Regrafting (SPR). La figura es de creación propia y no asume una hipótesis evolutiva, siendo netamente ilustrativa para la gran variedad de serotipos existentes de BIA en todo el mundo
Mediante las comparaciones de secuencias de nucleótidos y aminoácidos se determinó que aislamientos recientes tienen un 98.97% de similitud genética con cepas del genotipo QX que genera manifestaciones clínicas renales de mayor impacto en la salud aviar (Abro et al., 2012). La replicación del virus de estructura de ARN puede estar relacionada en parte con el hecho de que la unión del VBIA a las células huésped depende del ácido N-acetilneuramínico o ácido siálico presente en la superficie celular de las aves, el cual es una molécula que se localiza en las partes lubricantes como la saliva o en la capa de mucina que recubre las distintas mucosas en el organismo (Cavanagh, 2007). Existe evidencia de que el ácido siálico intercede en el proceso de unión de la glucoproteína S del virus y las células del huésped (Krempl et al., 1997).
Una aparición de nuevas variantes de VBIA es una consecuencia respecto a patotipos, serotipos y protectotipos ya que su evolución en los procesos filogenéticos ha generado cambios en la patogenicidad (Liu et al., 2014). El análisis genético y la secuencia de nucleótidos siguientes de las series de genes de las proteínas S1 y N han ofrecido un método rápido y preciso para clasificar y predecir el genotipo del virus de BIA, y un poderoso instrumento para monitorear la evolución filogenética y epidemiológica de sus variantes (Montassier, 2010).
La cepa 793/B del VBIA es un genotipo importante que circula actualmente en varios países (Zhang et al., 2015). Otro serotipo que tiene una alta distribución afectando los tejidos del sistema respiratorio digestivo y renal es el IRFIBV32 (Boroomand et al., 2012; Kalokhoran et al., 2017).
En el 2017, se reportó el estudio de patogenicidad de la cepa iraní denominada variante IR-1, con epiteliotropismo marcado en el tracto respiratorio, pero también con consecuencias en el sistema digestivo y renal (Najafi et al., 2016)-Paralelamente, en la misma región fueron aisladas las cepas circulantes de distribución mundial IS-1494-like, 793/B, QX and Massachusetts IBV (Modiri Hamadan et al., 2017) con porcentajes de similitud entre 10 y 100% y con una mayor identidad en los clústeres de las cepas 4/91 y IB88 (Kalokhoran et al., 2017). En Egipto fueron reportadas dos cepas de campo circulantes del virus de BIA con alta similitud con la cepa egipcia II (Naguib et al., 2017).
Mahmood et al. (2011) infirieron que el péptido basado en múltiples epítopos de la secuencia de aminoácidos de las cepas aisladas en Israel (IS/720/99, IS/885) y Egipto (Egipto/Benisuef/01) pueden tener relación y pertenecer a un nuevo genotipo. También se ha evidenciado que la mayor virulencia en pollos libres de patógenos se debe a la acumulación y recombinación de mutaciones en el genoma CK/CH/LJL/111054 (Liu et al., 2014).
En Brasil se describieron tres subcepas en un genotipo de BIA genéticamente distante de la cepa Mass. Inesperadamente dos cepas se tipificaron como 4/91, también conocidas como 793B y CR88, lo que demuestra la gran diversidad del virus de BIA en el país (Brandão, 2010).
Respuesta Inmunológica al Virus de BIA
El mayor riesgo sanitario de los sistemas de producción avícola se ha identificado por el contacto directo y/o indirecto con aves silvestres (Wang et al., 2013) y aves de traspatio, acompañado de medidas de bioseguridad deficientes (Jiang et al., 2014). El virus de la BIA es clasificado como uno de los agentes infecciosos secundarios basados en estudios epidemiológicos que indican que la inmunodeficiencia viral desempeña un papel significativo en el desarrollo de la infección (Toro et al., 2006). Esta falla puede estar asociada con otros virus como el Virus de la bursa y el de Anemia infecciosa aviar por limitación en la respuesta inmune innata de la glándula harderiana y las tonsilas cecales (van Ginkel et al., 2008). Adicionalmente, la inmunodeficiencia generada por la infección por VBIA a menudo ocurre debido a la aparición de nuevos serotipos o cepas de campo antigénicamente diferentes de las cepas vacunales (Xia et al., 2018). Ante esto, la producción de vacunas con cepas muertas o vivas atenuadas se enfoca en la inclusión de nuevas variantes de BIA, pero este proceso puede tardar meses o años, a pesar de la urgencia de la industria avícola para controlar las cepas de campo (Jackwood, 2012)
Como consecuencia al uso masivo de cepas vacunales, la evolución a una nueva variedad de cepas virales se origina a través de una mutación espontánea aleatoria y la recombinación genética que podría conducir a una desviación en los clústeres genéticos (Rafique et al., 2018). Por esa razón es necesario invertir en vigilancia epidemiológica para evaluar el impacto de las cepas de vacuna utilizadas en cada región, así como explorar el desarrollo de vacunas con enfoques novedosos y eficaces (Fraga et al., 2018). En este sentido, el análisis de la red filogenética cumple una función fundamental para la identificación del origen, perfil genético del virus de campo y producción de nuevas cepas vacunales (Jackwood y Lee, 2017). No obstante, la vacunación mixta de la cepa H120 y 793/B comparada con la vacuna única H120 no presentó diferencia en la reducción de la carga viral y daños patológicos (Karimi et al., 2019), reafirmando la hipótesis de la falta de protección cruzada entre las cepas vacunales y las variantes de nuevos genotipos (Cifuentes-Rincón et al., 2016).
En la avicultura comercial es común encontrar infecciones concomitantes con otros virus como el de la enfermedad de Newcastle e influencia aviar (Hanaa et al., 2017) así como con bacterias (Valastro et al., 2016). La vacunación con cepas vivas del virus de BIA 4/91 en Egipto evidenció de manera cuestionable el incremento de la patogenicidad del Ornithobacterium rhinotracheale (Ellakany et al., 2019).
Estudios sobre la patogenicidad del VBIA cepa emergente QX-like, demostró la alta morbilidad acompañada de ciliostasis traqueal severa y baja letalidad, con genotipificación de cinco variantes denominadas GDJ, GDS, LN1, LN2, y TJ (Yan et al., 2019), mientras que la patogenicidad de la cepa LX4-type se enfocó en el tropismo renal ocasionando nefropatías con las variantes denominadas CK/CH/LHLJ/04V, atribuido a la región 3\beta-7kb del virus (Liu et al., 2009). Esto evidencia la evolución constante del virus y la inminente necesidad de estudiar la epidemiologia y patogenicidad, de manera de ayudar a controlar su diseminación mediante la vacunación con cepas locales atenuadas (Quinteros et al., 2016) e incluso buscar el desarrollo de estrategias antivirales efectivas (Zhou et al., 2017).
En atención a metodologías de inducción de respuesta inmunológica vacunal, se han estudiado alternativas sobre el uso de péptidos inmunogénicos vacunales contra diferentes cepas de VBIA, expresados en bacterias tales como Lactococcus lactis NZ3900 y Escherichia coli, que actúan como vehículos vacunales que incrementan la respuesta celular y humoral en vacunas de uso oral contra la infección experimental con la cepa SAIBk del virus de BIA, ofreciendo protección ante desafíos virales a dosis letal (Cao et al., 2013). Otra opción validada es la producción de cepas vacunales con recombinación dirigida del ARN basadas en VBIA virulento, brindando oportunidades de vacunas atenuadas vivas y diseñadas racionalmente (van Beurden et al., 2018). De una manera semejante, se ha evidenciado el incremento de la respuesta inmune celular y humoral mejorando la secreción de IgA en lágrimas y secreciones intestinales cuando se vacuna con cepas vivas y atenuadas en coadministración con el resiquimod (R848) (Matoo et al., 2018).
Una estrategia que ha ganado atención es inducir respuestas antivirales innatas efectivas, ya que proporcionan la primera línea de defensa contra virus invasores en el organismo (Barjesteh et al., 2020). Dentro de las estrategias antivirales han sido estudiados los polisacáridos de astrágalo (PSA), incluyendo el caso de VBIA, pudiendo representar un agente terapéutico potencial para inhibir la replicación viral o incluso como coadyuvante de la vacunación, incrementando la respuesta inmune tanto innata como específica (Zhang et al., 2018). De igual manera, a la hipericina (HY) se le han identificado efectos antivirales contra la infección por VBIA promoviendo la inhibición de la apoptosis de célula renales desafiadas, reduce la expresión de RNAm de citocinas tipo Fas, FasL, JNK, Bax, Caspase 3, and Caspase 8, y aumenta de manera significativa la expresión de Bcl-2 mRNA y la generación de especies reactivas de oxígeno en células de riñón de embrión de pollo (Chen et al., 2019).
A nivel experimental se ha identificado interacción negativa en la coinfección entre VBIA y el virus de influenza aviar de baja patogenicidad (LPAI) H9N2, demostrándose que dependiendo de las condiciones se disminuye el crecimiento del primer virus inoculado (Aouini et al., 2018). Estos resultados reafirman la hipótesis de la influencia que existe entre los diferentes virus que se incluyen en los programas de vacunación para afectar de forma negativa la respuesta inmune (Lupini et al., 2020).
Las medidas de prevención contra el VBIA en todo el mundo dependen principalmente de la aplicación de cepas de vacunas vivas modificadas. No obstante, los estudios demuestran que la recombinación entre cepas de campo y cepas vacunales dan lugar a nuevas cepas patógenas (Mo et al., 2020; Ren et al., 2020). De ahí la importancia de los estudios epidemiológicos moleculares, el monitoreo y el control de los brotes, articulado con el desarrollo de nuevas vacunas basadas en los serotipos que circulan en el campo, para evitar la propagación de la enfermedad y sus consecuencias económicas. Estas últimas van a depender de diversos factores como edad de las aves al momento de la infección, la cepa del virus, nutrición, bioseguridad, así como del ambiente externo e interno de las aves (Colvero et al., 2015).












 uBio
uBio 

