INTRODUCCIÓN
En los últimos años se han logrado progresos considerables en la maduración (MIV), fertilización (FIV) y cultivo in vitro (CIV), y aunque los sistemas de producción in vitro de embriones (PIVE) son aptos para la generación de embriones bovinos sigue sin resolverse el problema de la baja cantidad y calidad de desarrollo y supervivencia de los embriones (Camargo et al., 2006). Se ha demostrado un retraso o freno en el desarrollo de embriones cultivados in vitro cuando se compara con los embriones desarrollados in vivo (Rizos et al., 2002), siendo la concentración de oxígeno uno de los factores ambientales que puede contribuir a esta diferencia, debido a la producción de especies reactivas de oxígeno (EROs), lo cual genera un estrés oxidativo al embrión (Favetta et al., 2007; Takahashi, 2012). Además, la activación metabólica del embrión requiere moléculas energéticas tales como glucosa, piruvato y lactato (Khurana y Niemann, 2000), lo cual a su vez contribuye a la generación de EROs (Dalvit et al., 2005).
Con la finalidad de mejorar las tasas de producción y la calidad de los embriones se han estudiado estrategias en diferentes campos de investigación, como es el diseño de plataformas de cultivo de embriones (Swain y Smith, 2011; Smith et al., 2012), el control de la producción de EROs con el uso de antioxidantes como el ácido ascórbico (Córdova et al., 2010) y el α-tocoferol (Olson y Seidel, 2000), o mediante cambios en los componentes del medio de incubación, entre ellos los suplementos energéticos como piruvato, lactato, acetoacetato, hidroxibutirato (Gómez et al., 2002), glucosa y fructosa (Barceló-Fimbres y Seidel, 2007), fuentes de proteína como suero o albúmina (Mucci et al., 2006; Lim et al., 2007), hormonas como la hormona del crecimiento (Moreira et al., 2002) e insulina (Augustin et al., 2003) y factores de crecimiento (Mtango et al., 2003).
El suplemento de insulina, transferrina y selenito de sodio (ITS) ha resultado exitoso en el desarrollo de diversos tipos de células (Van der Valk et al., 2010), incluyendo sistemas de PIVE en porcinos (Jeong et al., 2008; Quan et al., 2008) y en bovinos (Córdova et al., 2010). Esta combinación se considera de gran utilidad en el sistema de PIVE, ya que la insulina suple la deficiencia de factores moduladores del metabolismo energético del embrión. Algunos estudios han demostrado que la suplementación del medio con insulina o con factor de crecimiento insulinoide tipo I (IGF-I) aumenta la captación de glucosa (Riley y Moley, 2006), la síntesis de RNA y proteínas (Santos et al., 2008) y genera una respuesta mitogénica y anti-apoptótica que mejora la tasa de desarrollo embrionario (Augustin et al., 2003).
La transferrina media la disponibilidad de hierro al interior de la célula para la síntesis de citocromos, enzimas y proteínas como la mioglobina y la hemoglobina, y gracias a su capacidad quelante disminuye la toxicidad de los iones Fe+3, pero los mantiene disponibles para la célula. Además, cumple funciones antioxidantes al restringir el hierro catalítico para las reacciones generadoras de radicales libres (Kell, 2009). El último componente del suplemento, el selenito de sodio (Na2SeO3) es un compuesto que hace parte de varias moléculas biológicas con funciones antioxidantes, como las proteínas tiorredoxinas y glutatión peroxidasas (GPxs), las cuales tienen actividad reductora sobre peróxidos (Battin y Brumaghim, 2009). Ante esto, El objetivo del artículo fue evaluar el efecto del suplemento Insulina-Transferrina-Selenio (ITS) sobre el porcentaje de blastocistos y la calidad embrionaria determinado por el número de células totales y producción de EROs.
MATERIALES Y MÉTODOS
Consideraciones Éticas
El protocolo del estudio fue aprobado por el Comité de Ética de la Universidad Nacional de Colombia, sede Medellín, mediante Oficio CEMED 019 del 14 de mayo de 2012.
Sitio de Estudio
Los complejos oocito cúmulo (COCs) se obtuvieron de ovarios de bovinos sacrificadas en la planta de beneficio de Envigado ENVIcárnicos (Envigado, Antioquia), mientras que las técnicas relacionadas con la producción y evaluación de embriones se llevaron a cabo en el Laboratorio de Genética de la Universidad Nacional de Colombia (UNAL), sede Medellín.
Recuperación de Oocitos y Maduración in vitro (MIV)
Los ovarios colectados se depositaron en solución tampón fosfato salino (PBS) estéril a 35 ºC y trasladados durante unos 30 min al laboratorio para su procesamiento. Allí se procedió al lavado de los ovarios por tres veces consecutivas con PBS a 35 ºC. Luego, utilizando una aguja N.° 18 en jeringa de 5 mL se aspiraron los folículos que presentaban un diámetro de 3 a 6 mm. El líquido folicular se depositó en tubos cónicos de 15 mL en un baño seco a 37 ºC, donde el líquido folicular fue decantado por gravedad por 15 min. Se descartó el sobrenadante y el precipitado se resuspendió en 1 mL de medio de lavado (TCM-199 con sales de Hank suplementado con 275 µg/mL de ácido pirúvico, 29.2 µg/mL de glutamina, 1X de la solución de antibióticos) (SigmaA5955) (Tsafriri et al., 1996), depositándose en una caja de Petri estéril de 60 x 15 mm.
Se seleccionaron los complejos oocitocúmulo (COCs) de buena calidad, utilizando un estereomicroscopio, siguiendo los criterios de De Wit et al. (2000); es decir, aquellos con citoplasmas claros y homogéneos y al menos con tres capas compactas de células de la granulosa. Se procedió al lavado por tres veces de los COCs seleccionados en medio TCM-199 suplementado con sales de Hank. Grupos de 12 COCs fueron cultivados a 38.5 °C en gotas de 50 µl de medio de maduración suplementado de acuerdo con el grupo de estudio, cubiertas con aceite mineral en plato de cultivo de 4 pozos.
El medio de maduración (TCM-199) fue suplementado con 275 µg/mL de ácido pirúvico, 29.2 µg/mL de glutamina, 1X de la solución de antibióticos, 1 µg/mL de estradiol, 6 mg/mL de albúmina sérica bovina libre de ácidos grasos (Bovine Serum Albumin - Fatty Acid Free, BSA-FAF) 3% de suero bovino fetal (SBF) y gonadotropinas (1 µg/mL de FSH porcina [Calder et al., 2003] y 10 UI/mL de LH recombinante humana [Anderiesz et al., 2000]). El cultivo se realizó a 38.5 °C, 5% de CO2 y 90% de humedad relativa.
Fertilización in vitro (FIV) y cultivo de embriones (CIV)
Cumplidas las 24 horas de maduración in vitro, las unidades de cada grupo fueron retiradas del medio de cultivo y pasadas sucesivamente por tres gotas de 50 µl de medio TALP-Hepes. Luego, las unidades fueron transferidas a gotas de 50 µl de medio de fertilización (TALP suplementado con 10 µg/mL de heparina, 1mM de hipotaurina, 250 mM de Epinefrina, 2 mM de penicilamina, 1X de la solución de antibióticos) (Dode et al., 2002).
Se utilizó semen proveniente de un toro de la planta de procesamiento San Pablo de la UNAL, descongelado a 37 ºC por 30 s. Se seleccionaron los espermatozoides viables y móviles mediante gradiente de AllGradient® (45 y 90%) a 400 g por 7 min. El sobrenadante fue descartado y el botón celular de esperma-tozoides se lavó con 1 mL de medio de fertilización sin heparina y fue centrifugado a 200 g por 4 min. La concentración de espermatozoides fue ajustada a 2 x 106/mL de espermatozoides en el medio de fertilización (Dode et al., 2002). Las gotas de fertilización fueron cubiertas totalmente con aceite mineral y se incubaron durante 18 h a 38.5 °C, 5% de CO2 y 90% de humedad relativa. Al término de la incubación los presuntos cigotos fueron transferidos a medio de desarrollo.
Los presuntos cigotos luego de 18 h de la inseminación (hpi) fueron desnudados de las células del cúmulo y cultivados durante 48 h en gotas de 50 µl de medio de cultivo Evolve suplementado con 6 mg/mL de albúmina de suero bovino libre de ácidos grasos (BSA-FAF), 1X de la solución de antibióticos y 3% de suero fetal bovino. Las primeras 48 horas de cultivo se definieron como cultivo 1 (CIV1). Luego de este tiempo se realizó un recambio del 60% del medio de cultivo y se mantuvo así por 144 h adicionales (día 8 de cultivo), definido como cultivo 2 (CIV2). Las condiciones de cultivo fueron 38.5 °C, 5% de CO2 y 90% de humedad relativa.
En este trabajo se evaluó el complejo ITS en una combinación de 5 µg/mL de insulina, 2.74 µg/mL de transferrina y 3.34 ng/mL de selenio (Gibco 41400, Life Technologies Corporation, USA), suplemento usado en los medios de desarrollo 1 (CIV1) y 2 (CIV2) in vitro, los cuales se denominaron CIV1-ITS y CIV2-ITS, respectivamente.
Efecto del Suplemento ITS sobre el Desarrollo Embrionario
La determinación de la tasa de clivaje sobre el total de oocitos inseminados se realizó mediante visualización en estereoscopio a las 48 h de iniciar el cultivo de los presuntos cigotos, contando el número de embriones con dos o más células. El porcentaje de blastocistos se determinó a los 8 días de cultivo (210 hpi) identificando los embriones en estadio de blastocistos por visualización en microscopio invertido de contraste de fase (Carl Zeiss Microscopy, España). Esta evaluación morfológica se realizó desde el día 6 hasta el día 8 de cultivo para corroborar el avance de embriones en diferentes estadios, con base al número de oocitos fertilizados. Por último, para determinar la competencia para el desarrollo, se tuvo en cuenta el número de blastocistos sobre el total de embriones clivados.
Número de Células Totales
Para determinar el número de células por embrión se realizó tinción de los núcleos de los blastocistos expandidos obtenidos de los tratamientos entre la 162 hpi (día 6 de cultivo) y las 210 hpi (día 8 de cultivo), incubando cada embrión en solución Hoechst 33324 (Sigma® B2261) a una concentración de 10 µg/mL durante 5 min en la oscuridad a 38 °C, lavado posteriormente en PBS y transferidos individualmente a un portaobjetos. El conteo celular se realizó sobre una fotografía digital obtenida en microscopio de epifluorescencia (Nikon eclipse 80i) con filtros UV2E con una longitud de emisión a 352 nm y de excitación a 455 nm (Uhm et al., 2009).
Producción de EROs
La producción intracelular de especies reactivas de oxígeno (EROs) en los embriones se determinó por la oxidación de la sonda fluorescente diacetato 2’,7’-dichloro-dihydrofluoresceina (H2DCFDA). Cada embrión individual fue incubado por 30 min con 10 µM del fluorocromo en la oscuridad. Luego fueron lavados buffer fosfato salino Dulbecco (DPBS) (Invitrogen Corporation). La fluorescencia se observó en gotas de 10 µl con un microscopio de epifluorescencia (Nikon eclipse 80i) con filtros UV de 460 nm. Las imágenes fluorescentes se guardaron como archivos TIFF. La intensidad de fluorescencia de los embriones fue evaluada con el software ImageJ (v. 1.41; National Institutes of Health, Bethesda, USA) y normalizada con la media de fluorescencia de los embriones control o tratamiento 1 (You et al., 2010; Kwak et al., 2012).
Análisis Estadístico
Para las variables porcentaje de clivaje, blastocistos y competencia para el desarrollo se realizaron seis réplicas por tratamiento, mientras que para la determinación de la celularidad se utilizaron como unidades experimentales cada uno de los blastocistos expandidos de cada tratamiento y sometidos a tinción. Para la determinación de la producción de EROs se utilizó cada blastocisto expandido de cada tratamiento para su tinción con H2DCFDA. Los datos se normalizaron como una proporción del promedio de intensidad de fluorescencia del tratamiento control, siendo por lo tanto igual a 1 para el promedio del mismo control. Los datos de cada variable fueron sometidos al test de Brown-Forsythe para homogeneidad de varianzas y se evaluaron mediante análisis de varianza de una vía. Las medias de los tratamientos en cada variable fueron comparadas a través de la prueba de Tukey. Se utilizó el programa STATISTICA 10.0 (StatSoft, USA) en todas las pruebas estadísticas.
RESULTADOS
Efecto del suplemento ITS sobre la producción in vitro de embriones bovinos
Se evaluaron tres parámetros: el porcentaje de embriones en etapa de clivaje sobre el número de oocitos inseminados determinado a las 48 h de cultivo, el porcentaje de blastocistos sobre el número de oocitos inseminados, y la capacidad o competencia de los embriones clivados para alcanzar la etapa de blastocisto. Se tuvieron 6 repeticiones por tratamiento, 617 oocitos y 186 blastocistos (Cuadro 1).
Cuadro 1. Porcentaje de embriones bovinos cultivados con el suplemento Insulina-Transferrina-Selenio (ITS) en el clivaje (48 horas p.i) y en blastocistos (día 8)
| Tratamiento | Suplemento ITS CIV1/CIV2* | n | Clivaje n (%) | Blastocistos / oocitos (%) | Blastocistos / clivados (%) |
|---|---|---|---|---|---|
| 1 | -/- | 145 | 121 (83.5±2.3)a | 38 (26.2±6.5)a | 31.4a |
| 2 | +/- | 159 | 137 (86.1±5.4)a | 50 (31.5±3.9)ab | 36.5ab |
| 3 | -/+ | 135 | 113 (83.7±12.2)a | 40 (29.6±2.7)ab | 35.4ab |
| 4 | +/+ | 178 | 136 (76.4±7.9)a | 58 (32.6±4.7)b | 42.7b |
a,b Letras diferentes en la misma columna indican diferencia significativa entre tratamientos (p<0.05)
Cada experimento fue repetido 6 veces. Los datos representan promedio ± DE
1 CIV1: Primeras 48 horas de cultivo in vitro; CIV2: Después de las 48 horas de iniciar el cultivo in vitro
No se encontró diferencia estadística en el porcentaje de clivaje entre los grupos de estudio (p>0.05) (Cuadro 1). Por otro lado, en la producción de blastocistos se observó que el tratamiento 4 (suplementado con ITS en CIV1 y CIV2) presentó el valor más alto (32.6%) comparado con el control (T1, sin suplemento ITS) (26.2%); sin embargo, no hubo diferencias significativas (p>0.05) en los porcentajes de blastocistos de T2 (31.5%) y T3 (29.6%) (Cuadro 1). La competencia para el desarrollo (porcentaje de embriones clivados que se desarrollaron hasta blastocisto) mostró un comportamiento muy similar; obteniendo el mayor porcentaje en T4 (42.7%), significativamente superior (p<0.05) al control (31.4%), sin diferir en T2 y T3 (36.5 y 35.4%, respectivamente).
Cantidad de células totales de embriones cultivados con o sin ITS
Los embriones en etapa de blastocisto expandido fueron teñidos para evaluar el efecto del suplemento ITS sobre la celularidad. Se revisaron los registros fotográficos 18-28 embriones en estadio de blastocisto expandido por tratamiento (Cuadro 2), haciendo un total de 88 embriones. T4 presentó la mayor celularidad (145.6) en relación con los demás tratamientos (p<0.05), mientras que la celularidad de los otros grupos experimentales fue estadísticamente similar (Cuadro 2).
Cuadro 2. Número de células totales de blastocistos expandidos de bovino cultivados in vitro con el suplemento Insulina-Transferrina-Selenio (ITS)

a,b Letras diferentes en la misma columna indican diferencia significativa entre tratamientos (p<0.05) Los datos representan promedio ± DE
1 CIV1: Primeras 48 horas de cultivo in vitro; CIV2: Después de las 48 horas de iniciar el cultivo in vitro
Producción de especies reactivas de oxígeno (EROs) en embriones cultivados con o sin ITS
Se evaluaron 10 embriones en estadio de blastocisto expandido por tratamiento (total: 40 embriones) incubados con sonda fluorescente de H2DCFDA. Solo T4 (con suplemento ITS en CIV1 y CIV2) presentó una disminución significativa (p<0.05) en la producción de EROs (0.78) cuando se compara con el control (sin ITS), mientras que los demás tratamientos no presentaron diferencias (p>0.05) con el grupo control 1 (Figura 1).
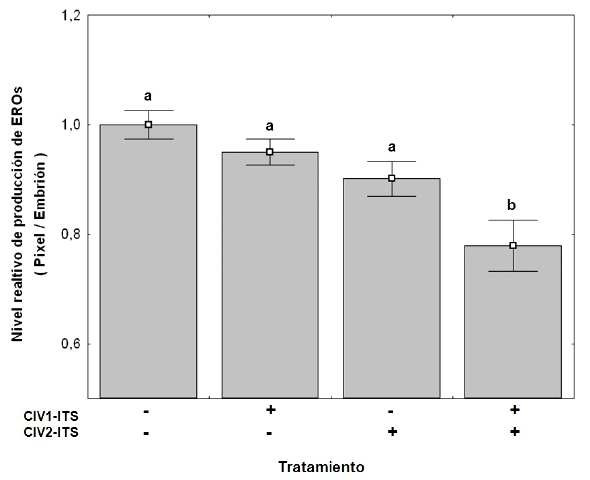
Figura 1. Efecto del suplemento Insulina-Transferrina-Selenio (ITS) sobre los niveles de especies reactivas de oxígeno (EROs) intracelulares en embriones de bovino producidos in vitro. Embriones cultivados con (+) o sin (-) ITS. CIV1 (primeras 48 horas de cultivo) y CIV2 (48 horas después de iniciar el cultivo). Los datos representan promedio ± EE. Columnas con letras diferentes (a, b) indican presentan diferencia significativa (p<0.05)
DISCUSIÓN
Las técnicas de reproducción asistida tienen una baja tasa de producción de blastocistos (Rizos et al., 2002), debido a factores que pueden disminuir la eficiencia y calidad de embriones producidos in vitro, entre ellos el estrés oxidativo generado por la concentración de oxígeno, la exposición a la luz y el medio de cultivo (Du Plessis et al., 2008). Si bien la calidad intrínseca del oocito es fundamental su desarrollo a mórula o blastocisto en los procesos PIVE, el ambiente del cultivo in vitro durante el desarrollo embrionario influye significativamente sobre la calidad del blastocisto (Sirard, 2001).
En este trabajo se evalúo el suplemento ITS sobre varios parámetros de calidad embrionaria, encontrando un porcentaje de clivaje entre 76.4 y 86.1% durante dos momentos del proceso (cultivo 1 o cultivo 2) (Cuadro 1), siendo resultados similares al 69.6 y 77.7 descritos por Makaverich y Markkula (2002) y al 81 y 85% reportado por Augustin et al. (2003), respectivamente. Sin embargo, en este estudio no se encontró efecto del suplemento ITS sobre la tasa de embriones en etapa de clivaje (Cuadro 1), tal como lo señala Makaverich y Markkula (2002) al suplementar con factor de crecimiento insulinoide tipo I, aunque Augustin et al. (2003) han reportado un efecto positivo sobre la tasa de clivaje al suplementar con insulina.
La mejor respuesta porcentual de blastocistos con el suplemento ITS en T4 ha sido reportada tanto en embriones bovinos producidos in vitro (Solovera et al., 2003), en embriones murinos (Ta-Chin et al., 2003) y partenogenéticos porcinos (Quan et al., 2007). Esta respuesta puede explicarse por las propiedades mitogénicas que presenta la insulina (Ta-Chin et al., 2003) y la activación del metabolismo de la glucosa y lípidos (Tsujii et al., 2002). Adicionalmente, la insulina favorecería el metabolismo de la glucosa que compromete el desarrollo de los embriones de sexo hembra en bovinos, debido a que se ha demostrado que la no compensación de dosis para la expresión de la glucosa 6 fosfato deshidrogenasa (G6PD) ligada al cromosoma X en embriones producidos in vitro genera un desbalance en el metabolismo de la glucosa en embriones hembra (Wrenzycki et al., 2002).
La celularidad es considerada como uno de los indicadores más importantes de calidad embrionaria (Ushijima et al., 2009). En este estudio se encontró el mayor número de células (p<0.05) por embrión en T4 (145.6) en comparación con los demás grupos experimentales (Cuadro 2). Este efecto benéfico del suplemento sobre la celularidad también ha sido reportado en otros trabajos con insulina (Augustin et al., 2003) e IGF-I (Ta-Chin et al., 2003).
La producción de especies reactivas de oxígeno (EROs) está asociada al estrés oxidativo (Martín-Romero et al., 2008), al envejecimiento del oocito (Goud et al., 2008; Gupta et al., 2010). En el presente estudio se encontró que las estructuras en T4 presentaron los niveles más bajos (p<0.05) de fluorescencia, lo cual refleja una baja producción de EROs (Figura 1), tal y como fue informado por Jinyoung et al. (2010) al suplementar el medio de cultivo con moléculas antioxidantes antocianinas.
Los resultados obtenidos con el suplemento ITS en el desarrollo embrionario son efectos sumatorios de los componentes (insulina - transferrina - selenio).Así, el componente insulina mejora los parámetros de celularidad e índice apoptótico (Augustin et al., 2003), e inhibe la acumulación de triacilgliceroles (Tsujii et al., 2002), aumenta el transporte de glucosa al interior de la célula a través del estímulo para la translocación de los transportadores de glucosa inducibles por la insulina GLUT8 (Carayannopoulos et al., 2000) y GLUT12 (Zhou et al., 2004) y aumenta la oxidación de la glucosa (Foufelle y Ferre, 2002). Además, los efectos sumatorios de la transferrina, que debido a su propiedad de unión al hierro (Kell, 2009) disminuye la probabilidad de que el ion participe en la generación de radicales libres a través de la reacción de Fenton, en la cual se forma el radical hidroxilo (Guérin et al., 2001), y por el efecto del selenio, que hace parte de varias moléculas con funciones antioxidantes como las glutation peroxidasas, participando en la disminución del estrés oxidativo del embrión (Du Plessis et al., 2008; Jeong et al., 2008).
Bajo las condiciones experimentales del presente estudio se demostró que el suplemento ITS en una combinación de 5 µg/mL de insulina, 2.74 µg/mL de transferrina y 3.34 ng/mL de selenio administrado durante toda la fase de cultivo aumenta la producción de blastocistos, promueve el desarrollo desde el clivaje hasta el estadío de blastocisto y mejora parámetros de calidad del embrión reflejado en el número de células en blastocistos expandidos y disminución de la producción de especies reactivas de oxígeno. Los resultados sugieren que la suplementación de ITS durante el cultivo (CIV1 y CIV2) favorece la producción y la calidad de embriones bovinos producidos in vitro.












 uBio
uBio 


