INTRODUCCIÓN
La alpaca (Vicugna pacos) es una especie oriunda de los Andes sudamericanos que tiene como ancestro a la vicuña (Kadwell et al., 2001). La mayor parte de la población está distribuida en altitudes entre 3600 a 5400 msnm en América del Sur donde son fuente de carne, fibra y transporte, y sus heces se usan como combustible y fertilizante (Díaz et al., 2016). La mayoría de los productores poseen parcelas menores a 100 ha de pastos naturales en las que crían rebaños de 50 a 100 animales en promedio. Esta actividad económica en el Perú involucra a 2.9 millones de personas que representan el 11% de la población nacional (Brenes, 2001).
La producción se encuentra limitada, fundamentalmente, por bajas tasas de natalidad y elevadas mortalidades neonatales causantes de significativas pérdidas económicas. Las enfermedades infecciosas del tracto intestinal y respiratorio son las principales fatalidades en etapas neonatales (Guerrero y Leguía, 1987; Rosadio y Ameghino, 1994). Los principales agentes infecciosos productores de enteropatías en crías de alpacas incluyen virus, bacterias y, sobre todo, parásitos intracelulares tales como Cryptosporidium spp, Giardia spp y diversas especies de Eimeria (Cebra et al., 2007; Cid et al., 2010; Rojas et al., 2016). Cinco especies de Eimeria infectan a las alpacas, tres de ellas (E. lamae, E. alpacae y E. punoensis) replican exclusivamente en células intestinales maduras y las otras dos (E. macusaniensis y E. ivitaensis) en el epitelio de las criptas. E. lamae y E. macusaniensis son las principales especies responsables de infecciones intestinales a consecuencia de la reproducción y lisis de las células intestinales maduras y epitelio de las criptas, respectivamente (Palacios et al., 2005; Rosadio et al., 2010).
Estudios sobre prevalencia de eimeriosis en camélidos sudamericanos indican que las crías y animales jóvenes son muy susceptibles a todas las especies de Eimeria, excretan elevadas cargas de ooquistes, presentan severas disfunciones fisiológicas intestinales, y algunas de ellas producen severas patologías descritas como enteritis hemorrágicas, similares a las descripciones macro y microscópicas de la enterotoxemia neonatal (Palacios et al., 2005; Rosadio et al., 2010). Las infecciones en animales adultos, dependiendo de las cargas parasitarias y del tipo de especie involucrada, son, generalmente, de tipo subclínico y asintomático, aunque existen reportes de infecciones fatales en alpacas y llamas adultas (Cebra et al., 2007). Se argumenta que la alta prevalencia de eimeriosis en crías es producto de un manejo deficiente en las pariciones, especialmente en casos de sobrepoblación y pobres condiciones higiénicas sanitarias (Rodríguez et al., 2012).
Las infecciones muy tempranas por Eimeria spp podrían ser consecuencia de varios factores, pero que podrían explicarse por excreciones de ooquistes de madres gestantes portadoras o tal vez exposiciones de ooquistes infecciosos presentes en las pasturas y en las letrinas en las «canchas de parición». Consecuentemente, el presente estudio fue realizado para elucidar si las madres gestantes son portadoras asintomáticas y fuentes de infección de especies de Eimeria durante el periodo perinatal. Con este objetivo, se analizaron muestras fecales de hembras gestantes en tres grupos etarios durante siete semanas alrededor del parto para identificar la especie y carga de ooquistes de Eimeria.
MATERIALES Y MÉTODOS
Lugar y Tiempo de Estudio
La presente investigación se ejecutó en el Centro de Investigación y Producción «La Raya» (CIP La Raya) de la Universidad Nacional del Altiplano (UNAP), ubicado en el distrito de Santa Rosa, provincia de Melgar, región Puno, Perú. El CIP La Raya se encuentra situado entre 4200 a 5500 msnm, piso ecológico de puna húmeda. La recolección de muestras de heces se desarrolló entre los meses de diciembre 2018 a marzo 2019 en época de lluvia, con temperatura mínima de 5 °C y máxima de 14 ºC, precipitación pluvial anual de 725 mm y humedad relativa de 61.83% (SENAMI, 2022).
Las muestras recolectadas fueron procesadas en el Laboratorio de Parasitología de la Facultad de Medicina Veterinaria (FMV) de la Universidad Nacional Mayor de San Marcos (UNMSM) en Lima, Perú.
Animales
Se trabajó con 50 alpacas gestantes de raza Huacaya, clínicamente sanas, con edades de 3 a 12 años, criadas bajo un sistema de producción extensiva a base de pastos naturales, con un manejo controlado y calendarizado y cuyos registros de producción (parición, empadre, mortalidad y producción) se encuentran debidamente registrados en el CIP La Raya-UNAP.
Se empleó el programa WinEpi (Universidad de Zaragoza, España) para estimar el tamaño de muestra en base a las fórmulas de estimación de una proporción (para la evaluación de la prevalencia) y estimación de una media (para la carga de opg excretados en las heces) en base a los datos obtenidos de un muestreo piloto en 200 animales de la misma población que identificó 198/200 (99%) positivos. Con la fórmula de estimación de una proporción para una población finita (500 animales) con una proporción referencial de 0.99, precisión de 0.03 y un nivel de confianza del 95% se obtuvo una muestra mínima de 43 animales. Con la fórmula de estimación de una media para una población finita (500 animales), con un nivel de confianza del 95%, una desviación estándar de 184.6 y un error absoluto aceptado de 50, se obtuvo una muestra mínima de 48 animales. En el estudio se muestrearon 50 animales.
Las alpacas fueron distribuidas en tres grupos etarios: Grupo A (n=19) de 3-4 años, Grupo B (n=26) de 5-8 años, y Grupo C (n=5) de 9-12 años. Los animales estuvieron identificados con aretes metálicos, la gestación fue diagnosticada mediante palpación rectal y las fechas de parición fueron estimadas para diciembre o enero. Con la finalidad de estudiar la dinámica de excreción de ooquistes se realizaron muestreos periódicos durante siete semanas a fin de tener muestras correspondientes a las dos semanas antes y cuatro semanas posteriores al parto.
Muestras
Las muestras fecales (5-10 g) fueron colectadas semanalmente y extraídas directamente del recto de los animales y conservadas en refrigeración hasta su análisis en el laboratorio. Se determinó la presencia de ooquistes mediante el método cualitativo de flotación fecal con solución saturada de azúcar siguiendo la metodología descrita por Sheather (Foreyt, 2002). La cantidad de ooquistes por gramo de heces (opg) fue determinada por el método cuantitativo de McMaster. Para la identificación de las especies de Eimeria se utilizaron las medidas descritas por Guerrero (1967), Guerrero et al. (1971) y Leguía y Casas (1999). Para la esporulación, los ooquistes fueron colocados en una copa de sedimentación con agua destilada e incubados a 15 °C (temperatura promedio durante el día en temporada de lluvias en el CIP La Raya) con un termostato automático para acuario Oct-50 50w (Ocean-Aqua, India) y flujo de aire continuo, suministrado con un compresor de aire EHEIM air400 (EHEIM, Alemania). La temperatura fue monitoreada con un termómetro digital para acuario (Control Company, USA).
Análisis de Datos
Los valores de opg de los tiempos de muestreo (preparto, parto, postparto) fueron introducidos en una plantilla de Excel (Microsoft, USA) para calcular la media, desviación estándar (DE), mediana y rango por grupo etario y especie de Eimeria. El análisis estadístico fue realizado con el programa Stata® 17 (Stata, USA). Se empleó la prueba de Kruskal Wallis para determinar diferencia entre la excreción de opg entre semanas de muestreo y grupos etarios, la correlación de Spearman para analizar la relación entre opg y edad, y la regresión de Poisson para estimar la razón de prevalencias.
RESULTADOS
Especies de Eimeria
Se encontró E. punoensis, E. alpacae, E. lamae y E. macusaniensis, pero no se halló E. ivitaensis (Figuras 1 y 2).

Figura 1. Especies de Eimeria. Ooquistes esporulados de Eimeria punoensis (a), E. alpacae (b), E. lamae (c) y E. macusaniensis (d). (100x). Fuente propia

Figura 2. Eimeria macusaniensis por método de flotación con solución de Sheather. Muestra de cría de alpaca contiendo ooquistes de E. macusaniensis y E. alpacae. Nótese la correcta ejecución del método que permite la visualización de los ooquistes (a) Ooquistes esporulados (b y c) de E. punoensis (1), E. alpacae (2), E. lamae (3) y E. macusaniensis (4). (400x). Fuente propia
Cinética de Excreciones de Ooquistes
El 86% (43/50) de las alpacas al parto presentaron ooquistes de E. alpacae y 98% (49/50) de E. punoensis, mientras que solamente el 10% (5/50) y el 6% (3/50) eliminó E. lamae y E. macusaniensis, respectivamente (Figura 3). El porcentaje de madres excretando ooquistes de E. alpacae y E. punoensis se incrementó desde la segunda semana preparto. Muy pocos animales excretaron E. lamae (10%) y ninguna hembra excretó E. macusaniensis en las dos primeras semanas preparto (Figura 3).

Figura 3. Alpacas positivas a de excreción de ooquistes de Eimeria spp durante las semanas del periparto (n=50)
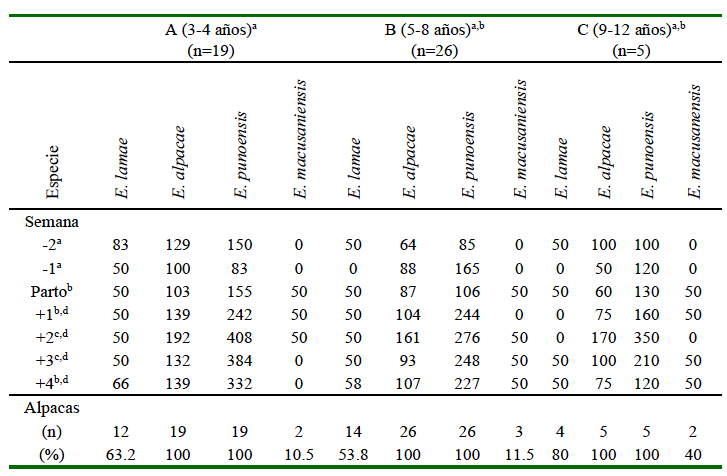
La excreción de ooquistes por gramo (opg) de heces de E. alpacae y E. punoensis se fue incrementando alrededor y después del parto en los tres grupos etarios (Cuadro 1). La carga promedio de E. alpacae fue menor a 50 opg a las dos semanas preparto, alcanzando 115.7 opg en el parto y 162.8 opg desde la segunda a la cuarta semana posparto, en tanto que las cargas de E. punoensis fueron de 70 opg a la segunda semana preparto, 110 opg al parto y 234 opg a la cuarta semana posparto. Por otro lado, los animales no excretaron cargas considerables de E. macusaniensis y E. lamae antes y después del parto. Los animales de los tres grupos etarios no excretaron E. macusaniensis en las dos primeras semanas antes del parto, detectándose cargas menores a 50 opg al parto que se mantuvieron hasta la cuarta semana posparto.
Cuadro 1. Media de ooquistes de Eimeria spp por gramo (opg) de heces en alpacas madres del CIP La Raya, Puno, Perú (diciembre 2018 -marzo 2019) en las semanas del periparto (n = 50)
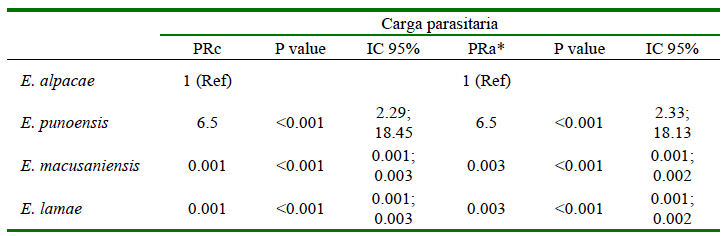
Prueba de Kruskal Wallis y comparación múltiple de medianas como análisis post hoc
a,b,c,d Superíndices diferentes evidencian diferencia significativa (p<0.05)
En cuanto a la excreción de opg por grupo etario, se observó que las alpacas madres más jóvenes (3-4 años) eliminaron mayores cargas de E. alpacae y E. punoensis en comparación con las de 5-8 y 9-12 años (Cuadro 2). Las madres de 3-4 años presentaron una excreción de opg de E. lamae mayor que los dos grupos restantes, mientras que, las excreciones de E. macusaniensis fueron relativamente bajas en los tres grupos etarios (Cuadro 2). Se encontró diferencia significativa entre las categoríasA(3-4 años) y B (5-8 años) (p=0.0123) y, principalmente, entre las dos semanas preparto y todas las de posparto (Cuadro 1), además de una correlación negativa muy baja (Spearman’s rho=-0.0538) entre el número de opg y la edad (p=0.0468).
Cuadro 2. Totales y media de ooquistes de Eimeria spp por gramo (opg) de heces en alpacas madre del CIP La Raya, Puno, Perú (diciembre 2018 -marzo 2019) en las semanas del periparto (n = 50)

Prueba de Kruskal Wallis y comparación múltiple de medianas como análisis post hoc
a,b,c,d Superíndices diferentes evidencian diferencia significativa (p<0.05)
El n del total general representa a todos los animales que salieron positivos para al menos una especie de Eimeria
Se observó diferencia estadística en los valores de opg entre las dos semanas preparto y las del posparto (p<0.05), entre la semana previa al parto con la semana del parto (p=0.0313) y todas las de posparto (p<0.001), así como entre la semana del parto con la segunda (p=0.007) y tercera semana posparto (p=0.0277) (Cuadro 2). La carga de opg de E. alpacae y E. punoensis fue estadísticamente similar en las dos semanas previas al parto, así como entre E. macusaniensis y E. lamae. Sin embargo, a partir del parto hasta la semana 4 posparto se observó diferencia estadística entre E. alpacae y E. punoensis (Cuadro 2).
Prevalencias de Eimerias
Los animales con E. punoensis presentaron 6.5 veces la prevalencia de aquellos parasitados con E. alpacae (p<0.001; IC95% 2.33-18.13), mientras que, los animales con E. macusaniensis y E. lamae presentaron un 0.1% de prevalencia en comparación con E. alpacae (p<0.001; IC95% 0.001-0.003) (Cuadro 3).
DISCUSIÓN
Las elevadas tasas de mortalidad neonatales en las explotaciones alpaqueras andinas son causadas, principalmente, por agentes infecciosos que se presentan en los primeros meses de vida (Ameghino y DeMartini, 1991; Rosadio et al., 2012). Informaciones históricas recolectadas en dos empresas asociativas en el sur peruano evidenciaron pérdidas sustanciales asociadas a cuadros de enterotoxemia y neumonías agudas (Ameghino y DeMartini, 1991). Estudios recientes sobre la etiopatogenia de la enterotoxemia demuestran que este proceso patológico no sería exclusivamente producto de infecciones clostridiales, sino, de un síndrome asociativo (coinfección) predominante de Eimeria spp y Clostridium perfringens (Palacios et al., 2006; Rosadio et al., 2012). Esto ha conllevado a realizar estudios sobre presentaciones patológicas y prevalencia de eimeriosis en establecimientos alpaqueros que evidencian altas tasas de infecciones en neonatos durante los primeros meses de vida (Rodríguez et al., 2012), sugiriendo que estas infecciones tempranas son producto de infecciones crónicas y asintomáticas de las madres gestantes que excretan ooquistes durante la época de parición, o bien atribuidas a la persistencia de formas infecciosas (contaminaciones ambientales) en los potreros o «canchas de parición» (Rodríguez et al., 2012).
Las observaciones sobre la dinámica de excreciones de ooquistes en los tres grupos etarios revelan que todos los animales gestantes llegan al parto excretando altas cargas de ooquistes, principalmente, de E. alpacae (2950 opg) y E. punoensis (5500 opg) y cantidades casi nulas (<50 opg) y leves (100 opg) de E. macusaniensis y E. lamae, respectivamente (Figura 3, cuadros 1 y 2), pero sin detectarse la presencia de E. ivitaensis. Se dispone de pocos estudios sobre excreciones de eimerias en animales gestantes; sin embargo, análisis coprológicos en 161 alpacas en el segundo tercio de gestación de tres comunidades campesinas de la sierra central del país mostraron excreciones de Eimeria spp (31.7%) y E. macusaniensis (4.3%) (Rosadio et al., 2012), lo que sugiere que las madres gestantes podrían ser fuentes de infecciones para los neonatos durante el parto y en días posteriores.
Los resultados muestran que las 50 madres incrementan las excreciones de eimerias pequeñas desde la segunda semana preparto (promedios: 44 y 70 opg) hasta la parición (promedios: 116 y 110 opg) de E. alpacae y E. punoensis, respectivamente (Cuadro 2). Estas excreciones aumentaron sobre todo en la segunda y tercera semana después del parto (Figura 3, Cuadro 2), evidenciando que las madres serían fuentes de contaminaciones ambientales y posibles causas de infecciones para la progenie. Estos datos coinciden con la mayoría de los reportes sobre prevalencia de estas dos especies de Eimeria en camélidos domésticos adultos (Leguía y Casas 1999; Camareno et al., 2016) y silvestres (Jarvinen, 1999; Beltrán-Saavedra et al., 2011; Cafrune et al., 2014; Hyuga y Matsumoto, 2016; Enríquez et al., 2019). Las madres estudiadas incrementaron 2-6 X las excreciones de E. alpacae y 1.5 X de E. punoensis al momento de la parición en comparación con las dos semanas previas al parto (Cuadro 1).
Se observó un incremento de ooquistes en heces hasta la cuarta semana posparto, posiblemente debido a un desbalance fisiológico y/o hormonal por el parto (Taylor y Catchpole, 1994; Kehrli et al., 1999), por lo que serían posibles fuentes de contaminación ambiental y/o infección para sus respectivas crías. Interesantemente, las excreciones de las eimerias consideradas más patogénicas (E. lamae y E. macusaniensis) fueron casi nulas o mínimas antes del parto (Figura 3, Cuadro 1). Asimismo, ninguna alpaca excretó E. macusaniensis antes del parto y solo el 6% (3/50) comenzó a eliminar cargas mínimas en el parto, sin que se eleven las cargas en las semanas siguientes. Estos resultados permiten sugerir que las madres serían responsables de infecciones tempranas en neonatos a partir de la segunda semana de edad como lo reportan Leguía y Casas (1999), y los resultados positivos de 28/30 crías analizadas al término del estudio (28 días) con una carga promedio de 446.2 opg de las tres eimerias pequeñas (datos no publicados). Además, los resultados negativos de E. macusaniensis en los neonatos corroboran que la infección por esta especie es, preferentemente, a partir de los 45 días de edad (Rodríguez et al., 2012).
Las madres de menores edades eliminan mayores cargas ooquísticas (Cuadro 1), coincidiendo con las referencias que indican que los animales jóvenes son altamente susceptibles a infecciones subclínicas de eimeriosis (Dubey, 2018). Los animales del estudio no mostraron signos clínicos asociados a infecciones parasitarias, pero mostraron un pobre estado de carnes (datos no registrados). Las 50 alpacas eliminaron un total de 6000 opg de las eimerias estudiadas en las dos semanas previas al parto, aumentando hasta 8500 opg en el parto y alcanzando 15 600, 23 600, 18 750 y 16 150 opg en las primeras cuatro semanas postparto, respectivamente (Cuadro 2), siendo mayormente de E. alpacae y E. punoensis (Cuadro 2). Estas excreciones totales son menores a lo reportado por Camareno et al. (2016) y los incrementos podrían ser explicados por reactivaciones de formas inmaduras producto de un probable deterioro inmunológico ocasionado por el estrés del parto (Roth, 1985; Taylor y Catchpole, 1994; Kehrli et al., 1999; Taylor et al., 2010).
El presente estudio demuestra que, a pesar de que los animales adultos han estado expuestos a infecciones coccidiales durante su vida productiva en condiciones naturales y, supuestamente, haber adquirido cierta inmunidad, las hembras incrementan las excreciones de ooquistes de eimerias pequeñas, incluyendo a E. lamae, como resultado de posibles reactivaciones parasitarias in vivo, especialmente en la segunda y tercera semana posparto, periodo que coincide con la edad de mayor susceptibilidad de las crías (Rosadio et al., 2010). Asimismo, se evidencia eliminaciones dobles y triples de distintas especies (datos no publicados) de Eimeria spp y, a pesar de estas infecciones mixtas, no se observaron alteraciones clínicas, como han sido reportadas por otros autores (Palacios et al., 2004, 2005); Chigerwe et al., 2007; Cebra et al., 2007). No obstante, estas infecciones mixtas corroboran que las madres gestantes son portadores asintomáticas y diseminadoras de Eimerias spp en el periodo perinatal; no obstante, se encontró que las madres no serían fuente importante de infección de una de las especies más patogénicas (E. macusaniensis).
CONCLUSIONES
Las alpacas gestantes llegan al parto infectadas y diseminan, predominantemente, Eimeria punoensis, E. alpacae, y excretan cantidades mínimas de E. lamae y E. macusaniensis.
La mayor frecuencia de excreción de ooquistes de las eimerias pequeñas se registró en la segunda y tercera semana posparto, mientras que la eliminación de E. lamae se observó a partir de la segunda semana posparto.
Las madres gestantes serían fuente de infección de la E. alpacae y E. punoensis para las crías desde el momento del parto y de E. lamae a partir de la segunda semana posparto.
Las mínimas excreciones de E. macusaniensis evidencian, aparentemente, que las madres gestantes no serían posibles fuentes de infección para los neonatos.












 uBio
uBio