INTRODUCCIÓN
Ehrlichia es una bacteria gramnegativa intracelular de la familia Anaplasmataceae, parásito obligado con tropismo por las células hematopoyéticas (Dumler et al., 2001). Tiene distribución mundial y muy frecuente en perros, aunque es de mayor preocupación en climas tropicales y templados (Gonzaga et al., 2018). También se ha informado en otras especies de mamíferos y presenta un riesgo zoonótico mínimo (Little, 2010). La garrapata Rhipicephalus sanguineus es el vector biológico de este patógeno (Dantas-Torres, 2010).
El protozoario Hepatozoon produce la hepatozoonosis, enfermedad distribuida a nivel mundial que afecta diversas especies de animales (Maia et al., 2014; Merino et al., 2014; Meneses et al., 2016). En caninos, Hepatozoon canis se transmite con la ingestión de garrapatas R. sanguineus infectadas con oocistos maduros o esporulados (Baneth et al., 2007; Pasa et al., 2008). Además de las garrapatas, Hepatozoon también se ha encontrado en ácaros, mosquitos, pulgas, piojos y moscas (Smith, 1996; Baneth et al., 2001; Van et al., 2015).
Es común encontrar coinfección entre Ehrlichia canis y Hepatozoon canis, así como con otros hemoparásitos, por lo que el diagnóstico rutinario de ambos parásitos se basa en la microscopía y las características morfológicas observadas en sangre periférica posterior a coloraciones tipo Romanowsky (Baneth et al., 2007; Rey-Valerion et al., 2012). Sin embargo, en el caso del Hepatozoon, el extendido de la capa flogística (concentración leucocitaria) aumenta las probabilidades de observación positiva de gamontes (Martin et al., 2022).
Para el diagnóstico de ehrlichiosis como de hepatozoonosis se han desarrollado pruebas serológicas y moleculares, siendo estas últimas las mejores, con sensibilidad mayor al 85% (Mylonakis et al., 2003; Ramos et al., 2009). Sin embargo, las pruebas moleculares no siempre se encuentran disponibles para pruebas inmediatas por el alto costo de los kits, necesidad de equipos sofisticados, conocimiento teórico práctico y otras limitaciones. Por otro lado, a pesar de que en la actualidad existen pruebas diagnósticas serológicas comerciales, los costos pueden no estar al alcance de los propietarios de canes, por lo que se opta por métodos más prácticos y menos costosos. Tradicionalmente los hemoparásitos se diagnostican mediante signos clínicos, ayudados de la epidemiología de las enfermedades y hallazgos hematológicos en laboratorio. No obstante, existe una gran variabilidad en la aplicación de técnicas en laboratorio o clínica veterinaria, por lo que el presente estudio evalúa la prevalencia de Ehrlichia sp y Hepatozoon sp en perros atendidos en un centro médico veterinario de la ciudad de Trujillo, Perú.
MATERIALES Y MÉTODOS
La anamnesis de los sujetos, recolección y coloración de las muestras sanguíneas se realizó en el Centro Médico Veterinario San Martín de la ciudad de Trujillo, Perú.
El tamaño de la muestra se determinó con una proporción esperada de 45% (Rabanal, 2014), nivel de confianza de 90% y precisión del 5%, resultando en 95 muestras sanguíneas. Únicamente se consideraron canes infestados con garrapatas o con exposición anterior en los tres meses previos, independientemente de la edad, raza y sexo.
Los pacientes caninos provenían de la misma ciudad (ubicada a una altitud de 30 m y temperatura promedio anual de 19.5 °C). Las muestras de sangre (3 mL) fueron colectadas de la vena cefálica con aguja 21G x 1½» en tubos al vacío (Vacutainer®) conteniendo EDTA. La lectura de los frotis se llevó a cabo en el Laboratorio de Parasitología Veterinaria y Enfermedades Parasitarias de la Facultad de Ciencias Veterinarias, Universidad Nacional de Cajamarca, Cajamarca, Perú.
La sangre se centrifugó a 157 g durante 15 min. Con una micropipeta se retiró el plasma y se extrajo una parte de la capa flogística (0.05 mL) que fue extendida en una lámina portaobjetos para su coloración mediante la tinción Wright. Los frotis se observaron en microscopio óptico a 40X y 100X.
Los resultados se sometieron a una estadística básica de prevalencia e intervalo de confianza al 95%.
RESULTADOS Y DISCUSIÓN
Se observaron mórulas de Ehrlichia sp en 30 muestras, correspondiente a 31.6 ± 9.4%, valor inferior a un estudio realizado en esta ciudad donde se halló una prevalencia de 45% en 100 perros, usando la técnica de frotis sanguíneo (Rabanal, 2014). Estas diferencias podrían atribuirse a que en dicha investigación se consideró el hallazgo de Ehrlichia sp en plaquetas, lo cual se tiene que reconsiderar ya que en estas estructuras se ubica la bacteria Anaplasma platys (Valenciano et al., 2014; Franco-Zetina et al., 2019). Por otro lado, debido a una mayor presencia de polimorfonucleares y con ella Ehrlichia canis en sangre periférica, generalmente la toma de sangre se realiza de la región auricular (Franco-Zetina et al., 2019), tal como se realizó en dicho estudio, en contraste al presente estudio que se extrajo sangre de la vena cefálica.
En una región limítrofe con similares condiciones ambientales (Huánuco) al del presente estudio, se halló una prevalencia de 42.7% a E. canis en perros de casa y 63.9% en perros callejeros, donde se reportó la condición de calle como un factor de riesgo de infestación por garrapatas y de padecer E. canis (Huerto-Medina et al., 2015).
Las mórulas de Ehrlichia sp se identificaron en células polimorfonucleares y mononucleares de la línea blanca (Figura 1). Ehrlichia canis tiene afinidad por los leucocitos mononucleares (Mylonakis et al., 2003; Lukács et al., 2020), mientras que la observación de mórulas en neutrófilos comúnmente está asociados a perros infectados por Ehrlichia ewingii o Anaplasma phagocytophilum (Aguiar et al., 2019; Lukács et al., 2020).
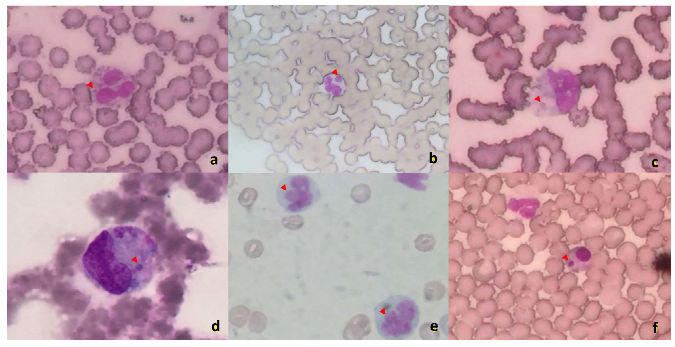
Figura 1. Presencia intracitoplasmática de múltiples mórulas de Ehrlichia sp en neutrófilo segmentado (a, b; 40X), monocito reactivo (c, 100X), en monocito (d, e; 40X) y en linfocito (f; 40X). Tinción Wright
Otros reportes en el país de Ehrlichia canis en perros presentaron prevalencias mayores a las del presente estudio. Así, Huerto-Medina et al. (2015) en Huánuco halló 51.3 ± 8.3% (77/150), mientras que Cusicanqui y Zúñiga (2020) reportaron una prevalencia de 59.4% (723/1716) en los distritos de Lima Metropolitana. Sin embargo, en estas investigaciones se usó un inmunoensayo cromatográfico como método diagnóstico, el cual detectó anticuerpos contra E. canis y no el parásito como tal, por lo que sus resultados pudieron estar sesgados, ya que es probable que los perros hayan sido pacientes recuperados a una infección previa, los anticuerpos podrán ser detectados por largo tiempo (Harrus et al., 1998; Schaefer et al., 2007; McClure et al., 2010).
Se justifica el uso de la capa flogística en el diagnóstico de Ehrlichia sp y Hepatozoon sp porque es una técnica que ha demostrado óptimos resultados. Además, es una técnica económica y fácil de realizar, tiene mayor sensibilidad que el frotis sanguíneo, e incluso ha logrado mejores resultados que la sangre periférica, ganglio linfático, médula ósea y cultivo a corto plazo basado en la detección de mórulas de Ehrlichia canis (Mylonakis et al., 2013).
A pesar del uso de la capa leucocitaria y que el procesado de las muestras se realizó de forma inmediata, no se observó la presencia de gamontes de Hepatozoon sp, congruente con otros estudios donde no se han reportado la presencia de Hepatozoon sp en perros en Perú.












 uBio
uBio 


