Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Ecología Aplicada
versión impresa ISSN 1726-2216
Ecol. apl. v.3 n.1-2 Lima ene./dic. 2004
ARTÍCULOS ORIGINALES
Diversidad y densidad de la comunidad de cactáceas en el cerro Umarcata y quebrada Orobel en el valle del río Chillón (Lima) y su relación con los factores edáficos
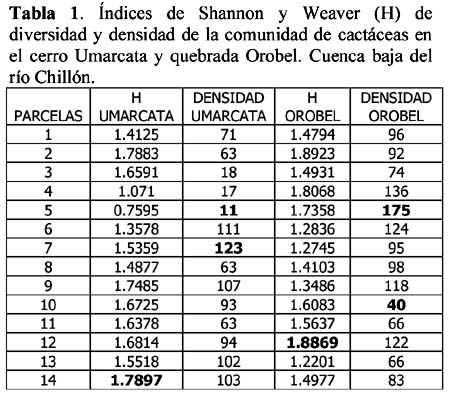
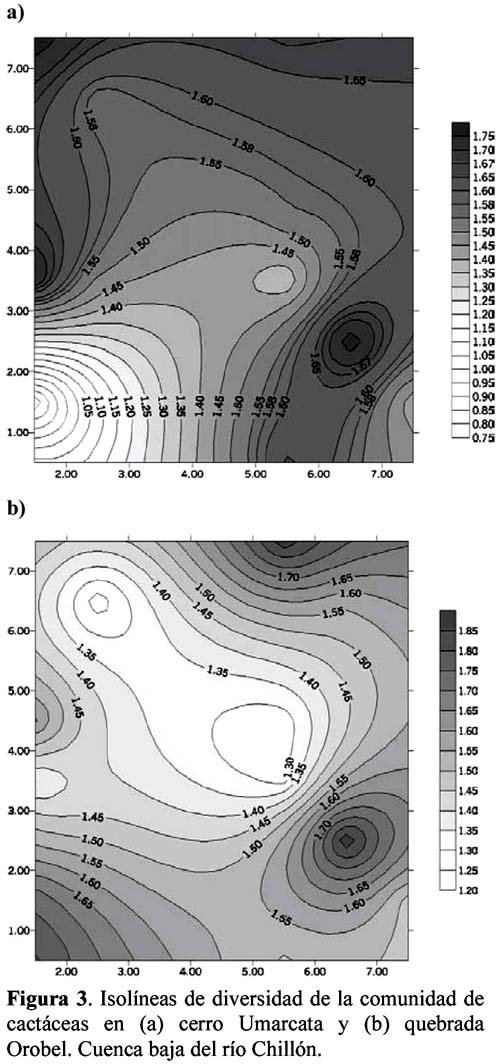
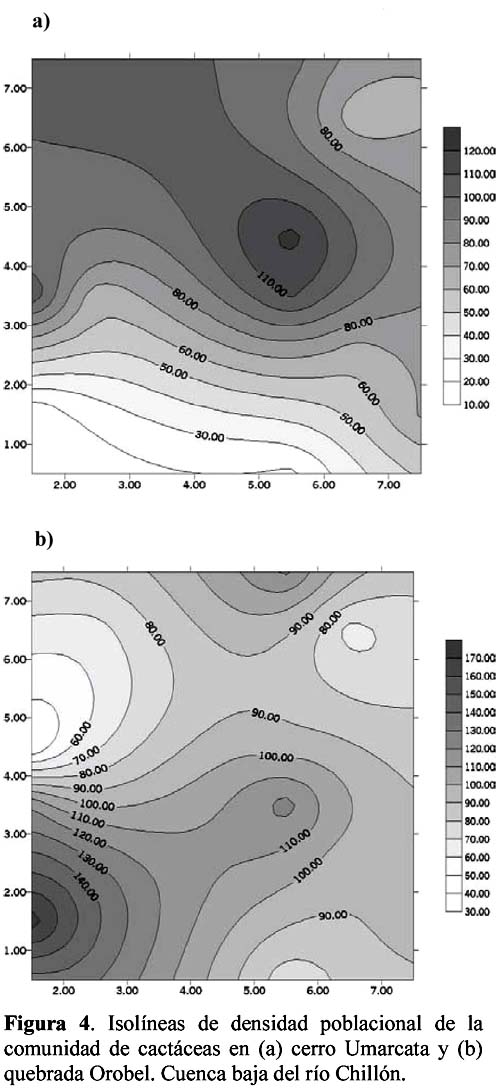
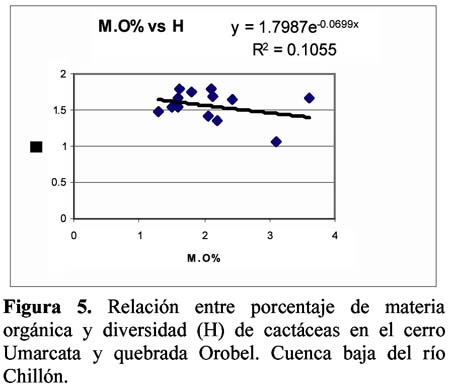
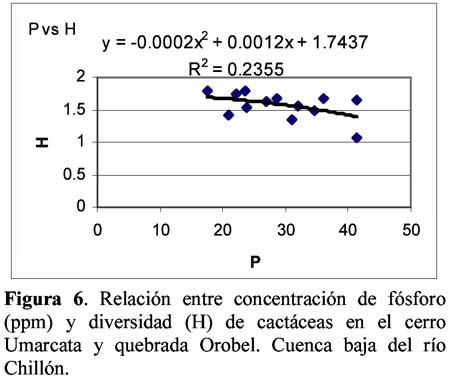
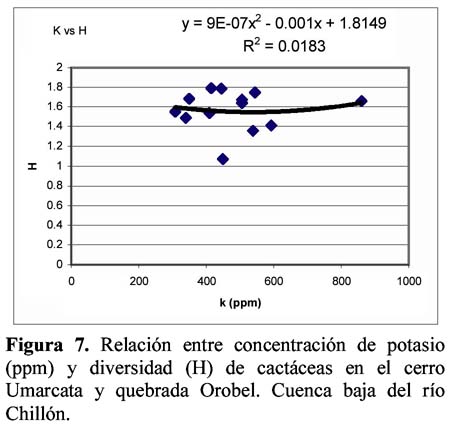
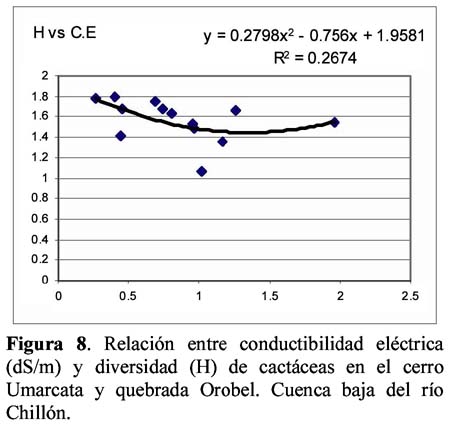
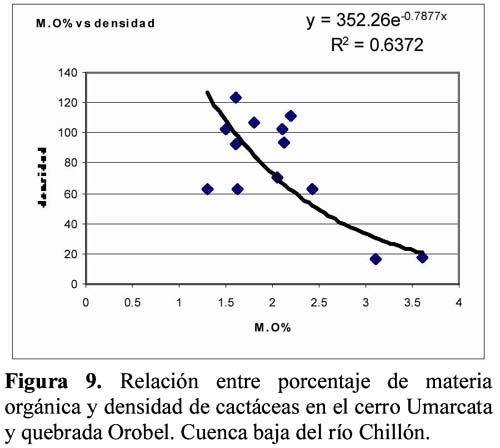
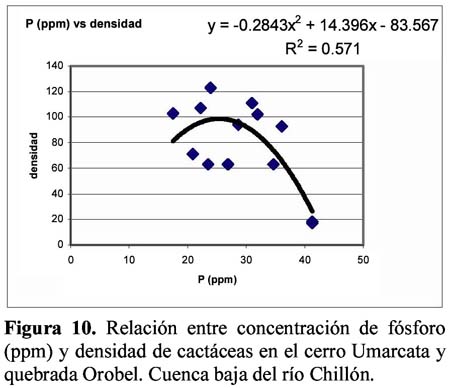
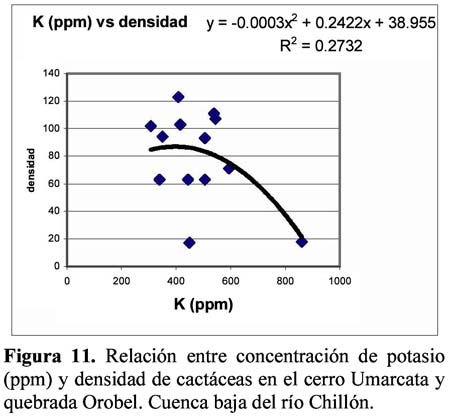
Diversity and density of a cacti community in the Chillón river valley: Umarcata hill and Orobel valley and their relationship with the soil factors Vanessa Teixeira Roth1; Viviana Castro Cepero2; Aldo Ceroni Stuva2 y Raúl Eyzaguirre Pérez3 1 Pontificia Universidad Católica del Perú (PUCP), vteixeira@pucp.edu.pe, Apartado 1761. Lima 100, Perú. Resumen Pocos estudios de vegetación realizados en zonas áridas han asociado factores edáficos con formaciones vegetales, por lo que se hace interesante saber cuáles son los factores edáficos más importantes que afectan a la composición, distribución y estructura de la comunidad. Se estudió así la comunidad de cactáceas en el cerro Umarcata y la quebrada Orobel de la cuenca baja del río Chillón. Se realizó un muestreo aleatorio simple en parcelas cuadradas de 15 metros de lado, con 14 parcelas por zona. Cada zona fue además dividida en tres franjas: alta, media y baja. Se tomaron muestras de suelo, las cuales fueron analizadas para determinar la concentración de potasio, fósforo, materia orgánica, pH, conductividad eléctrica y porcentaje de carbonato de calcio. Los valores de diversidad del cerro Umarcata se encuentran en el rango de 0.75 a 1.789 bits/individuo, mientras que en la quebrada Orobel de 1.22 a 1.88 bits/individuo. En esta última, la diversidad específica y la equidad son mayores, por lo que se considera una comunidad más estable y organizada. El fósforo (15 a 42 ppm) y el potasio (300 a 800 ppm) se constituyen como uno de los factores limitantes en el crecimiento de los cactus en la comunidad, y la conductividad eléctrica (0.3 a 2 dS/m) se relaciona con la diversidad debido a que la conductividad eléctrica mide la salinidad del suelo. Palabras clave: Diversidad, densidad, factores edáficos, comunidad de cactáceas, factor limitante. Abstract Few studies of vegetation conducted in arid zones have associated soil factors with plant associations. In our study we try to understand which are the most important soil factors that affect composition, distribution and structure of the community. The cacti community was studied at Umarcata Hill and Orobel Valley of the Chillon River Basin. A simple random sampling was carried out in square 15 meter sided plots, with 14 plots per area. Every area was divided into three zones: high, medium and low. Soil samples were analyzed to determine potassium, phosphorus, and organic matter concentration, pH, electrical conductivity and calcium carbonate percentage. The diversity values at Umarcata Hill lie in the rank from 0.75 to 1.789 bits / individual, whereas in Orobel Valley they rank from 1.22 to 1.88 bits / individual. In the latter, specific diversity and equity are higher indicating a stable and organized community. Phosphorus (15 to 42 ppm) and potassium (300 to 800 ppm) are the factors that limit cacti growth in the community. Electric conductivity (0.3 dS/m) is related to diversity due to the fact that it measures soil salinity, which in turn affects plant growth. Key words: Diversity, density, soil factors, community of cacti, limiting factors. Introducción La Familia Cactaceae es muy importante en la flora americana debido a la gran adaptabilidad de sus representantes en zonas áridas, donde el agua se presenta como un recurso sumamente escaso. El Perú cuenta con aproximadamente 34 géneros y más de 255 especies (Hunt, 1999). Las zonas áridas y semiáridas guardan una gran variedad de especies de esta familia, las cuales han experimentado un gran proceso evolutivo. En las zonas áridas, la distribución espacial y la dinámica poblacional son afectadas fuertemente por perturbaciones (Leirana-Alcocer & Parra-Tabla, 1999). Sin embargo, muy pocos estudios de vegetación realizados en paisajes semiáridos han tratado de asociar los procesos dados por los ciclos de erosión-depositación al estado actual de las comunidades vegetales (Peterson, 1981; Valiente et al., 1993). En este sentido existe evidencia que indica que la comprensión del estado actual de la vegetación en zonas áridas puede relacionarse con la evolución dinámica de los suelos y formas del relieve (Valiente, et al., 1993). Por lo tanto, es necesario saber cuáles son los factores edáficos más importantes que influencian la composición, distribución y estructura de la comunidad (Leirana-Alcocer & Parra-Tabla, 1999). La diversidad es una expresión de la estructura que resulta de las interacciones entre los elementos del ecosistema que está determinado por factores histórico-evolutivos y factores abióticos y bióticos que actúan sobre cada especie (Margalef, 1982; Odum, 1986) y se divide en componentes que tienen un comportamiento consistente y entendible, proporcionando una estima de la capacidad de conexiones internas o interacciones entre especies en un ecosistema (Houston, 1994). Las zonas áridas son sistemas en los cuales las condiciones abióticas son extremas y determinan tanto la abundancia como la diversidad de las especies vegetales. Estas condiciones abióticas determinan en muchos casos la disponibilidad de recursos, y por lo tanto, la distribución de las especies. Sin embargo, condiciones locales de tipo biótico afectan la distribución y abundancia de los individuos (Golubov et al., 2000). En regiones áridas y semiáridas, la vegetación ha experimentado un profundo proceso de evolución resultando en una variedad de formas de vida y una relativa riqueza de especies (Gómez-Hinostroza & Hernández, 2000). Las cactáceas se consideran plantas de zonas secas y es allí donde se supone se tiene su mayor diversidad. El presente trabajo tuvo como objetivo aportar, al conocimiento de la vegetación de la comunidad de cactáceas en el valle del río Chillón, los parámetros de diversidad, la densidad poblacional y su relación con los factores edáficos. El estudio fue realizado en el cerro Umarcata y quebrada Orobel, ubicados en la cuenca baja del río Chillón. Materiales y métodos Área de estudio Ubicación Clima Suelos Ecología Metodología H = - ∑ pi log2pi Donde: Para relacionar la composición del suelo con la diversidad y densidad de cactáceas se calcularon coeficientes de determinación con modelos cuadráticos y exponenciales para cada una de las superficies. Resultados y discusión Diversidad y densidad La comunidad de cactáceas de las zonas estudiadas están conformadas por las siguientes especies: Opuntia pachypus K. Schumann, Mila nealeana Backeberg, Haageocereus acranthus (Vaupel) Backeberg, H. pseudomelanostele ssp. aureispinus (Rauh & Backeberg) Ostolaza, Clesitocactus acanthurus ssp. faustianus (Backeberg), Melocactus peruvianus Vaupel, Neoraimondia arequipensis spp. roseiflora (Werdermann & Backeberg) Ostolaza, Espostoa melanostele (Vaupel) Borg y Opuntia sphaerica C.F.Förster, esta última sólo se encontró en la quebrada Orobel. Los valores de diversidad se encuentran en un rango de 0.75 a 1.789 bits/individuo en la zona del cerro Umarcata y entre 1.22 a 1.88 bits/individuo en la quebrada Orobel (Tabla 1). Como se puede apreciar la diversidad es ligeramente más alta en la quebrada Orobel. Esto se debe a las diferencias entre la abundancia de especies entre las dos zonas, lo que crea más probabilidades de diversidad en la quebrada Orobel, por presentar una especie más que en el cerro Umarcata, además de una menor dominancia de las principales especies como Melocactus peruvianus. En cuanto a las isolíneas de diversidad se aprecia que en el cerro Umarcata hay sólo un núcleo de alta diversidad que se encuentra en la zona baja a la derecha (Figura 3a), mientras que en la quebrada Orobel hay hasta tres núcleos de alta diversidad, en la zona alta a la derecha, zona baja a la derecha y zona baja a la izquierda (Figura 3b). Sin embargo, así como se aprecian núcleos de alta diversidad en la quebrada Orobel también se pueden apreciar núcleos de baja diversidad, por lo menos dos en la zona alta izquierda y media derecha, mientras que en el cerro Umarcata hay sólo un núcleo de baja diversidad en la zona baja izquierda. Esto indica que la comunidad del cerro Umarcata es más heterogénea en términos de diversidad y densidad ya que las parcelas tienen una gran diferencia entre sus valores de densidad con un mínimo de 11 individuos por parcela hasta 123 individuos por parcela en comparación con quebrada Orobel, donde el mínimo valor de densidad es de 40 individuos por parcela y el máximo de 175 individuos por parcela (Tabla 1). Esto podría indicar que en esta última zona se encuentran muchos núcleos de baja y alta densidad por lo que se constituye como una comunidad más homogénea en términos de distribución espacial, y se podría considerar como una comunidad en un estado sucesional un poco más avanzado que el cerro Umarcata, o en todo caso donde las distribuciones de cada una de las especies es más regular. (Los coeficientes de variabilidad en términos de densidad para cada zona son: el cerro Umarcata 0.5 y la quebrada Orobel 0.34). Comparando la diversidad con la densidad total de cactáceas en el cerro Umarcata (Figura 3a y 4a), se puede apreciar que donde hay menos densidad de especies también hay baja diversidad, como se aprecia en la zona baja de Umarcata que tiene muy baja diversidad de cactaceas. Esto se podría deber a que no sólo hay pocos individuos por especies sino que alguna de las especies está dominando el área. De la misma forma es evidente que donde hay un núcleo alto de densidad la diversidad es baja, pero no se forma ningún núcleo muy estable, como en la zona media. Esto nos indica que hay una especie que está dominando la zona y ésta se encuentra en grandes cantidades. En el caso de la quebrada Orobel (Figura 3b y 4b) se encuentra que en la zona baja a la izquierda hay un núcleo de alta densidad y en el mismo sitio también encontramos un núcleo de alta diversidad. Este hecho nos indica que hay muchos individuos de diferentes especies y todos estos están distribuidos equitativamente dentro de la zona. También se puede apreciar esta distribución en la zona alta a la derecha. Estos resultados nos indican que en la quebrada Orobel hay más diversidad especifica que en el cerro Umarcata y que las especies están distribuidas más homogéneamente, por lo tanto, no hay ninguna especie dominante que desequilibre la comunidad. Se sabe que la diversidad incluye a la riqueza y a la equidad, por lo tanto una comunidad diversa es más estable y más organizada (Margalef, 1991). Relaciones de la diversidad y densidad con la composición del suelo Las relaciones entre las variables de composición de suelo y diversidad no son significativas. Así la relación entre porcentaje de materia orgánica y diversidad da un R2= 0.105 (Figura 5), que es relativamente baja, pero no es una relación lineal ya que cuando la materia orgánica es demasiado alta en el suelo, la diversidad disminuye. Esto podría ser que sólo alguna de las especies de cactus está adaptada a soportar estas cantidades de materia orgánica. Sin embargo, la relación entre el fósforo y la diversidad también es una relación polinómica con un R2= 0.235 (Figura 6), que a pesar de tener un índice de correlación bajo, está demostrando la importancia de un macronutriente como el fósforo en la comunidad; la relación es también inversa como con la densidad, es decir, hay un rango de concentración de fósforo que va entre los 20 a 40 ppm donde la diversidad es más o menos estable entre 1.4 y 1.8, sin embargo si se pasa de esta concentración de fósforo la diversidad disminuye. Este es un comportamiento clásico de un elemento esencial en la composición del suelo y para la comunidad de cactáceas. El comportamiento de la diversidad con el potasio, con un R2= 0.018, no demuestra ninguna relación entre la diversidad y la concentración de potasio (Figura 7). Por otro lado, de los diferentes componentes del suelo que se analizaron, la conductividad eléctrica (CE), fue el que demostró una mayor conectividad con la diversidad con un R2=0.267, aunque no es significativo, igual ilustra la importancia de esta variable en el suelo (Figura 8). La conductividad eléctrica (CE) determina la concentración de sales solubles en el agua presentes en el suelo y está relacionada linealmente con la presión osmótica. El agua que tenga la mayor cantidad de sales disueltas tendrá mayor conductividad eléctrica. En este caso la conductividad eléctrica del suelo es muy baja, lo cual indica que no es un suelo con problemas de sales (Ashman & Puri, 2002). En cuanto a las relaciones entre la composición del suelo y la densidad de cactáceas se aprecia que entre el porcentaje de materia orgánica (%M.O) y la densidad existe una relación exponencial entre las variables con un R2=0.637 (Figura 9). Esta relación muestra que a mayor porcentaje de materia orgánica en el suelo se tiene menor densidad de cactáceas. Este resultado contradice el hecho que las plantas necesitan materia orgánica para poder crecer adecuadamente, lo cual podría deberse a la fisiología de este tipo de plantas. La relación entre fósforo y densidad es descrita por una función con un R2= 0. 571 (Figura 10), es decir, la máxima cantidad de cactáceas en las parcelas está determinada por un rango de concentración de fósforo entre 20 a 30 ppm. Cuando las concentraciones de fósforo están fuera de este rango la densidad de cactáceas disminuye. El fósforo al ser un macronutriente actúa como factor limitante en la comunidad ocasionando que a pesar de su abundancia las cactáceas no lo utilizan. La relación entre potasio y densidad muestra también un comportamiento polinómico de segundo grado con un R2=0.273 (Figura 11), donde se puede apreciar el comportamiento de elemento limitante del potasio en la comunidad, siendo el rango de 350 a 450 ppm, donde se ubica la mayor densidad de cactáceas. Aquí se puede apreciar que hay un límite de concentración, es decir, hay un rango de concentración de estos nutrientes que son utilizados por las plantas y sirven para aumentar su densidad, pasando este rango simplemente las especies no utilizan el macronutriente y afecta su densidad en la parcela. La diversidad de especies en las comunidades de plantas es dependiente, en parte, de la fertilidad del suelo, ya que la adición de nutrientes usualmente gobierna los cambios de riqueza y equitatividad. La diversidad es mayor en niveles intermedios de fertilización (Theodose & Bowman, 1997). En la gran mayoría de los ecosistemas, el fósforo es el principal elemento limitante, por lo que el desarrollo de procesos de conservación y de reciclado interno adquirirá una alta prioridad para estas poblaciones y comunidades (Sarmiento, 1984). La concentración de fósforo y potasio puede hacer decrecer la riqueza de especies, ya que la diversidad suele disminuir con la fertilización en suelos infértiles, cuando la adición de nutrientes aumenta los niveles de fertilidad por encima del valor potencial de diversidad (Theodose & Bowman, 1997). En suelos particularmente bajos en nutrientes, y con un alto o bajo pH, las comunidades de plantas especializadas evolucionan (Krueger et al., 1983). Además el porcentaje de materia orgánica y de nitrógeno está relacionado con el contenido de micronutrientes, como el Mn, Zn y Fe. Finalmente, la observación que un nutriente es limitante, no significa que sólo ese nutriente limita el ecosistema, sino que la limitación simultánea por recursos múltiples parece ser la regla (Tanner et al., 1998) Conclusiones Los valores de diversidad se encuentran en un rango de 0.75 a 1.789 bits/individuo en la zona del cerro Umarcata y entre 1.22 a 1.88 bits/individuo en la quebrada Orobel. En la quebrada Orobel hay más diversidad específica que en el cerro Umarcata y las especies están distribuidas más homogéneamente, por lo tanto, no hay ninguna especie dominante que desequilibre la comunidad. La comunidad del cerro Umarcata, es una comunidad con un alto índice de dominancia de 1 ó 2 especies en la comunidad, como Melocactus peruvianus. El fósforo y el potasio actúan como elementos esenciales en relación a la densidad de cactáceas. Se puede apreciar que hay un límite máximo de concentración para estos macronutrientes en donde la densidad aumenta, pasando este rango, la densidad de las cactáceas disminuye. La conductividad eléctrica (CE), fue la que demostró una mayor asociación con la diversidad, ya que a mayor conductividad pareciera que hubiera mayor diversidad. Agradecimientos Los autores expresan su agradecimiento a los estudiantes del Curriculum de Biología de la Universidad Nacional Agraria La Molina y al Sr. Antonio Sacsara, Capataz del Jardín Botánico Octavio Velarde Núñez, que han participado en la fase de campo, dentro del Proyecto Cactáceas de Lima. Asimismo, al Fondo Especial de Desarrollo Universitario (FEDU) y al Concejo Nacional de Ciencia y Tecnología (CONCYTEC) por el apoyo financiero. Literatura citada Ashman M.R & Puri G. 2002. Essential Soil Science. Blackell Science Ltd. Inglaterra. [ Links ] Centro de Información y Desarrollo Integral de Autogestión (CDIAC). 1993. La Cuenca del Río Chillón. Diagnostico para un Plan Integral de Desarrollo. Lima, Perú. [ Links ] Golubov J., Mandujano M. & Montaña C. 2000. Cactáceas asociadas a pastizales de Hilaria mutica (Bucal.) Benth. En la Reserva de la Biosfera de Mapimí, México. Cactáceas y Suculentas Mexicanas. Tomo XLV Año 45 4: 84-89. [ Links ] Gómez-Hinostroza C. & Hernández H. 2000. Diversity, geographical distribution, and conservation of Cactaceae in the Mier y Noriega region, Mexico. Biodiversity and Conservation. 9: 403-418. [ Links ] Houston M. 1994. Biological Diversity- The Coexistence of species on changing landscape. Edit. Cambridge University Press. England. [ Links ] Hunt D. 1999. Cites Cactaceae Checklist. 2da Edición. [ Links ] Instituto Nacional de Recursos Naturales (INRENA). 1996. Diagnóstico de la Calidad del agua de la Vertiente del Pacífico. Vol II. Lima- Perú. [ Links ] Krueger F.J., Mitchell D.T. & Jarvis J.V.M. 1983. Mediterranean type ecosystems. The Role of nutrients. Springer. Berlín. [ Links ] Leirana-Alcocer J. & Parra-Tabla P. 1999. Factor affecting the distribution, abundant and seedling survival of Mammillaria gaumeri, and endemic cactus of coastal Yucatán, México. Journal of Arid Environments. 41: 421-428. [ Links ] Magurran A. 1991. Diversidad Ecológica y su Medición. Ediciones Vedra. Barcelona, España. [ Links ] Margalef R. 1982. Ecología. Ediciones Omega. Barcelona, España. [ Links ] ---------- 1991. Teoría de los Sistemas Ecológicos. Barcelona, España. [ Links ] Odum E. 1986. Fundamentos de Ecología. Editorial Trillas. Mexico. [ Links ] Oficina Nacional de Recursos Naturales (ONERN). 1975. Inventario y Evaluación de los Recursos Naturales de la zona del Proyecto Marcapomacocha. Perú. [ Links ] Peterson F.F. 1981. Landforms of the Basin and Range Province Defined for Soil Survey, Nevada Agricultural Experiment Station TEchnical Bulletin 28, University of Nevada, Reno. [ Links ] Rivera P. 1981. Análisis sobre las zonas de recreación en áreas naturales en la Cuenca del Río Chillón (Dpto.Lima- Perú). Tesis. Universidad Nacional Agraria La Molina. [ Links ] Sarmiento G. 1984. Los ecosistemas y la ecosfera. Editorial Blume. Barcelona. [ Links ] Tanner E.V.J., Vitousek P.M & Cuevas E. 1998. Experimental investigation of nutrient limitation on forest growth on wet tropical mountains. Ecology. 79 (1): 10-22. [ Links ] Theodose T. & Bowman W. 1997. Nutrient availability, plant abundant, and species diversity in two alpine Tundra communities. Ecology. 78 (6): 1861-1872. [ Links ] Valiente A., Dávila P., Ortega R.J., Arizmendi M.C., León J.L, Breceda A. & Cancino J. 1993. Influencia de la Evolución de una pendiente de piedemonte en una vegetación de cardonal de Pachycereus pringlei en Baja California Sur, México. Investigaciones Geográficas Boletín, núm. especial 3. México. [ Links ]
2 Jardín Botánico Octavio Velarde Nuñez, Departamento Académico de Biología. Facultad de Ciencias. Universidad Nacional Agraria La Molina, vcastro@lamolina.edu.pe, aceroni@lamolina.edu.pe, Apartado 12-056. Lima 12, Perú.
3 Departamento Académico de Estadística e Informática, Facultad de Economía y Planificación, Universidad Nacional Agraria La Molina, reyzaguirre@lamolina.edu.pe Apartado 12-056. Lima 12, Perú.
El río Chillón se origina en la laguna de Chonta a 4800 msnm, y se alimenta con las precipitaciones que caen en su cuenca colectora y con los deshielos de la cordillera de la Viuda. La cuenca del río Chillón se halla comprendida entre las coordenadas geográficas 76º 20 y 77º 10 Longitud Oeste y entre los 11º 20 y 12º 00 Latitud Sur. Políticamente se halla ubicada en el departamento de Lima, ocupando las provincias de Lima y Canta; limita por el Norte con la cuenca del río Chancay – Huaral, por el Sur con la cuenca del río Rímac, por el Este con la cuenca del río Mantaro y por el Oeste con el Océano Pacífico (INRENA, 1996).
El estudio se realizó en la cuenca baja del río Chillón en dos zonas: cerro Umarcata (76º 46 9 Longitud Oeste y 11º 37 35 Latitud Sur), aproximadamente a 1260 msnm y quebrada Orobel (76º 45 25.9 Longitud Oeste y 11º 45 25.9 Latitud Sur), aproximadamente a 1380 msnm (Figura 1). 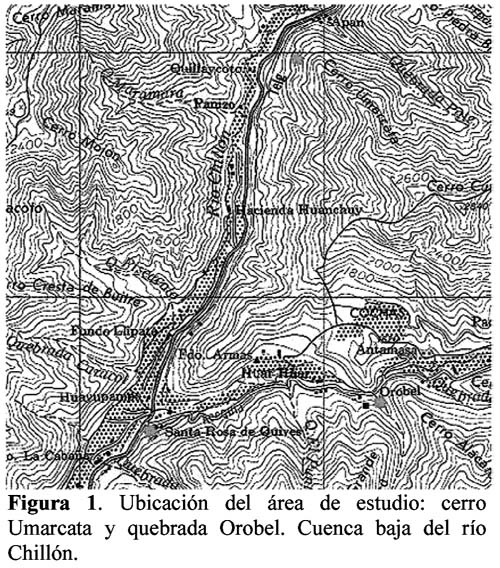
La temperatura media anual cerca al mar es de 20ºC y en el interior es de 13.6º C (Canta, 2832 msnm). La precipitación pluvial en la cuenca del río Chillón varía desde escasos milímetros en la costa árida y desértica hasta más de 600 mm en la cordillera (INRENA, 1996). La humedad relativa (HR) en términos generales es mayor en la costa próxima al litoral (83%) que en la sierra baja (62%) (CDIAG, 1993).
En la zona predominan los suelos litosólicos, salvo en la zona de monte ribereño (Rivera, 1981). Por su naturaleza los suelos de la cuenca son aluviales en las áreas de valle, coluviales en las áreas de quebradas, aluvio-coluviales y eólicos en las pampas y residuales en las áreas de laderas y zonas de montaña (CDIAG, 1993). Conforme nos acercamos a Canta son más frecuentes los suelos de tipo litosol desértico-andosol vítrico (Rivera, 1981).
El piso ecológico involucrado en el estudio es la Formación matorral desértico Sub-Tropical (md – ST): Se extiende entre los 800 hasta los 2200 msnm y abarca 638.30 km2 que representa el 45% del área total. El clima es árido y semi-cálido, es decir, que la precipitación promedio se estima que es mayor de 125 mm anuales y la temperatura media anual está alrededor de 18ºC. Topográficamente, la formación presenta tres áreas bien definidas constituidas por el área agrícola de valle, área agrícola de quebrada y piedemonte y la última conformada por montañas áridas (ONERN, 1975).
Se realizó un muestreo aleatorio simple en parcelas de 15m x 15m en cada una de las zonas de estudio. Para determinar el número de individuos por especie, cada una de estas zonas fueron divididas en tres franjas (alta, media, baja) donde se aleatorizaron las parcelas (Figura 2). El número de parcelas en cada superficie fue de 14. En cada una de estas parcelas se obtuvieron muestras de suelos que fueron analizadas, para determinar su composición. Las variables de suelo analizadas fueron: potasio, fósforo, materia orgánica, pH, conductividad eléctrica y porcentaje de carbonato de calcio. La diversidad de la comunidad de cactáceas se midió con el Índice de Shannon y Weaver (Magurran, 1991).
pi: es la proporción de individuos de la i-ésima especie.