Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Ecología Aplicada
versión impresa ISSN 1726-2216
Ecol. apl. v.4 n.1-2 Lima ene./dic. 2005
El forrajeo de la hormiga Camponotus sp. en los botones florales del cactus Neoraimondia arequipensis subsp. roseiflora ( Werdermann & Backeberg ) Ostolaza ( Cactaceae )
Camponatus sp. ant foraging on flowering buttons of the Neoraimondia arequipensis subsp. roseiflora (Werdermann & Backeberg ) Ostolaza ( Cactaceae ) cactus
Sidney Novoa1, Inés Redolfi2, Aldo Ceroni1 y Consuelo Arellano3
1 Jardín Botánico Octavio Velarde Núñez. Departamento Académico de Biología. Universidad Nacional Agraria La Molina. Av. La Molina s/n, Apartado Postal12056, Lima100. Perú, 2000084@lamolina.edu.pe, aceroni@lamolina.edu.pe
2 Laboratorio de Control Biológico y Ecología de Artrópodos. Departamento Académico de Biología, Universidad Nacional Agraria La Molina, rhi@lamolina.edu.pe
3 Gabinete de Investigación en Ecología Cuantitativa. Departamento Académico de Biología. Universidad Nacional Agraria La Molina, carellano@lamolina.edu.pe
Resumen
A fin de determinar la secuencia estacional del forrajeo de la hormiga Camponotus sp. en los botones florales del cactus Neoraimondia arequipensis subsp. roseiflora ( Werdermann & Backeberg ) Ostolaza ( Cactaceae ) , se realizó un estudio en el cerro Umarcata, cuenca baja del río Chillón, Lima, Perú. Se marcaron en forma aleatoria 15 plantas adultas del cactus y se evaluó durante un año el número de botones totales producidos por la planta hasta un máximo de 50 botones y el número total de hormigas sobre cada uno de los botones florales. Las observaciones fueron mensuales desde Octubre del 2003 hasta Setiembre del 2004. Las matrices de similitud entre meses estudiados basadas en producción de botones florales y visitas de hormigas a los botones florales respectivamente, se sometieron a la técnica de ordenación de escalamiento multidimensional no paramétrico ( NMDS ) y las configuraciones de similitud entre meses obtenidas se compararon mediante la técnica Procrustes de rotación de ejes, e igualmente se examinó la significancia de la asociación ( no randomizada ) entre ambas configuraciones mediante la prueba randomizada de Procrustes ( Protest ) con 1000 permutaciones. La hormiga forrajea el néctar secretado sobre los botones florales desde que estos aún se encuentran tapados por los pelos afelpados de las areolas hasta que se abren en flores rosadas. La visita de las hormigas presenta un pico durante los meses de Marzo, Abril y Mayo, con un punto máximo en el mes de Abril en respuesta al estadio fenológico, a la temperatura y humedad relativa. Existe una asociación entre el número de botones florales producidos y el número de hormigas visitantes que se intensifica durante los meses de Abril, Julio, Octubre y Noviembre y esta se hace más débil durante los meses restantes, y que podría responder a la oferta de alimento y a factores abióticos como la temperatura y la humedad relativa.
Palabras clave: Camponotus sp., ecosistema árido, forrajeo hormiga-cactácea, Neoraimondia arequipensis subsp. roseiflora, secuencia estacional.
Abstract
The seasonal foraging sequence of the Camponatus sp. ant on the flowering buttons of the Neoraimondia arequipensis subsp. roseiflora ( Werdermann & Backeberg ) Ostolaza ( Cactaceae ) cactus was the subject of a study at Umarcata hills, lower Rio Chillon basin, Lima, Peru. Fifteen mature cacti plants were marked randomly and the number of total buttons, up to a maximum of 50 buttons, produced by each plant was registered monthly, during twelve months, and the observed total number of ants in each flowering button was simultaneously recorded. Observations were taken monthly from October 2003 to September 2004. Similarity matrices between these months, based on phenological and ant-related data, were compared by the Procrustes technique of rotational axis. A randomized test, Procrustes test or Protest with 1000 permutations, was used to analyze the significance of ( non random ) association between the configurations obtained by non parametric multidimensional acaling ( NMDS ) ordenation technique. Ants forage the nectar secreted over the flowering buttons, from the time they are covered by the areoles plush hair till they open as pink flowers. Ant visits show a peak during the months of March, April and May, reaching their maximum in April in response to the recurrent cactus phenophase, temperature and relative humidity. There is an association between the number of flower buttons produced and the number of visiting ants, which is intensified during April, July, October and November, and becomes weaker during the remaining months, which might respond to food offer and abiotic factors such as temperature and relative humidity.
Keywords: Camponotus sp., arid ecosystem, foraging, ant-cactaceae, Neoraimondia arequipensis subsp. roseiflora, seasonal sequence.
Introducción
La relación hormiga-cactácea ha sido estudiada en diversas zonas desérticas del mundo, desde las primeras observaciones de Lloyd ( 1908 ) de grupos de hormigas que se aglomeraban en los jóvenes brotes de una especie de Cylindropuntia sp. La relación entre la hormiga Crematogaster opuntiae Buren y la cactácea Opuntia acanthocarpa Engelmann & Bigelow en el noreste de Phoenix, Arizona ( Pickett & Clark, 1979 ) . Las once hormigas visitantes sobre Ferocactus gracilis Gates ( Blom & Clark, 1980 ) . Algunas observaciones de hormigas sobre Opuntia basilaris Engelm. & J.M. Bigelow, Opuntia bigelovii Engelm., Opuntia echinocarpa Engelm. & J.M. Bigelow y Ferocactus acanthodes ( Lemaire ) Britton & Rose ( Pemberton,1988 ) . Dos especies de hormigas, Crematogaster depilis Wheeler e Iridomyrmex pruninosus Royer en Ferocactus cylindraceus ( Engelmann ) Orcutt ( Ruffener & Clark, 1986; Hunt, 1999 ) . Las hormigas Camponotus planatus Royer y Crematogaster brevispinosa Mayr en Opuntia stricta ( Haw. ) Haw ( Rico, 1993 ) . La visita de hormigas a nectarios extraflorales en O. stricta en el desierto de Sonora ( México ) y la protección de la hormiga al cactus ( Oliveira et al., 1999 ) . En el Perú, los estudios de esta relación son escasos. Ostolaza et al. ( 1985 ) mencionan acerca de una ¨ hormiga negra ¨ que se encontraba sobre los botones florales de Neoraimondia arequipensis. La relación que se da en los jardines de las hormigas Camponotus femoratus y Azteca cf. traili en la cual estas incorporan semillas de las heces de algunos vertebrados beneficiando al cactus epífito Epiphyllum phyllanthus ( L. ) Haw y a la vez aprovechando sus frutos y segregación de azúcares a través de sus nectarios ( Davidson, 1988; Davison & Epstein, 1989 ) . El estudio de la interacción de la hormiga Camponotus sp. y una comunidad de cactáceas en el valle del río Chillón, determina una relación altamente significativa entre esta hormiga y los botones florales de N. arequipensis, por lo que podría considerarse a Camponotus sp. como un bioindicador de nectarios externos en este cactus ( Novoa et al., 2003 ) .
Con la finalidad de profundizar en el conocimiento del forrajeo de la hormiga Camponotus sp. en N. arequipensis, el presente trabajo tiene por objetivo determinar la secuencia estacional del forrajeo de la hormiga en los botones florales y la relación con la fenología del cactus. Por otro lado, al determinar la secuencia estacional de la actividad de la hormiga sobre el cactus se podría tener un indicador indirecto de la producción de néctar de la planta a lo largo del tiempo.
Materiales y Métodos
Ubicación: El presente estudio fue llevado a cabo en el cerro Umarcata, el cual se encuentra a una distancia de 6 kilómetros de Santa Rosa de Quives, a la altura del kilómetro 69 de la carretera Lima – Canta, a una altitud de 1260 msnm a 11°3739 L.S. y 76°469 L.O. en el valle del río Chillón, Departamento de Lima, en la Provincia de Canta. La vegetación en la Zona de Vida de la cuenca baja del río Chillón corresponde al matorral desértico Subtropical ( md – ST ) ( Novoa et al., 2005 ).
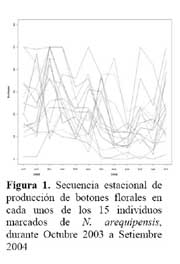
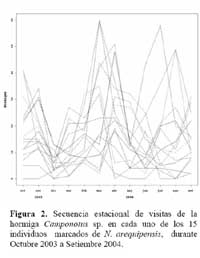
Determinación de la secuencia estacional de la actividad de la hormiga Camponotus sp. forrajeando en Neoraimondia arequipensis subsp. roseiflora Se realizaron visitas mensuales desde Octubre del 2003 hasta Setiembre del 2004 donde se marcaron 15 plantas adultas al azar. Se evaluaron el número de botones totales producidos por la planta y el número total de hormigas sobre cada uno de los botones florales; el conteo se realizó en el instante en el que el observador fijaba la mirada sobre la estructura floral. Se tomó en cuenta un máximo de 50 botones florales ( n=50 ) . Finalmente, en base a la información anterior, se construyeron curvas de actividad de las hormigas ( y de producción de botones ) para ilustrar la secuencia estacional en el periodo de estudio.
Determinación de la relación entre la hormiga Camponotus sp. y el estado fenológico de Neoraimondia arequipensis subsp. roseiflora Disimilitud entre cada par de meses en términos de la producción mensual de botones florales o de presencia de hormigas sobre los botones florales se calcularon utilizando la distancia euclidiana normalizada ( Okasanen, 2004 ) . Esta medida reduce la influencia de valores de frecuencia extremos. Las matrices de disimilitud se sometieron a un análisis de ordinación ( McCune & Grace, 2002 ) mediante la técnica de escalamiento multidimensional no métrico ( NMDS, Nonmetric MultiDimensional Scaling ) . Este análisis produce una representación bidimensional de las distancias entre meses, haciéndose corresponder la disimilitud observada entre dos meses cualesquiera a la distancia en el plano entre estos dos meses, preservándose el ordenamiento ( ranking ) de las disimilitudes originales. Ambas configuraciones bidimensionales ( NMDS-hormigas, NMDS-botones ) se compararon mediante la técnica Procrustes ( Peres- Neto & Jackson, 2001; Okasanen, 2004 ) de rotación de ejes, utilizando el programa estadístico R, versión 2.0. Esta técnica busca aproximar al máximo de similaridad una de las configuraciones ( NMDShormigas ) a la configuración base ( NMDS-botones ) mediante procesos de rotación, traslación y expansión y permite establecer el grado de asociación entre ambas configuraciones. Mediante un análisis de Protest con 1000 permutaciones se examinó la significancia de la asociación ( no randomizada ) entre ambas configuraciones ( Peres-Neto & Jackson, 2001; Okasanen, 2004 ) . El número de botones florales y el número de hormigas fueron relacionados con los datos fenológicos de N. arequipensis según Novoa et al. ( 2005 ) . Paralelamente a estas evaluaciones se tomaron datos de temperatura y humedad relativa con un termohidrómetro digital colocado a la sombra, al pie del cactus.
Determinación de tejido secretor en botones florales y flores Se realizaron cortes longitudinales a mano alzada ( Ceroni, 1998 ) de botones florales y flores para determinar qué estructuras producían la secreción de néctar. Estos fueron teñidos con zafranina y observados al microscopio óptico a 400X.
Resultados y Discusión
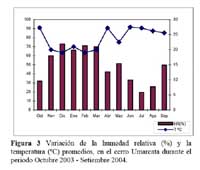
Determinación de la secuencia estacional de la actividad de la hormiga Camponotus sp. forrajeando en Neoraimondia arequipensis subsp. roseiflora La hormiga Camponotus sp. forrajeaba sobre los botones florales de N. arequipensis subsp. roseiflora desde que estos aún se encontraban tapados por los pelos afelpados de las areolas hasta que se abrían en flores rosadas. A pesar de no encontrarse un ensamble secuencial entre todas las plantas respecto a la visita de la hormiga es notoria la presencia de un pico de mayor número de visitantes durante los meses de Marzo y Abril, con un máximo de visitantes totales en el mes de Marzo ( Figura 1, Tabla 1 ) . A dichos meses les corresponden los estadios fenológicos de botones abortados y floración total. Pese a que los meses que van desde Noviembre hasta Enero fueron más abundantes para el estadio fenológico de botones florales ( Figura 2, Tabla 1 ) , este máximo de visitas de hormigas en el mes de Abril podría explicarse debido a que durante los meses anteriores la humedad relativa se incrementó sobre el 65%, por otra parte la temperatura disminuyó hasta los 19 ºC de promedio ( Figura 3 ) . Las hormigas que se alimentan de comida líquida en los desiertos responden a cambios en el contenido de agua de su alimentación ( Ruffener & Clark, 1986 ) . El incremento de la humedad permite que la planta desarrolle una mayor cantidad de estructuras florales y también es la causante de que la concentración de los azúcares en el néctar disminuya, esto sumado al descenso de la temperatura se constituyen en los principales factores que afectan a la secuencia estacional de la actividad de la hormiga Camponotus sp.
Por otra parte durante los meses de Abril y Mayo las temperaturas se mantienen estables bordeando los 24 ºC en promedio y 45% de Humedad Relativa y en el mes de Abril junto con la floración total se da una nueva campaña de botones florales los cuales serían más atractivos a la hormiga al presentar una mayor concentración de néctar además de que las condiciones ambientales son más cálidas. Los valores más bajos de visita se dieron entre los meses de Diciembre y Enero, meses en los que se resaltan los estadios botones abortados y flores marchitas los cuales no fueron atractivos a la hormiga.
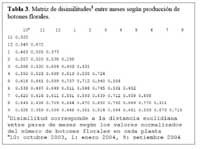
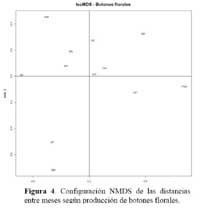
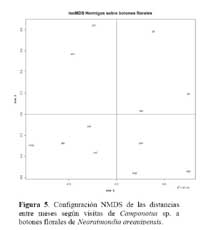
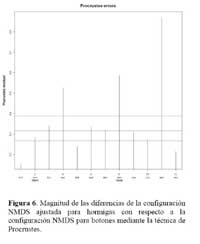
Determinación de la relación entre la hormiga Camponotus sp. y el estado fenológico de Neoraimondia arequipensis subsp. roseiflora Las matrices de disimilitud entre meses según visitas de hormigas ( Tabla 2 ) y producción de botones ( Tabla 3 ) se utilizaron para hallar mediante el análisis no-métrico de escala dimensional múltiple ( NMDS ) las configuraciones NMDS-hormigas ( Figura 4 ) y NMDS-botones ( Figura 5 ) de los meses del año que muestran los meses con respuesta similar ( distancias menores ) según la producción de botones florales o las visitas de hormigas a los botones florales. El coeficiente de correlación entre ambas configuraciones resultó igual a 0.5783 en una rotación Procrustes simétrico, con un nivel de significación observado igual a 0.034 para 1000 permutaciones, lo cual permite concluir que existe asociación ( _=0.05 ) entre los patrones de similitud de los meses del año según la producción de botones florales y según el número de hormigas observadas forrajeando sobre los botones florales. Los Meses de Enero, Mayo y Agosto muestran las mayores discongruencias entre el comportamiento de hormigas y botones, mientras que es Octubre donde ocurre la mayor congruencia de comportamiento ( Figura 6 ) ; corrrespondiendo Mayo y Agosto a meses con alta variabilidad relativa, mientras que Enero presenta baja correlación entre el número de hormigas y la producción de botones florales por planta ( r=0.023 ) ; en Octubre relativamente menor variabilidad y una correlación media ( r=0.637 ) .
Los resultados muestran que existe una asociación entre el número de hormigas sobre los botones florales y la producción de los mismos durante el periodo Marzo-Agosto que se intensifica durante los meses de Abril, Mayo y Agosto ( r > 0.85, P<0.001 ) y ésta se hace más débil durante los meses Diciembre, Enero, Febrero ( correlación de Pearson r< 0.32, P>0.05 ) , siendo los meses de mayor intensidad de visita ( mayor promedio de hormigas por planta, mayor ratio de visitas ) Abril y Marzo ( Tabla 1 ) . Los meses donde la relación se hace más fuerte ( r > 0.60, ratio > 1 ) corresponden a estadios fenológicos donde la producción de botones florales es escasa. Igualmente estos meses coinciden con los valores más altos de temperatura y más bajos de humedad por lo que al parecer, la presencia de la hormiga Camponotus sp. responde a la oferta de alimento y a factores abióticos, a mayor cantidad de alimento habrá una mayor distribución de la hormiga por botones florales en la población del cactus muestreada haciendo que la probabilidad de encontrar una o más hormigas por botón floral disminuya. Asimismo la disminución de la temperatura y aumento de humedad relativa afectará al número de hormigas que visiten al cactus durante el tiempo de estudio. En los meses de Abril a Octubre la humedad relativa es baja y permite que la planta concentre mayor cantidad de azúcares. Se ha demostrado que las hormigas prefieren néctares que son ricos en azúcares ( glucosa, fructosa y sacarosa ) y aminoácidos y que son capaces de discriminar entre néctares pobres y ricos en estas sustancias ( Pickett & Clark, 1979; Rico, 1993 ) . Por otra parte, en los meses de Diciembre hasta Febrero donde hubo una gran producción de botones florales la presencia de la hormiga es más débil concordando con la hipótesis de la distribución de hormigas por recurso y calidad del mismo. Igualmente, en los meses de Mayo y Junio se desarrollaron los estadios de fruto inmaduro y estado vegetativo, los cuales no le son atractivos a la hormiga por ser muy bajos en producción de botones florales, pero la asociación también se hace fuerte, esto debido a que los pocos botones florales que se encontraron en estos meses fueron visitados por más de una hormiga. La explicación de la relación de la hormiga con el cactus se debe a la arquitectura de N. arequipensis subsp. roseiflora. Este cactus posee pocas costillas, entre 4 – 7 bien distanciadas entre si, lo cual facilita a las hormigas a llegar a los botones florales más que en otros cactus de la comunidad con gran densidad de espinas y estrechez entre costillas.
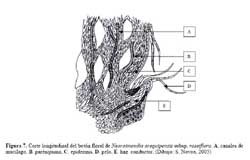
Pero la razón más importante es la sobreproducción de estructuras florales que deberían proveer de alimento constantemente a la hormiga. Novoa et al., ( 2003 ) realizaron la prueba de éxito de colecta de alimento líquido el cual dio un resultado positivo encontrándose una gran abundancia de alimento líquido transportado por las hormigas. Para determinar qué estructuras del cactus producían este alimento se hicieron cortes longitudinales a los botones florales y flores de N. arequipensis, encontrándose que en el interior de estas existía una cámara nectarífera pero esta era estéril, es decir que no producía ningún azúcar líquido que le pudiese atraer a la hormiga. Sin embargo, las observaciones de los botones florales en el campo permitieron detectar que externamente los botones exudaban numerosas gotitas dulces que ante la ausencia de la hormiga se cristalizaban en pequeños cubitos de azúcar. En los cortes transversales de estas estructuras se observa la presencia de un parénquima muy vascularizado, atravesado por canales mucilaginosos, cuyos haces conductores terminan en la zona apical de los tépalos petaloides de flores y botones ( Figura 7) , característica que se ha reportado en Neobuxbaunia polylopha ( Buxbaum, 1953 ) y que podría explicar porque se da esa exudación externa sin encontrarse una estructura definida.
La estrecha relación que se observó durante la secuencia estacional en la oferta de alimento por el cactus a la hormiga y el comportamiento agresivo por parte de Camponotus sp. frente a insectos fitófagos ( Diptera y Lepidoptera ) , como la persecución de estos hasta su alejamiento del botón o flor, son un determinante de beneficio para el cactus. El néctar segregado podría ser la recompensa que reciben las hormigas por la protección frente a los herbívoros, a pesar que la hormiga no presentó un comportamiento depredador. Numerosos estudios han demostrado que las hormigas son atraídas por el néctar que secretan las plantas y esta relación tiene como finalidad la exclusión de fitófagos u otros beneficios para la planta ( Deuth, 1977; Inouye & Taylor, 1979; Koptur, 1979, Pickett & Clark, 1979; Schemske, 1980; Keeler, 1981; Stephenson, 1982; Horvitz & Schemske, 1984; Barton, 1986; Davidson & McKey, 1993; Fonseca, 1999; Oliveira et al., 1999 ) . Además las plantas brindan condiciones favorables como sombra y temperatura que intervienen en el establecimiento de los nidos de las hormigas bajo el cactus, aireando las raíces a través de las galerías subterráneas e incrementando los nutrientes a través de la acumulación de sus desechos, a un suelo pobre en elementos esenciales ( Teixeira et al., 2004 ) .
Agradecimientos
Los autores expresan su agradecimiento a los estudiantes de Biología de la UNALM que colaboraron en la toma de datos. Igualmente, a los dos revisores convocados, cuyas sugerencias hicieron posible mejorar el manuscrito original. Esta investigación fue financiada por el Fondo Especial de Desarrollo Universitario ( FEDU ) de la Universidad Nacional Agraria La Molina.
Literatura citada
Barton A.M. 1986. Spatial variation in the effect of ants on an extrafloral nectary plant. Ecology. 67 ( 2 ) : 495-504.
Blom P.E. & Clark W.H. 1980. Observations of Ants ( Hymenoptera: Formicidae ) visiting extrafloral nectarines of the barrel cactus, Ferocactus gracilis Gates ( Cactaceae ) , in baja California, México. The Southwestern Naturalist. ( 25 ) 2: 181-196.
Buxbaum F. 1953. Morphology of cacti. Section II. Flower.Abbey Garden Press, Pasadema.
Ceroni A. 1998. Modelos vasculares en peciolos de Leguminosas del Jardín Botánico Octavio Velarde Núñez de la Universidad Nacional Agraria La Molina. Anales Científicos. Vols. XXXVI – XXXVII: 151-166.
Davidson D. 1988. Ecological studies of neotropical ant gardens. Ecology. 69 ( 4 ) : 1138- 1152.
Davidson D. & Epstein W. 1989. Epiphitic associations with ants, in Vascular Plants as Epiphytes. U. Lüttege. Ed. Springer-Verlag, Berlin.
Davidson D. & McKey D. 1993. The evolutionary ecology of symbiotic ant-plant relationships. Journal of Hymenoptera Research. 2( 1 ) : 13-83. Fonseca C.R. 1999. Amazonian ant-plant interactions and the nesting space limitation hipótesis. Journal of Tropical Ecology. 15: 807-825.
Hunt C. 1999. CITES. Cactaceae Checklist. 2nd. Ed. Deuth D. 1977. The function of extrafloral nectaries in Aphelandra deppeana Schl. and Cham. ( Acanthaceae ) . Brenesia. 10: 135-145.
Horvitz C.C. & Schemske D.W. 1984. Effects of nectar feedeng ants and an ant-tended herbivore on seed production of a neotropical herb. Ecology. 65: 1369- 1378.
Inouye D.W. & Taylor O.R. 1979. A temperature region plant-and-seed predator system: consequences of extrafloral nectar secretion by Helianthella quinquenervis. Ecology. 60: 1-7.
Keeler K.H. 1981. Function of Mentzelia nuda ( Loasaceae ) postfloral nectaries in seed defense. American Journal of Botany. 68: 295-299.
Koptur S. 1979. Facultative mutualism between weedy verches bearing extrafloral nectaries and weedy ants in California. American Journal of Botany. 66:1016-1020.
Lloyd F.E. 1908. Extrafloral nectaries in the cacti. Plant World. 11: 138-140.
McCune, Bruce & James B. Grace. 2002. Analysis of Ecological Communities. MjM Software Design, Gleneden Beach, Oregon. USA.
Novoa S., Castro V., Ceroni A. & Redolfi I. 2003. Relación entre la hormiga Camponotus sp. ( Hymenoptera: Formicidae ) y una comunidad de cactus ( Cactaceae ) en el valle del río Chillón. Ecol. apl. 2 ( 1 ) : 69-73.
Novoa S., Ceroni A & Arellano C. 2005. Contribución al conocimiento de la fenología del cactus Neoraimondia arequipensis subsp roseiflora ( Werdermann & Backeberg ) Ostolaza ( Cactaceae ) en el valle del río Chillón, Lima-Perú. Ecol. apl. 4 ( 1/2 ) ( en prensa ) .
Oksanen, J., Kindt, R. & O'Hara, R.B. ( 2005 ) . vegan: Community Ecology Package version 1.6-9. http://cc.oulu.fi/~jarioksa/.
Oliveira P.S., Rico-Gray V., Díaz-Castelazo C. & Castillo- Guevara C. 1999. Interaction between ants, extrafloral nectaries and insect herbivores in Neotropical coastal sand dunes: herbivore deterrence bu visiting ants icreases fruit set in Opuntia stricta ( Cactacea ) . Functional Ecology. 13: 623-631.
Ostolaza C., Mitich W.L. & King J.M. 1985. Neoraimondia arequipensis var. roseiflora ( Werd & Backbg ) Rauh. Cactus and Succulent. Journal ( U.S ) . 57: 60-64.
Peres-Neto P.R. & Jackson D.A. 2001. How well do multivariate data sets match? The advantages of a Procrustean superimposition approach over the Mantel test. Oecologia. 129:169-178.
Pemberton R. 1988. The abundante of plants bearing extrafloral nectaries in the colorado and Mojave desert communities of southern California. Madroño. 35( 3 ) : 238-246.
Pickett C. & Clark W. 1979. The function of extrafloral nectarines in Opuntia acanthocarpa ( Cactaceae ) . American Journal of Botany. 66: 618-625.
R Development Core Team. 2005. R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. ISBN 3-900051- 07-0, URL http://www.R-project.org.
Rico V. 1993. Use of plant-derived food resources by ants in the dry tropical lowlands of coastal Veracruz, México. Biotropica. 25( 3 ) : 301-315.
Ruffener G. & Clark W. 1986. Extrafloral nectar in Ferocactus acanthodes ( Cactaceae ) : composition and its importance to ants. American Journal of Botany. 73: 185-189.
Schemske D.W. 1980. The evolutionary significance of extrafloral nectar production by Costus woodsonii ( Zingiberaceae ) : an experiemntal analysis of ant protection. Journal of Ecology. 68: 959-968.
Stephenson A.G. 1982. The role of extrafloral nectaries of Catalpa speciosa in limiting herbivory and increasing fruit production. Ecology. 63: 663-669.
Teixeira V., Castro V., Ceroni A. & Eyzaguirre R. 2004. Diversidad y densidad de la comunidad de cactáceas en el cerro Umarcata y quebrada Oropel en el valle del río Chillón ( Lima ) y su relación con los factores edáficos. Ecol. apl. 3 ( 1/2 ) :1-8.