Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Ecología Aplicada
versión impresa ISSN 1726-2216
Ecol. apl. v.4 n.1-2 Lima ene./dic. 2005
Selectividad del insecticida Cartap empleando bioensayos con organismos no destinatarios
Selectivity of the cartap insecticide employing bioassays with non target organisms
José Iannacone1 y Lorena Alvariño2
1 Laboratorio de Ecofisiología Animal. Facultad de Ciencias Naturales y Matemática. Universidad Nacional Federico Villarreal. Calle San Marcos 383, Pueblo Libre, Lima, Perú. E-mail: joseiannacone@yahoo.es
2 Laboratorio de Ecofisiología Animal. Facultad de Ciencias Naturales y Matemática. Universidad Nacional Federico Villarreal. Calle San Marcos 383, Pueblo Libre, Lima, Perú. E-mail: joselorena@terra.com
Resumen
El objetivo de la presente investigación fue evaluar la ecotoxicidad del cartap ( Bala® 50 PS ) sobre ocho organismos animales no destinatarios:
1) Melanoides tuberculata ( Müller, 1774 ) ( Mollusca ) , 2) Emerita analoga ( Stimpson, 1857 ) ( Crustácea ) , 3) Chironomus calligraphus Goeldi, 1805 ( Diptera ) , 4) Cyprinus carpio ( Linné, 1758 ) ( Osteichyties ) , 5) Eisenia foetida ( Savigny, 1826 ) ( Annelida ) , 6) Podisus nigrispinus (Dallas, 1851 ) ( Hemiptera ) , 7) Trichogramma fuentesi Torre, 1980 ( Hymenoptera ) y 8) Trichogrammatoidea bactrae Nagaraja, 1979 (Hymenoptera ) , y evaluar la selectividad de este insecticida. Los parámetros de toxicidad aguda evaluados fueron la concentración letal media (CL50 ) ( mg o μg L-1 ) , la dosis letal media ( DL50 ) ( mg o μg kg-1 ) y el tiempo letal medio ( TL50 ) (h) . La secuencia de sensibilidad al cartap en el ambiente acuático en términos de CL50 a 24 h de exposición fue: E. analoga > C. carpio > Ch. calligraphus > M. tuberculata. Para E. foetida, se encontró un incremento de la mortalidad con las dosis crecientes del cartap en el suelo, y a partir de 257 mg IA de cartap kg-1, se observó una disminución del peso húmedo. En las ninfas II de P. nigrispinus, el efecto de contacto produjo mayor mortalidad que el de inmersión. T. bactrae presentó mayor sensibilidad en la emergencia de huevos que T. fuentesi. El cartap mostró selectividad sobre siete de las ocho especies analizadas. Solo E. analoga presentó un riesgo a nivel del ambiente acuático.
Palabras claves: ecotoxicología, bioensayos, Cyprinus, Chironomus, Eisenia, Emerita, Melanoides, Podisus, Trichogramma, Trichogrammatoidea.
Abstract The aim of the current research was to evaluate cartap ( Bala® 50 SP ) ecotoxicity on eight non target animal organisms: 1) Melanoides tuberculata ( Müller, 1774 ) ( Mollusca ) , 2) Emerita analoga ( Stimpson, 1857 ) ( Crustacea ) , 3) Chironomus calligraphus Goeldi, 1805 ( Diptera ) , 4) Cyprinus carpio ( Linné, 1758 ) ( Osteichthyies ) , 5) Eisenia foetida ( Savigny, 1826 ) ( Annelida ) , 6) Podisus nigrispinus ( Dallas, 1851 ) (Hemiptera ) , 7) Trichogramma fuentesi Torre, 1980 ( Hymenoptera ) and 8) Trichogrammatoidea bactrae Nagaraja. 1979 ( Hymenoptera ) , and to evaluate selectivity of this insecticide. Acute toxicity parameters were mean lethal concentration ( LC50 ) ( mg o μg L-1 ) , mean lethal dose (LD50) ( mg o μg kg-1 ) and mean lethal time ( TL50 ) ( h ) . The sequence of sensibility to cartap in the aquatic environment in terms of LC50 at 24 h exposure was: E. analoga > C. carpio > Ch. calligraphus > M. tuberculata. For E. foetida, with higher cartap soil doses mortality was increased, and from 257 mg AI of cartap kg-1 onwards, diminishing wet weights were observed. In P. nigrispinus nymphs II, contact effects produced higher mortality than immersion effects. T. bactrae showed higher egg emergence sensibility than T. fuentesi. Cartap showed selectivity on seven of the eight species analyzed. Only E. analoga showed risks at the aquatic environmental level.
Key words: ecotoxicology, bioassays, Cyprinus, Chironomus, Eisenia, Emerita, Melanoides, Podisus,, Trichogramma, Trichogrammatoidea.
Introducción
Los organismos no destinatarios del control químico pueden servir para determinar si existen secuelas negativas del uso de plaguicidas en el ambiente ( Vargas & Ubillo, 2001 ) . Se han desarrollado diferentes protocolos de bioensayos para determinar el efecto de plaguicidas sobre distintos componentes biológicos ( Calow, 1993; Vega et al., 1999; Werner et al., 2000 ) . Los parámetros de toxicidad aguda más comúnmente empleados son la concentración letal media ( CL50 ) ( mg o μg L-1 ) , la dosis letal media ( DL50 ) ( mg o μg kg-1 ) y el tiempo letal medio ( TL50 ) ( h ) .
El caracol dulceacuícola Melanoides tuberculata ( Müller, 1774 ) ( Prosobranchia: Thiaridae ) originario del Asia, es una especie dioica, y con dimorfismo sexual caracterizado por el mayor tamaño del macho. Presenta viviparismo y una reproducción rápida. Su hábitat son las lagunas fangosas y pedregosas. Se alimenta de microalgas y plantas, y en algunos casos requiere detritus. Puede resistir altas fluctuaciones de alcalinidad del agua. En el Perú, se ha empleado esta especie como herramienta ecotoxicológica para evaluar detergentes domésticos ( Alquil Aril sulfonato de sodio lineal = LAS ) ( Iannacone & Alvariño, 2002 b ) .
Emerita analoga ( Stimpson, 1857 ) ( Decapoda: Hippidae ) muy muy es un crustáceo macrozoobentónico característico del intermareal e infralitoral arenoso de las Costas del Pacífico Sur de América, a la vez que es un componente importante en las tramas tróficas de este sistema. Pese a su gran importancia pocos son los estudios tendientes a conocer aspectos de su ecología. E. analoga ha sido empleada como especie bioindicadora de importancia ecotoxicológica para el monitoreo de algunos metales pesados, de efluentes pesqueros y de ficotoxinas en el ecosistema marino ( Iannacone & Alvariño, 2003 ) . Chironomus calligraphus Goeldi, 1805 ( Diptera: Chironomidae ) es una especie de distribución predominantemente neotropical, que también se presenta en la región neártica, muy común en los ambientes acuáticos epicontinentales de la ciudad de Lima, Perú. Esta especie ha demostrado una alta sensibilidad a metales pesados y plaguicidas ( Iannacone & Alvariño, 2004a ) .
La carpa, Cyprinus carpio ( Linné 1758 ) ( Teleostei: Cyprinidae ) , un pez originario de China, típico de embalses y lagos de tierras bajas; es decir de aguas calmadas o de débil corriente, cálidas y de fondos fangosos. Es capaz de soportar bajas concentraciones de oxigeno ( 0.5 mL L-1 ) , temperaturas muy altas, ambientes ricos en vegetación y con contaminación orgánica significativa. Es un pez omnívoro bien valorado por los pescadores por las grandes tallas que alcanza y por ser de crecimiento rápido. Hay multitud de variedades de colores diversos, apreciadas como peces ornamentales para estanques y grandes acuarios. La carpa ha sido empleado como bioindicador de contaminación por metales pesados y pesticidas ( Dautremepuits et al., 2004; Drastichova et al., 2004; Satyanarayan et al., 2004 ) .
Las lombrices de tierra ( Oligoquetos ) , han sido utilizadas en bioensayos ecotoxicológicos para evaluar metales pesados ( Conder & Lanno, 2000; Dallinger et al. 2000; Oste et al., 2001 ) , plaguicidas ( Helling et al., 2000; Vermeulen et al., 2001; Iannacone & Alvariño 2004 b ) y además, como organismos centinelas ( Scott-Fordsmand & Weeks, 2000; Beeby, 2001 ) . Los oligoquetos lumbrícidos Eisenia foetida ( Savigny, 1826 ) y Eisenia andrei ( Bouché, 1972 ) han sido empleadas en bioensayos ecotoxicológicos ( Calow, 1993; Robidoux et al.,1999; Fisher et al., 2001 ) , debido a que son fáciles de cultivar en el laboratorio, presentan tiempos generacionales relativamente más cortos que otros oligoquetos, utilizan menores volúmenes de suelo en la cría y en el laboratorio y son ecológicamente más representativos en el ambiente terrestre ( Van Gestel et al., 1988; Keddy et al., 1995; OECD, 2000; Robidoux et al., 2001 ) . E. foetida es un oligoqueto que ha demostrado ser adecuado para la evaluación de la toxicidad de plaguicidas empleando los criterios de la OECD ( 1984, 2000 ) y las recomendaciones de Calow ( 1993 ) . E. foetida es una especie clave en el ecosistema terrestre, esta es una de las razones por las que estas lombrices de tierra han sido propuestas extensivamente en estudios ecotoxicológicos ( Scott- Fordsmand & Weeks, 2000 ) . Por este motivo, en años recientes se han usado otras respuestas biológicas (biomarcadores ) , como la alteración del ADN, inducción de proteínas ligantes a metales, inhibición de la actividad enzimática, estabilidad de la membrana liposomal, respuestas inmunológicas, cambios en el conteo espermático, entre otras ( Dallinger et al., 2000; Scott- Fordsmand & Weeks, 2000 ) .
Podisus nigrispinus ( Dallas, 1851 ) ( Heteroptera: Pentatomidae ) es un chinche, que en todos sus estados de vida es depredador de larvas de lepidópteros u otras presas ocasionales. Se han evaluado algunos parámetros ecológicos como la temperatura y requerimientos nutricionales en P. nigrispinus ( Mohaghegh et al., 1999; Oliveira et al., 2002; Vivan et al., 2002; Medeiros et al., 2003; Evangelista et al., 2004 ) . Esta especie, es muy voráz en el tercer estadío ninfal ( Tillman & Mullinix, 2004 ) . Se ha determinado la susceptibilidad a insecticidas en formas adultas e inmaduras de P. nigrispinus ( Zacarias et al., 1998; Evangelista et al., 2002; Torres et al., 2002, 2003 ) .
Las especies de Trichogramma Westwood, 1833 ( Hymenoptera: Trichogrammatidae ) contribuyen al control de huevos de plagas de lepidópteros de importancia agrícola ( Castro et al., 1997; Velasquez & Terán, 2003 ) . Trichogramma fuentesi Torre, 1980 y Trichogrammatoidea bactrae Nagaraja, 1979 son especies consideradas eficientes controladores de huevos de varias especies de lepidópteros considerados plagas agrícolas ( Whu, 1985; Fuentes, 1994; Whu & Valdivieso, 1999 ) . T. fuentesi se le ha encontrado parasitando a Helicoverpa zea ( Boddie 1850 ) ( Noctuidae ) , a Spodoptera frugiperda ( Smith, 1797 ) ( Noctuidae ) en el cultivo de maíz, a Diatraea saccharalis ( Fabricius, 1794 ) ( Pyralidae ) en el cultivo de caña de azúcar, a Heliothis virescens ( Fabricius, 1977 ) ( Noctuidae ) y a Anomis texana Riley, 1885 ( Noctuidae ) en el cultivo de algodón ( Querino & Zucchi, 2003; Velásquez & Terán, 2003 ). La avispita T. bactrae, ha sido introducida de los campos algodoneros de Australia al Perú, y ataca al gusano rosado del algodón Pectinophora gossypiella ( Saunders, 1844 ) ( Gelechiidae ) en la costa peruana, así como una gran variedad de huevos de insectos perjudiciales, especialmente microlepidóptera de la familia Gelechiidae, Pyralidae, Olethreutidae y Noctuidae, en los cultivos de arroz, algodón, caña de azúcar, frutales, hortalizas y maíz ( Malik, 2001 a b ) . Estos parasitoides son de fácil reproducción y son una herramienta en el control biológico de plagas ( Reddy & Guerrero, 2001 ).
El hidrocloruro de cartap, es un insecticida análogo sintético de una forma de oxidación de la nereistoxina ( NTX ) y es un bloqueador de canales iónicos de receptores de acetilcolina nicotínico ( Nagata et al., 1999; Lee et al., 2003; Liao et al., 2003; Delpech et al., 2003; Choi et al., 2004; Lee et al., 2004 ) . El cartap es un plaguicida carbámico usado a nivel mundial en el control de plagas agrícolas como la polilla minadora del tomate Tuta absoluta ( Meyrick, 1917 ) ( Lepidoptera: Gelechiidae ) ( Bezerril et al., 1992; Picanço et al., 1998; Reis & Souza, 1998 ) , la polilla minadora de los cítricos Phyllocnistis citrella Stainton, 1856 ( Lepidoptera: Gracillariidae ) ( Rae et al., 1996 ) , la polilla de la col Plutella xylostella ( Linnaeus, 1758 ) ( Lepidoptera: Plutellidae ) ( Reddy & Guerrero, 2001; Mohan & Gujar, 2003; Ninsin, 2004 ) y la polilla de la papa Phthorimaea operculella (Zeller, 1873 ) ( Lepidoptera: Gelechiidae ) ( Iannacone & Lamas, 2003 a ) . Además se ha utilizado como molusquicida sobre el gasterópodo dulceacuícola Oncomelania hupensis Gredler, 1881 para el control del hospedero intermediario de Schistosoma japonicum ( Katsurada, 1904 ) (Digenea: Schistosomatidae ) ( Xia et al., 1992 ) . En el Perú, el cartap se usa en diversos cultivos agrícolas de la costa peruana como el tomate, la papa, el maíz, hortalizas y frutales.
El cartap presenta alta toxicidad en el ambiente acuático, debido a que es empleado como un molusquicida contra caracoles de agua dulce. Los caracoles de agua dulce Physa acuta Draparnaud, 1805, Cipangopaludina malleata ( Reeve, 1863 ) e Indoplanorbis exustus ( Deshayes, 1832 ) mostraron una alta contracción corporal como un efecto subagudo y posteriormente altas mortalidades después de 72 a 96 h de exposición bajo la acción de cartap, en la revisión de Xia et al. ( 1992 ) . Moina macrocopa ( Straus, 1820 ) ( Crustacea: Cladocera ) resultó ser altamente sensible a cartap ( Iannacone & Alvariño, 2002 a ) . Toia et al. ( 1981 ) , Komala ( 1982, 1985 ) , encontraron una alta toxicidad del cartap a diferentes organismos acuáticos como los peces Salmo trutta Linnaeus, 1758, C. carpio, Poecilia reticulata ( Peters, 1859 ) , la pulga del agua Daphnia magna Straus, 1820, el mosquito Aedes aegypti ( Linnaeus, 1762 ) , plantas acuáticas como Azolla spp. y el protozoo Paramecium primaurelia Linnaeus, 1758. Sin embargo, los estudios de destino ambiental de cartap señalan una alta biodegradabilidad en ambientes acuáticos ( Komala, 1995 ) . Scott et al. ( 1991 ) y Geden et al. ( 1992 ) señalaron en un ensayo comparativo de insecticidas sobre Muscidifurax raptor Girault & Sanders, 1910, una especie congenérica de Muscidifurax raptorellus Kogan & Legner, 1976 ( Hymenoptera: Pteromalidae ) , una mayor sensibilidad en comparación con su plaga hospedera M. domestica. Los estudios con parasitoides sobre plagas de importancia económica son escasos, y aquellos con depredadores muestran resultados variables con relación a la toxicidad del cartap. Así, el escarabajo depredador Curinus coeruleus ( Mulsant, 1850 ) (Coleoptera: Coccinellidae ) y la microavispa parasitoide Trichogramma dendrolimi Matsumura, 1925 ( Hymenoptera: Trichogrammatidae ) fueron altamente sensibles ( Diraviam & Viraktamath, 1993; Takada et al., 2001 ) , en cambio el ácaro depredador Phytoseiulus persimilis Athias-Henriot, 1957 (Acarina: Phytoseidae ) fue poco sensible ( Blümel et al., 1993 ) .
Cartap mostró una alta degradabilidad aeróbica y anaeróbica bacteriana y fúngica en el suelo ( Endo et al., 1982 ) . Para Porcellio laevis Latreille, 1804 ( Crustacea: Isopoda ) , se encontró, un impacto leve y moderadamente tóxico de cartap ( Iannacone & Alvariño, 2002 a ) .
Aunque los ensayos crónicos para un plaguicida son muy importantes en la evaluación de Evaluación de Riesgos Ambientales ( ERA ) , Danfa et al. (1998) señalaron para la microavispa parasitoide Bracon hebetor ( Say, 1836 ) , que la mortalidad aguda es un buen parámetro predictivo y sensible para la determinación de la toxicidad, y por ende de la ERA. La mortalidad es un parámetro ecotoxicológico de gran importancia para determinar la selectividad del cartap ( Iannacone & Alvariño, 2002a ) .
En el Perú, Iannacone & Alvariño ( 2002a ) evaluaron el riesgo ambiental del cartap en bioensayos con tres invertebrados: M. macrocopa, P. laevis y M. raptorellus. Se ha determinado la selectividad del cartap empleando al depredador Chrysoperla externa ( Hagen, 1861 ) y a los parasitoides Trichogramma pintoi Voegelé, 1982, Copidosoma koehleri Blanchard, 1940 y Dolichogenidea gelechiidivoris ( Marsh, 1979 ) ( Iannacone & Lamas, 2002, 2003 b ) . Sin embargo, se requiere un mayor número de especies de diferentes nichos ecológicos para determinar adecuadamente la selectividad del cartap. El objetivo del presente trabajo fue evaluar la ecotoxicidad del cartap sobre ocho organismos no destinatarios de la biota animal:
1) el caracol de agua dulce M. tuberculata, 2) el muy muy E. analoga, 3) el insecto Ch. calligraphus, 4) el pez C. carpio, 5) la lombriz de tierra E. foetida, 6) el insecto depredador P. nigrispinus, y las microavispas 7) T. fuentesi y 8) T. bactrae, y a partir de estos resultados evaluar la selectividad de este insecticida.
Materiales y Métodos
Los bioensayos con el cartap se realizaron en el Laboratorio de Ecofisiología Animal de la Facultad de Ciencias Naturales y Matemáticas de la Universidad Nacional Federico Villarreal ( FCCNM, UNFV ) , Lima, Perú.
Organismos no destinatarios Ambiente acuático
Melanoides tuberculata
Se colectaron con la ayuda de un cucharón de las orillas arenosas de los humedales de las Lagunas artificial de La Molina ( 15° 5´LS; 75° 57´LO ) , Lima, Perú. Esta especie se distribuye en humedales dulceacuícolas naturales y artificiales de la costa central del Perú, cercanos a campos agrícolas. Posteriormente fueron trasladados al laboratorio en recipientes plásticos de 4000 ml, con sustrato en el fondo. Los caracoles fueron criados en acuarios de vidrio de 30 cm x 20 cm x 20 cm de capacidad y aclimatados por una semana previa al bioensayo empleando agua filtrada a 0.54 u de abertura procedentes de la laguna de colecta y agua de grifo hervida fría ( 1:1 v/v ) según recomendación de Calow ( 1993 ) . La longitud total promedio de M. tuberculata empleada en los ensayos ecotoxicológicos fue de 7 a 9 mm ( Iannacone & Alvariño, 2002b ) . Las pruebas estuvieron compuestas de un control y cinco concentraciones de Ingrediente Activo ( IA ) del cartap. Las concentraciones empleadas de IA de cartap fueron en orden creciente: 0.5 mg L-1; 2.5 mg L-1; 5 mg L-1; 25 mg L-1 y 50 mg L-1. En cada envase de 250 ml de capacidad se emplearon 10 individuos de M. tuberculata que se distribuyeron al azar en cada una de las cuatro repeticiones. Las lecturas se realizaron a las 12 h, 24 h, 36 h y 48 h de exposición. Al inicio del ensayo se ajustó a un pH de 5.0 y de 7.0 con una solución de HCl 1M o H2SO4 1N. Las cinco concentraciones siguieron un incremento alternado de x 5 y x 2. Para la discriminación de la mortalidad se usó el criterio propuesto por Iannacone & Alvariño ( 2002 b ) . Se consideró muerto el individuo incapaz de realizar algún tipo de movimiento en la placa de recuento, como mover el pie, la concha ó los tentáculos cefálicos durante 15 s de observación al estereoscopio. La temperatura se mantuvo en una incubadora fluctuante entre 18 °C ± 2 °C.
Emerita analoga
Esta especie se localiza en las orillas arenosas de la costa peruana bajo la acción de la ecorregión del mar frío de la corriente peruana. Se procedió a la colección y cría estandarizada de E. analoga. Cuarenta hembras de E. analoga con presencia de masas ovígeras fueron colectadas de una playa arenosa adjunta al Terminal Pesquero de Chorrillos de Lima, Perú. Posteriormente fueron trasladados al Laboratorio en recipientes plásticos de 2000 ml, con arena en el fondo. Los muy muy hembras fueron criados en acuarios de vidrio de 30 cm x 20 cm x 20 cm de capacidad y aclimatados por una semana previa al bioensayo empleando agua de mar filtrada a 0.54 u de abertura procedentes del lugar de colecta y arena ( 4:1 v/p ) según recomendación de Calow ( 1993 ) . Los ensayos ecotoxicológicos con E. analoga se iniciaron con larvas o zoeas de primer estadio dentro de 24 h de haber eclosionado de las masas ovígeras. Diez larvas de primer estadio se distribuyeron al azar en cada una de las cinco concentraciones más el control evaluadas en cada una de las cuatro repeticiones del ensayo experimental. Las concentraciones empleadas de IA de cartap fueron en orden creciente: 0,01 ug L-1; 0,1 ug L-1; 1 ug L-1; 10 ug L-1 y 100 ug L-1. Las cinco concentraciones siguieron un incremento de x 10. Las larvas se consideraron muertas si no fueron capaces de moverse coordinada y normalmente cuando fueron pinchadas ligeramente con un alfiler luego de 24 h y 48 h de exposición. Se emplearon un total de 240 larvas por ensayo. El bioensayo estático se realizó en envases plásticos de 0.5 l. La temperatura se mantuvo en una incubadora fluctuante entre 20 °C ± 2 °C ( Iannacone & Alvariño, 2003 ) .
Chironomus calligraphus
Esta especie se localiza en humedales naturales o artificiales costeros dulceacuícolas peruanos ( Iannacone et al., 2002 ) . El procedimiento de colección, identificación y cría estandarizada de C. calligraphus, así como el protocolo de bioensayo siguió el procedimiento detallado descrito por Iannacone et al. ( 2002 ) . Las concentraciones empleadas de IA de cartap fueron en orden creciente: 0.01 ug L-1; 0.1 mg L-1; 1 ug L-1; 10 ug L-1 y 100 ug L- 1. Las cinco concentraciones siguieron un incremento de x 10. Las lecturas se realizaron a las 24 h y 48 h de exposición. La temperatura se mantuvo regulada a 20°C ± 3 °C.
Cyprinus carpio
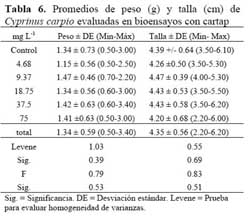
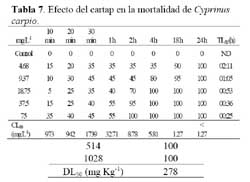
Esta especie ha sido introducida en ambientes naturales o artificiales costeros dulceacuícolas peruanos. Los especimenes de C. carpio fueron obtenidos de un cultivo del Laboratorio de Acuicultura de la Facultad de Oceanografia, Pesquería y Ciencias Alimentarias ( FOPCA ) , UNFV de Santa Eulalia, Lima, Perú. Se trasladaron al Laboratorio en baldes de plástico de 4 l de capacidad. Antes de la aclimatación en el laboratorio se descartaron los individuos que hubieran sufrido daño mecánico durante el transporte. Los adultos fueron colocados dos semanas previas a las pruebas ecotoxicológicas, en dos acuarios de vidrio de 90 cm x 40 cm x 30 cm, en un medio a base de una solución amortiguadora ( buffer- fosfato ) con agua destilada y agua de grifo reposada en igual cantidad ( 3 l de cada una ) . Se introdujeron ad libitum en el acuario plantas acuáticas para evitar el estrés de los peces ( Elodea sp. ) y fueron alimentados ad libitum con hojuelas para peces ( Tetramin® ) . Las carpas usadas en los bioensayos se extrajeron del cultivo a partir de la segunda semana de aclimatación. Los peces seleccionados presentaron una apariencia saludable para su uso en los ensayos ecotoxicológicos. Los peces empleados en los bioensayos presentaron un peso de 1.34 ± 0.59 g y una longitud estándar de 4.35 ± 0.56. Las pruebas de toxicidad se realizaron con cinco réplicas y cinco concentraciones más el control. Las concentraciones empleadas de IA de cartap fueron en orden creciente: 4,68 mg L-1; 9,37 mg L-1; 18,75 mg L-1; 37,5 mg L-1 y 75 mg L-1. Las cinco concentraciones siguieron un incremento de x 2. Las lecturas de la pruebas ecotoxicológicas se realizaron a los 10 min; 20 min; 30 min; 1; 2; 4; 18; 24 h de exposición. Los peces no se alimentaron durante el ensayo. Se usaron 120 peces por cada prueba de ecotoxicidad. Cada grupo de cuatro peces se colocó al azar en un recipiente de plástico con una capacidad de 250 ml. Se utilizó la mortalidad como punto final de lectura. La temperatura bajo el cual fue realizado el bioensayo fue de 20 ± 2°C.
Ambiente terrestre
Eisenia foetida
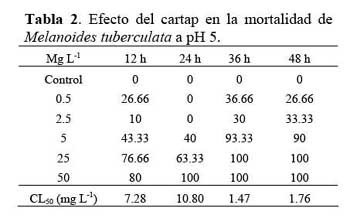
Las formas adultas del oligoqueto, E. foetida, se obtuvieron de cultivos masivos procedentes del área de Lombricultura de la Universidad Nacional Agraria La Molina ( UNALM ) – Lima-Perú, en un sustrato de compostaje al 100 %. La especie fue identificada a nivel del estadío adulto usando las características morfológicas específicas. E. foetida fue criada masivamente en el laboratorio de Ecofisiología Animal de la FCCNM-UNFV en lechos plásticos de 4000 ml de capacidad en un medio formado por tierra obtenida de los jardines de la FCCNM-UNFV previamente cernida usando una malla con diámetro de 2.5 mm. La aclimatación de E. foetida se realizó durante 14 d, con el fin de obtener individuos de una talla determinada fluctuante entre 4 ± 1 cm de longitud, bajo una temperatura de laboratorio de 20°C ± 2°C y 30 % de humedad relativa. Las pruebas ecotoxicológicas con los oligoquetos se realizaron con cohortes de 160 especímenes de E. foetida de 4 ± 1 cm de longitud que se obtuvieron del envase de cultivo masivo, sin considerar el grado de maduración. Al inicio del bioensayo, las lombrices fueron colocadas en envases de plástico de un litro de capacidad y de 12 cm de alto, con cuatro divisiones. Cada división se usó para una lombriz. Los bioensayos se realizaron bajo condiciones de oscuridad para evitar el efecto de fotólisis. Las lombrices fueron lavadas en agua destilada y luego secadas en papel absorbente para eliminar el exceso de agua durante la lectura. Se empleó aproximadamente 600 g de suelo como sustrato en ensayos estáticos a 7 d de exposición. El análisis granulométrico del suelo se presenta en la Tabla 1, indicando un suelo de tipo predominantemente arenoso. El pH del suelo empleando una solución amortiguadora de cloruro de potasio ( 1M ) y con cloruro de calcio ( 0.01M ) fue de 7.9. Los ensayos fueron considerados válidos cuando la mortalidad de E. foetida no sobrepasó al 10 %. El indicador de la prueba aguda fue la mortalidad de los especímenes que al ser pinchados con un alfiler entomológico, durante 10 s de observación no realizaron ningún movimiento coordinado. Debido a que las lombrices tienden a desintegrarse rápidamente después de la muerte, las lombrices ausentes se consideraron que habían muerto ( Maboeta et al., 2004 ) . Para la prueba subaguda, se evaluó la variación del peso húmedo (en %) a 7 d de exposición, el cual se determinó con una aproximación de 0.01 mg en una balanza semianalítica. Las siete dosis empleadas de IA de cartap fueron en orden creciente: 16.06 mg kg-1; 32.12 mg kg-1; 64.24 mg kg-1; 128.5 mg kg-1; 257 mg kg-1; 514 mg kg-1 y 1028 mg L-1. Las siete dosis siguieron un incremento de x 2. Los bioensayos se realizaron bajo condiciones no controladas de temperatura, pero aproximadamente a 20 °C ± 2 ºC.
Ambiente aéreo
Podisus nigrispinus
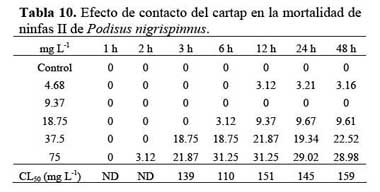
Los huevos ( < de 48 h de edad ) se obtuvieron de cultivos estandarizados del Programa Nacional de Control Biológico, Servicio Nacional de Sanidad Agraria ( PNCB-SENASA ) , a partir de los cuales se realizaron las crianzas masivas en condiciones de laboratorio, con el fin de obtener ninfas de II estadío para los bioensayos de susceptibilidad. Las ninfas de primer estadío recién emergidas ( < 24h ) , se aclimataron masivamente en el laboratorio en envases cuadrangulares de plástico de 12 cm x 30 cm x 20 cm. Estas ninfas se alimentaron con larvas de Spodoptera eridania ( Stoll, 1782 ) ( Lepidoptera: Noctuidae ) , obtenidos del PNCB-SENASA. La crianza se llevó a cabo bajo condiciones no controladas de temperatura y humedad relativa. Sin embargo la temperatura fluctuó entre 21 y 27 °C ( Promedio = 24 °C ) y la humedad relativa entre 65 % y 90 %. La crianza se realizó bajo un fotoperiodo 13:11 ( L:O ) . Para los bioensayos, fueron empleadas ninfas de II < de 48 h debido a que es considerado un estadio altamente susceptible a la acción de plaguicidas ( Evangelista et al., 2002 ) . Las ninfas fueron criadas individualmente en envases de plástico de 25 ml de capacidad y alimentadas ad libitum con larvas de S. eridania. Las pruebas de sensibilidad se realizaron bajo condiciones de oscuridad, para evitar el efecto de fotólisis. Los indicadores para las pruebas fueron, la mortalidad, considerada como la inmobilización de los especímenes y la desadherencia a la superficie interna del vial de vidrio al ser pinchados con un alfiler entomológico, durante 15 s de observación bajo la acción del microscopio estereoscopio de 10X. Las concentraciones empleadas de Ingrediente Activo ( IA ) de cartap fueron en orden creciente: 4.68 mg L-1; 9.37 mg L-1; 18.75 mg L-1; 37.5 mg L-1 y 75 mg L-1. Las cinco concentraciones siguieron un incremento de x 2. Se trataron 16 ninfas por cada concentración ( 4 especímenes / repetición ) . Después de las aplicaciones, los envases se mantuvieron cerrados en oscuridad bajo condiciones de cría, realizándose las lecturas a 1 h, 2 h, 3 h, 6 h, 12 h, 24 h y 48 h de exposición. Las ninfas se consideraron vivas si realizan algún tipo de movimiento coordinado y adherencia con las patas a la superficie interna del vial de vidrio durante 15 s de observación al microscopio estereoscopio a 10 de aumento, con la ayuda de un alfiler entomológico.
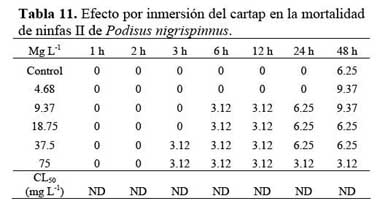
Ecotoxicidad por inmersión.
Se realizaron las aplicaciones en ninfas de P. nigrispinus por inmersión durante 5 s en placas de petri, en las diluciones de la sustancia y en agua destilada. Después de la inmersión, las ninfas fueron colocadas en papel Tissue® por 10 min para absorber lo restante de las soluciones acuosas y permitir el secado ambiental.
Ecotoxicidad por contacto.
Estos ensayos se llevaron a cabo para las ninfas de segundo estadio, alimentadas previamente con larvas de S. eridania. El cartap disuelto en agua destilada se aplicó en viales de vidrio ( 25 uL por cada vial de vidrio grande ) . En cada vial de vidrio se esparció homogéneamente en sus paredes y base, con la ayuda de un hisopo de base de madera, los uL determinados de la sustancia química colocada en su interior y posteriormente se permitió el secado de los viales a temperatura ambiente durante 2 h con sus respectivos tapones de algodón.
Trichogramma fuentesi y Trichogrammatoidea bactrae
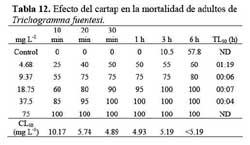
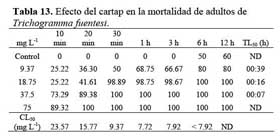
Las formas adultas ( hembras y machos ) de T. fuentesi y T. bactrae se obtuvieron a partir de crías estandarizadas del Programa Nacional de Control Biológico ( PNCB ) -SENASA. Los criterios de selección de ambas especies fueron la disponibilidad de material biológico bajo cría estandarizada y su representatividad como parasitoides en cultivos donde se aplica el cartap. La especie se determinó a nivel del estado adulto usando las claves de Pinto et al. ( 1983 ) . La crianza siguió las recomendaciones de Fuentes ( 1994 ) , utilizando como hospedero a S. cerealella. Se aplicó el ensayo de toxicidad por contacto para las microavispas adultas solo para T. fuentesi y el de aplicaciones por inmersión para los huevos parasitados de S. cerealella para ambas especies. Se aplicaron las siguientes concentraciones crecientes del cartap en agua destilada en mg ( IA ) L-1: 4.68; 9.37; 18.75; 37.5 y 75. Las cinco concentraciones siguieron un incremento de x 2. La temperatura ambiental de los ensayos fueron de 20 ± 2°C.
Toxicidad por inmersión:
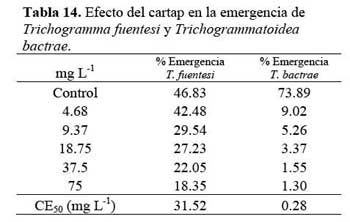
Se efectuó las aplicaciones tópicas por inmersión usando huevos de S. cerealella parasitados por T. fuentesi y T. bactrae, adheridos a pequeños cuadrados de cartulina de 6 mm x 6 mm, siguiendo las recomendaciones de Brunner et al. ( 2001 ) . Después de la inmersión, fueron colocados en papel Tissue® por 10 min para absorber lo restante de las soluciones acuosas, permitiendo el secado ambiental por 1 h. Esto está en conformidad con el procedimiento de la Organización Internacional en Control Biológico e Integrado ( IOBC ) ( Hassan, 1992 ) . Se trataron huevos ( 1 cuadrado de cartulina /repetición ) . Los huevos fueron aislados en viales de vidrios grandes ( Iannacone & Lamas, 2003 b ) . Los viales fueron dispuestos en posición horizontal en una caja de plástico ( Danfa et al., 1998 ) . Después de las aplicaciones tópicas, los viales se mantuvieron tapados en oscuridad bajo condiciones de cría, realizándose las lecturas hasta la eclosión de los adultos de los huevos. El porcentaje de emergencia de adultos de T. fuentesi y T. bactrae se calculó contando el número de huevos que tenían al menos un orificio de emergencia de adultos, dividiéndolo entre el número total de huevos parasitados y multiplicándolo por 100.
Toxicidad por contacto:
Estos ensayos se llevaron a cabo para los adultos de T. fuentesi. Las pruebas toxicológicas se realizaron con cohortes de hembras y machos colocados al azar y menos de 24 h de emergidos de los huevos de S. cerealella. Los bioensayos se efectuaron bajo condiciones de oscuridad. Las lecturas se hicieron en viales tapados con una torunda de algodón en ensayos estáticos. El indicador de la prueba de mortalidad fue la inmobilización de los especímenes, durante 10 s de observación bajo el microscopio estereoscopio ( Danfa et al., 1998; Brunner et al., 2001 ) . Los adultos no se alimentaron antes de los bioensayos toxicológicos. El cartap y el agua destilada se aplicaron en viales de vidrio esparciendo 25 uL por viales. Sin embargo, este protocolo no previene que los insectos se adhieran a la superficie no tratada ( torunda de algodón ) ( Danfa et al., 1998 ) . Posteriormente se permitió el secado de los viales a temperatura ambiente durante 2 h con sus respectivos tapones o torundas de algodón. Para cada una de las pruebas se utilizó 120 individuos, los cuales se consideraron muertos cuando no se posaron sobre el vial de vidrio y se encontraron en el fondo del recipiente con las patas dirigidas hacia arriba, durante 10 s de observación al microscopio estereoscopio. El tratamiento control consistió en agua destilada. Se utilizaron cuatro repeticiones ( 1 vial = 1 repetición ) por tratamiento. Se condujeron ensayos de toxicidad aguda estáticos de residuos en oscuridad. Los viales se mantuvieron en condiciones de cría y se observaron la mortalidad acumulada a diferentes h de exposición: 10 min, 20 min, 30 min, 1 h, 3 h, 6h y 12 h ( Hassan, 1992 ) . Las lecturas se continuaron siempre y cuando la mortalidad en el control no fue mayor al 60 %, considerándose este valor alto debido a que las microavispas no se alimentaron durante el bioensayo. Se colocaron cinco adultos al azar por vial.
Cartap
El formulado utilizado fue Bala® 50 PS, con las siguientes propiedades fisicoquímicas del cartap: solubilidad en agua = 178 g L-1 a 20 °C y 200 g L-1 a 25 °C; punto de ebullición = 179–181 °C; tiempo de vida media en el agua = 10 min a pH 7 y 25 °C. Para los ensayos la sustancia química se disolvió al 1 % en agua destilada ( pH = 7.2; conductividad específica = 70 umhos cm-1 ) . En los ensayos se aplicaron concentraciones de ingrediente activo ( IA ) en u ( m ) g L-1. Para el bioensayo con E. foetida, las mezclas de cartap con tierra emplearon la misma calidad de tierra usada para los cultivos, previamente fue cernida con el fin de obtener una textura uniforme. La dosis de aplicación de cartap para el control de plagas en agricultura es de 1000 mg IA L-1.
Diseño experimental y tratamiento estadístico
Las pruebas de toxicidad se realizaron empleando cinco concentraciones más el control, con cuatro repeticiones, en un diseño en bloque completamente aleatorio ( DBCA ) . Solo en el caso de E. foetida se usaron siete concentraciones. En todos los casos, la eficacia de los tratamientos y las repeticiones se evaluó a través de un análisis de varianza ( ANDEVA ) de dos vías, previa transformación de los datos a raíz cuadrada del arcoseno. La CL ( E ) 50, DL50 y TL50 se calcularon usando el programa computarizado Probit versión 1.5. El modelo de regresión fue verificado usando el estadístico Chi-cuadrado. Se empleó el paquete estadístico SPSS, versión 7.5 para Window 98 para el cálculo de los estadísticos descriptivos e inferenciales.
Selectividad
Se empleó esta técnica para determinar la naturaleza y magnitud de riesgo ambiental del cartap, empleando los escenarios más críticos y de mayor exposición, utilizando ocho organismos no destinarios: M. tuberculata, E. analoga, Ch. calligraphus y C. carpio para determinar el riesgo en organismos acuáticos; E. foetida como modelo biológico terrestre y P. nigrispinus, T. fuentesi y T. bactrae como artrópodos aéreos no objetivo del control químico. Con los resultados de toxicidad aguda ( CL50 o DL50 ) al máximo periodo de exposición con estas ocho especies y con los niveles de exposición o concentraciones ambientales esperadas predichas ( CEEs ) , calculados a partir de la dosis de aplicación media del cartap o su equivalente en mg L- 1, se determinaron los cuocientes de riesgo ( RQs ) . Para el cálculo de la CEE acuática se asumió una profundidad del cuerpo de agua de 30 cm y para la CEE terrestre una profundidad y densidad del suelo de 15 cm y 1.5, respectivamente. Para las medidas de mitigación se consideró 0.1 % de depósito de cartap a una distancia de 30 m del cuerpo de agua. Estos resultados se compararán con el nivel crítico respectivo de 0.5 propuesto por la EPA para ensayos agudos con organismo no destinatarios y de 1 para ensayos subagudos.
Resultados
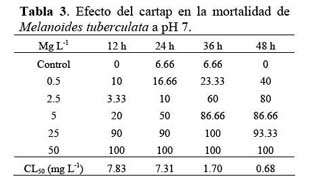
Ambiente acuático Se determinó el efecto toxicológico agudo del cartap a pH 5 y 7 sobre M. tuberculata ( Tablas 2 y 3 ) . La CL50 del cartap fluctuó entre 0.68 a 10.80 mg L-1 entre 12 h y 48 h de exposición. No encontrándose diferencias entre los valores de CL50 a ambos valores de pH (Tablas 2 y 3 ) . Se observó un incremento promedio en el valor de CL50 en 582 % entre las 24 h y las 36 h de exposición para ambos valores de pH ( Tablas 2 y 3 ) .
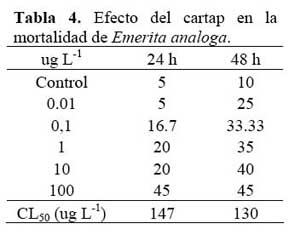
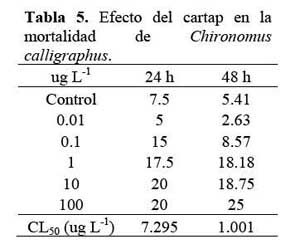
No se encontraron diferencias en los valores de CL50 del cartap sobre E. analoga a 24 h y 48 h de exposicion ( Tabla 4 ) . En cambio para Ch. calligraphus, se observo diferencias numericas en la CL50 entre 24 h y 48 h de expòsicion ( Tabla 5 )
El promedio del peso y la longitud estándar (talla) de C. carpio empleadas en los bioensayos con cartap no variaron entre las concentraciones evaluadas ( Tabla 6 ) . Los valores de CL50 de 10 min a 24 h de exposición decrecieron significativamente ( Tabla 7 ) . El TL50 fluctuó entre 25 min a 02h y 11 min para las concentraciones ensayadas ( Tabla 7 ) . La secuencia de especies de mayor a menor sensibilidad al cartap en el ambiente acuático en términos de CL50 a 24 h de exposición fue: E. analoga > C. carpio > Ch. calligraphus > M. tuberculata.
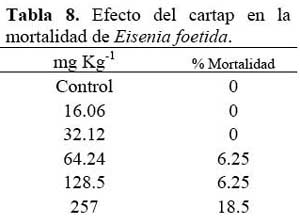
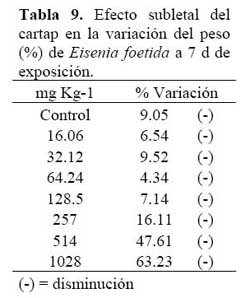
Ambiente terrestre Se encontró un incremento de la mortalidad de E. foetida con las dosis crecientes del cartap en el suelo ( Tabla 8 ) . Se observó a partir de 257 mg kg-1 de IA de cartap, una disminución significativa del peso húmedo en comparación con el control ( Tabla 8 ) .
Ambiente aéreo Al evaluar el efecto de contacto y de inmersión del cartap sobre las ninfas II de P. nigrispinus, se encontró que no existieron efectos de mortalidad en ambos casos hasta las 2 h de exposición ( Tablas 10 y 11 ) . En el caso del efecto de contacto, la CL50 varió entre 110 a 159 mg L-1 ( Tabla 10 ) . En cambio, a las cinco concentraciones evaluadas no existieron efectos de mortalidad significativos al compararse con el control para el bioensayo por inmersión con cartap sobre P. nigrispinus ( Tabla 11 ) . El efecto del contacto produjo mayor sensibilidad al cartap en términos de mortalidad que el efecto por inmersión ( Tablas 10 y 11 ) .
Los adultos de T. fuentesi entre 10 min a 6 h de exposición presentaron valores de CL50 entre < 5.19 y 23.57 mg L-1 ( Tablas 12 y 13 ) . El TL50 fluctuó entre 4 min a 01h 19 min para las concentraciones ensayadas ( Tabla 12 y 13 ) . Los valores de CE50 para la emergencia de T. fuentesi y T. bactrae de los huevos de S. cerealella fueron diferentes entre sí, siendo T. bactrae de mayor sensibilidad en términos de emergencia que T. fuentesi ( Tabla 14 ) . En todos los casos, los análisis estadísticos mostraron que no existieron diferencias significativas entre las cuatro repeticiones ( P > 0.05 ) .
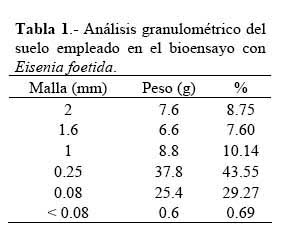
Selectividad La Tabla 15 muestra un resumen de la evaluación del riesgo ambiental ( ERA ) del cartap sobre ocho especies no destinatarias. Los resultados indicaron que el cartap no mostró riesgo ambiental sobre siete de las ocho especies analizadas. Solo E. analoga mostró un riegos a nivel del ambiente acuático, pues el riesgo fue alto en comparación con el nivel crítico. Solo al considerar un depósito del 0.1 %, tomando en cuenta el cuerpo de agua a una distancia de 30 m del campo agrícola de aplicación, el RQ fue de 0.02, y por ende esta sería una medida de mitigación muy adecuada, para disminuir el efecto del cartap en el ambiente acuático.
Discusión
El potencial de los organismos animales como bioindicadores en ensayos de toxicidad está ampliamente demostrado, la principal ventaja de emplearlos en investigación ecotoxicológica es la de mostrar los efectos del tóxico a nivel individual y sus consecuencias posteriores para niveles superiores de organización biológica, población y comunidad ( Alayo & Iannacone, 2002 ) .
Se requiere evaluar especies de diferentes nichos ecológicos para determinar adecuadamente la selectividad del cartap en el ambiente acuático, terrestre y aéreo ( Iannacone & Alvariño, 2002a ) . El cartap mostró selectividad sobre siete de las ocho especies analizadas pertenecientes a estas tres matrices ambientales. Solo el muy muy E. analoga, en la fase de zoea mostró riesgo a nivel del ambiente acuático, pues fue alto en comparación con el nivel crítico contrastado (Tabla 15) . Iannacone & Alvariño ( 2003 ) señalaron en una evaluación comparativa global que E. analoga es una especie adecuada para ser empleada en bioensayos ecotoxicológicos por su sensibilidad, facilidad de uso ( simplicidad en el manipuleo y disponibilidad de material biológico en el Perú ) y concordancia ecológica en el ambiente acuático marino. Muchos insecticidas son tóxicos para los crustáceos, lo que es comprensible dada la relación filogenético que existe entre insectos y crustáceos ( Ferrero et al., 2001 ) . No se ha encontrado bibliografía referente a la toxicidad del cartap sobre crustáceos marinos. Las diferencias de toxicidad entre las especies revelan interacciones en los insecticidas evaluados y los principales sistemas enzimáticos de detoxificación ( Ferrero et al., 2001 ) .
La baja sensibilidad del cartap encontrada sobre M. tuberculata en el presente estudio pudiera ser presumiblemente adscrita a diferencias en la bioquímica y fisiología de este caracol en comparación con otros organismos biológicos (Tabla 15) . Así como a su amplia valencia y plasticidad ecológica ( Iannacone & Alvariño, 2002b ) . El cartap presentó un bajo riesgo ambiental sobre el pez C. carpio como se ha observado en otros bioensayos ecotoxicológicos ( Iannacone & Alvariño, 2002a ) .
Rao & Kavitha ( 2004 ) observaron pérdidas de pigmentación en E. foetida expuestas a altas concentraciones del organofosforado monocrotofos. En el caso de las E. foetida expuestas al cartap, se ha observado pérdida de pigmentación sobre 64.24 mg IA kg-1 (Tabla 8) . Se han realizado ensayos ecotoxicológicos comparativos con E. foetida empleando papel filtro y suelo artificial, encontrándose resultados diferentes, siendo el suelo el que más se acerca a la realidad ecológica, aunque el empleo del papel filtro como sustrato permite evidenciar cambios patológicos más aparentes y reproducibles en E. foetida que el uso del suelo. En este estudio se empleó suelo como sustrato para el bioensayo. Giménez et al. ( 2004 ) indicaron que las lombrices presentan una variabilidad en la susceptibilidad a diferentes xenobióticos, según su origen y condiciones de vida, lo que demuestra la importancia de realizar experimentos con organismos locales. Sin embargo, se debe tener cuidado al interpretar los resultados de CL50 obtenidos en el Laboratorio empleando suelo y usando a E. foetida como organismo prueba, debido a que las pruebas de toxicidad con mortalidad como punto final pueden tener baja relevancia ecológica por la composición física del suelo ( textura, contenido de materia orgánica y algunos parámetros estacionales ) . Por ende, los cambios en la biomasa son ecológicamente más sensibles que el parámetro CL50 ( Moboeta et al., 2004 ) . En E. foetida expuesta al cartap, se ha encontrado sensibilidad similar entre ambos puntos finales de lectura (Tablas 8 y 9) .
En el caso de P. nigrispinus, Evangelista et al. ( 2002 ) encontraron que el lufenuron afecta a las ninfas de quinto estadio y adultos de este chiche por efectos de ingestión y residualidad. En contraste, Torres et al. ( 2002 ) al evaluar nueve plaguicidas agrícolas empleados en el cultivo de algodón, encontraron efectos selectivos de cuatro de ellos ( espinosad, pimetrozine, dicofol y propargite ) . Estos resultados evidencian la selectividad de estos cuatro plaguicidas sobre las ninfas de este predator y como productos agroquímicos en potencia en el MIP, al no causar mortalidad significativa y riesgo. En el presente caso, se observó muy poco efecto de riesgo del cartap sobre ninfas de II estadio de P. nigrispinus, tanto por contacto y por inmersión (Tabla 15) .
La sensibilidad a diferentes plaguicidas varía con las diferentes especies de Trichogramma evaluadas ( Thomson et al., 2000; Youssef et al., 2004 ) . Los organofosforados y los carbamatos en aplicaciones tópicas fueron altamente tóxicos para Trichogramma platneri Nagarkatti 1975. El Imidacloprid y la abamectina fueron altamente tóxicos cuando se aplicaron tópicamente, pero no fueron tóxicos en residuos de 1 h; en cambio los reguladores del crecimiento no causaron mortalidad, ni en aplicaciones tópicas, ni en residuos sobre T. platneri ( Brunner et al., 2001 ) . El organofosforado triclorfon, el organoclorado endosulfan y los piretroides deltametrina y lamdacihalotrina afectaron significativamente la emergencia de los adultos de Trichogramma cordubensis Vargas & Cabello, 1985 ( Vieira et al., 2001 ) . T. pintoi presentó un valor de CL50 a 6 h de exposición de 9.83 mg IA de cartap L-1 ( Iannacone & Lamas, 2003 b ) , el cual fue ligeramente mayor al del T. fuentesi de < 7.92 mg IA de cartap L-1 (Tablas 12 y 13) . Iannacone & Lamas ( 2003 b ) encontraron en T. pintoi a una concentración de 312.5 mg IA.de cartap L-1 un porcentaje de emergencia de 28.85 %, con menor efecto toxicológico que los resultados con T. fuentesi y T. bactrae a 75 mg IA de cartap L-1, que mostraron 18.35 % y 0.28 % de emergencia, respectivamente (Tabla 14) . El sustrato de aspersión empleado en los ensayos de toxicidad por contacto para plaguicidas, puede producir diferentes resultados. La toxicidad de cuatro fungicidas sobre Trichogramma cacoeciae Marchal, 1936 fue más tóxica al emplear el sustrato placas de vidrio en comparación a hojas de vid ( Hafez et al., 1999 ) . Este último sistema de bioensayo que usa hojas es más realista, ya que en la naturaleza la hoja es recorrida asiduamente por la microavispita, la cual inspecciona las hojas con sus antenas, lo cual posiblemente no ocurra sobre el sustrato vidrio. En adición, en las hojas, las proyecciones en pelos y otros pueden minimizar la exposición al producto. Sin embargo, debido a que las especies y variedades de las hojas de las plantas pueden ser sustratos muy variables; el bioensayo ha sido estandarizado por organismos internacionales empleando sustratos placas de vidrio, asumiendo el peor escenario de exposición ( Hafez et al., 1999) .
En el presente estudio el análisis ecotoxicológico de ocho especies animales con diferentes nichos ecológicos para determinar la selectividad del cartap, podría contribuir a tomar las medidas más apropiadas para su adecuado empleo en el MIP.
Agradecimiento
Al Blgo. Neil Salazar, a la Blga. Galia Manyari, a la Srta. Carmen Salcedo, a la Srta. Carmen Luna, al Sr. José Carlos Soto y al Sr. Jaime Mansilla por su apoyo en el manejo de las especies evaluadas en los bioensayos ecotoxicológicos. El presente trabajo fue expuesto en la XIV Reunión Científica del Instituto de Ciencias Biológicas de la Universidad Nacional Mayo de San Marcos, ICBAR-UNMSM, 27 al 29 de abril del 2005, Lima, Perú.
Literatura citada
Alayo M. & Iannacone J. 2002. Ensayos ecotoxicológicos con petroleo crudo, diesel 2 y Diesel 6 con dos subespecies de Brachionus plicatilis Müller 1786 ( Rotifera: Monogononta ) . Gayana. 66: 45-58.
Beeby A. 2001. What do sentinels stand for? Environmental Pollution. 112: 285-298.
Bezerril E.F., Carneiro J.D.S. & Torres-Filho J. 1992. Chemical control of the leafminer Scrobipalpula absoluta ( Meyrick, 1917 ) ( Lepidoptera: Gelechiidae ) in the Ibiapaba Plateau, Ceara. Annales of the Society Entomologica Brasileira. 21: 217-224.
Blümel S., Bakker F. & Grove A. 1993. Evaluation of differents methods to assess the side effects of pesticides on Phytoseiulus persimilis A-H. Experimental Applied Acarology. 17: 161-169.
Brunner J.F., Dunley J.E., Doerr M.D. & Beers E.H. 2001. Effect of pesticides on Colpoclypeus florus ( Hymenoptera: Eulophidae ) and Trichogramma platneri ( Hymenoptera: Trichogrammatidae ) , parasitoids of leafrollers in Washington. Journal of Economic Entomology. 94: 1075- 1084.
Calow P. 1993. Handbook of ecotoxicology. Vol. I. 478 p. Blackwell Science Ltd. Sheffield, UK.
Castro Z.J., Loayza C.F., Castro M.T., Meza P.M., Peña V.L. & Molinari N.E. 1997. Control integrado de plagas y producción de controladores biológicos en el Valle de Ica y el Callejón de Huaylas. Ed. CDEP/ RAAA. Lima- Perú.
Conder J.M. & Lanno R.P. 2000. Evaluation of surrogate measures of cadmium, lead, and zinc bioavailability to Eisenia foetida. Chemosphere. 41: 1659-1668.
Choi E., Cho I.H. & Park J. 2004. The effect of operational parameters on the photocatalytic degradation of pesticide. Journal of Environmental Science Health B. 39: 53-64.
Dallinger R., Berger B., Gruber C., Hunziker P. & Sturzenbaum S. 2000. Metallothioneins in terrestrial invertebrates: structural aspects, biological significance and implications for their use as biomarkers. Cell Molecular Biology. 46: 331-346.
Danfa A., Fall B. & Van Der Valk H. 1998. Acute toxicity tests with Bracon hebetor Say ( Hymenoptera: Braconidae ) , using different locust control insecticides in the sahel. Chapter 6. p. 117-136. In J.W. Everts, D. Mbaye, O. Barry, and W. Mullié ( eds. ) . Locustox project: Environmental side-effects of locust and grasshopper control. Vol. 3. Plant Protection Directorate, Ministry of Agriculture, Dakar, Senegal. Food and Agriculture Organization of the United- Nations, Rome, Italy.
Dautremepuits C., Betoulle S., Paris-Palacios S. & Vernet G. 2004. Immunology-related perturbations induced by copper and chitosan in carp ( Cyprinus carpio L. ) . Archives of Environmental Contamination and Toxicology. 47: 370-378.
Delpech V. R., Ihara M., Coddou C., Matsuda K. & Sattelle D. B. 2003. Action of nereistoxin on recombinant neuronal nicotinic acetylcholine receptors expressed in Xenopus laevis oocystes. Invertebrate Neuroscience 5: 29-35.
Diraviam J. & Viraktamath C.A. 1993. Toxicity of some insecticides to Curinius coeruleus Mulsant ( Coleoptera: Coccinellidae ) , an introduced predator of the subabul psyllid. Entomon. 18: 77-79.
Drastichova J., Svobodova Z., Luskova V. & Machova J. 2004. Effect of cadmium on hematological indices of common carp ( Cyprinus carpio L. ) . Bulletin of Environmental Contamination and Toxicology. 72: 725- 732.
Endo T., Kusaka T., Tan N. & Sakai M. 1982. Effect of the insecticide cartap hydrochloride on soil microflora. Journal of Pesticide Science. 7: 1-8.
Evangelista W.S. Jr., Silva-Torres C.S.A. & Torres J.B. 2002. Toxicidade de Lufenurom para Podisus nigrispinus ( Dallas ) ( Heteroptera: Pentatomidae ) . Neotropical Entomology. 31: 319-326.
Evangelista W.S.Jr., Gondim M.G.C. Jr., Torres J.B. & Marques E. J. 2004. Fitofagia de Podisus nigrispinus em algodoeiro e plantas daninhas. Pesquisas Agropecuarias brasileiras. 39: 413-420.
Ferrero A.A., Gutiérrez M.M. & Cervellini P.M. 2001. Evaluación en laboratorio de la toxicidad aguda de los insecticidas malation y deltametrina Chasmagnathus granulata Dana ( Crustacea: Brachyura: Grapsidae ) . Investigaciones Marinas ( Valparaiso ) . 29: 107-111.
Fisher E., Toth A. & Farkas S. 2001. Deltamethrin, effects on volumen control, and water balance in Eisenia foetida Sav. ( Annelida, Lumbricidae ) . Bulletin of Environmental Contamination and Toxicology. 66: 269- 276.
Fuentes F.S. 1994. Producción y uso de Trichogramma como regulador de plagas. Red de Acción en Alternativas al uso de Agroquímicos ( RAAA ) , Lima, Perú.
Geden C.K., Rutz D.A., Scott J.G. & Lomg S.J. 1992. Susceptibility of house flies ( Diptera: Muscidae ) and five pupal parasitoids ( Hymenoptera: Pteromalidae ) to abamectin and seven commercial insecticides. Journal of Economic Entomology. 85: 435- 440.
Giménez R., Penna A.D. & Odello E. 2004. Efectos tóxicos de los insecticidas clorpirifos y teflutrina sobre la lombriz de tierra ( Lumbricus terrestris L. ) . Agricultura Técnica ( Chile ) . 64: 347-352.
Hafez M.B., Schmitt A. & Hassan S.A. 1999. The sideeffects of plant extracts and metabolites of Reynoutria sachalinensis ( F. Schmidt ) Nakal and conventional fungicides on the beneficial organism Trichogramma cacoeciae Marchal ( Hym., Trichogrammatidae ) . Journal of Applied Entomology. 123: 363-368.
Hassan S.A. 1992. Guidelines for testing the effects of pesticides on beneficial organisms: description of test methods. IOBC/ WPRS Bulletin 1992/XV/3.
Helling B., Reinecke S.A. & Reinecke A.J. 2000. Effects of the fungicide copper oxychloride on the growth and reproduction of Eisenia foetida ( Oligochaeta ) . Ecotoxicology and Environmental Safety. 46: 108-116. Iannacone J. & Alvariño L. 2002 a. Evaluación del riesgo ambiental del insecticida cartap en bioensayos con tres invertebrados. Agricultura Técnica ( Chile ) . 62: 366-374.
Iannacone J. & Alvariño L. 2002 b. Efecto del detergente doméstico alquil aril sulfonato de sodio lineal ( LAS ) sobre la mortalidad de tres caracoles dulceacuícolas en el Perú. Ecología Aplicada. 1: 81-87.
Iannacone J. & Alvariño L. 2003. Efecto ecotoxicológico agudo del mercurio sobre larvas del muy muy Emerita analoga ( Stimpson ) ( decapada: Hippidae ) procedentes de cuatro localidades de Lima. Ecología Aplicada. 2: 111-115.
Iannacone J. & Alvariño L. 2004 a. Variabilidad de un ensayo ecotoxicológico con Chironomus calligraphus Goeldi ( Diptera: Chironomidae ) para evaluar cobre. Rev. per. Ent.. 44: 125-130.
Iannacone J. & Alvariño L. 2004b. Eisenia foetida ( Savigni, 1826 ) ( Annelida: Lumbricidae ) como modelo ecotoxicológico para evaluar lindano y clorpirifos. Acta Zoologica Lilloana. 67: 3-10.
Iannacone J. & Lamas G. 2002. Efecto de dos extractos botánicos y de un insecticida convencional sobre el depredador Chrysoperla externa. Manejo Integrado de Plagas y Agroecología ( Costa Rica ) . 65: 92-101.
Iannacone J. &. Lamas G. 2003 a. Efecto insecticida de cuatro extractos botánicos y del cartap sobre la polilla de la papa Phthorimaea operculella ( Zeller ) ( Lepidoptera: Gelechiidae ) , en el Perú. Entomotropica. 18: 95-105.
Iannacone J. & Lamas G. 2003 b. Efecto toxicológico del nim, rotenona y cartap sobre tres microavispas parasitoides de plagas agrícolas en el Perú. Boletín de Sanidad Vegetal Plagas. 29: 123-142.
Iannacone J., Alvariño L. & Mansilla J. 2002. Actividad insecticida de cuatro extractos botánicos sobre larvas de los mosquitos Culex quinquefasciatus ( Diptera: Culicidae ) y Chironomus calligraphus ( Diptera: Chironomidae ) . Wiñay Yachay ( Perú ) . 6: 59-74.
Keddy C.J., Greene J.C. & Bonnell M.A. 1995. Review of whole-organism bioassay: soil, freshwater sediment, and freshwater assessment in Canada. Ecotoxicology and Environmental Safety. 30: 221-251.
Komala K. 1995. Notes on the use of invertebrates, especially ciliates, in studies on pollution and toxicity. Folia Biologica ( Cracow ) . 43: 25-27.
Komala Z. 1982. Paramecium bioassay test in studies on cartap. Bulletin of Environmental Contamination and Toxicology. 28: 660-663.
Lee S.J., Tomizawa M. & Casida J.E. 2003. Nereistoxin and cartap neurotoxicity attributable to direct block of the insect nicotinic receptor/channel. Journal of Agriculture and Food Chemical. 51: 2646-2652.
Lee S.J., Caboni P., Tomizawa M. & Casida J.E. 2004. Cartap hydrolysis relative to its action at the insect nicotinic channel. Journal of Agriculture and Food Chemical. 52: 95-98.
Liao J.W., Pang V.F., Jeng C.R., Chang S.K., Hwang J.S. & Wang S.C. 2003. Susceptibility to cartap-induced lethal effect and diaphragmatic injury via ocular exposure in rabbits. Toxicology. 192: 139-148.
Malik M.F. 2001 a. Biological control of Pink Bollworm ( Pectinophora gossypiella, Lepidoptera: Gelechiidae ) by Trichogrammatoidea bactrae ( Hymenoptera: Trichogrammatidae ) in cotton ( Gossypium barbadense ) . Journal of Biological Sciences. 1: 488-489.
Malik M.F. 2001 b. Viability of Trichogrammatoidea bactrae pupae at different temperatures. Journal of Biological Sciences. 1: 593-594.
Medeiros R.S., Ramalho F.S., Zanuncio J.C. & Serrão J.E. 2003. Effect of temperature on life table parameters of Podisus nigrispinus ( Het., Pentatomidae ) fed with Alabama argillacea ( Lep., Noctuidae ) larvae Journal of Applied Entomology. 127: 209-213.
Mobaeta M.S., Reinecke S.A. & Reinecke A.J. 2004. The relationship between lysosomal biomarker and organismal responses in an acute toxicity test with Eisenia fetida ( Oligochaeta ) exposed to the fungicide copper oxychloride. Environmental Research. 96: 95- 101.
Mohaghegh J., De Clercq P. & Tirry L. 1999. Effects of rearing history and geographical origin on reproduction and body size of the predador Podisus nigrispinus ( Heteroptera: Pentatomidae ) . European Journal of Entomology. 96: 69-72.
Mohan M. & Gujar G. T. 2003. Local variation in susceptibility of the diamondback moth, Plutella xylostella ( Linnaeus ) to insecticides and role of detoxification enzymes. Crop Protection. 22: 495-504.
Nagata K., Ikeda T. & Shono T. 1999. Voltage-dependent modulation of the neuronal nicotinic acetylcholine receptor-channel by cartap. Pesticide Science. 55: 452- 456.
Ninsin K.D. 2004. Acetamiprid resistance and crossresistance in the diamondback moth, Plutella xylostella. Pest Managment Science. 60: 839-841.
OECD. 1984. Guideline for testing chemicals 207. Earthworm acute toxicity test. Adopted: 4 April.
OECD. 2000. Guideline for testing chemicals. New Guideline. Earthworm reproduction test ( Eisenia foetida/ andrei ) . Draft document.
Oliveira J.E.M., Torres J.B., Carrano-Moreira A.F. & Ramalho F.S. 2002. Biologia de Podisus nigrispinus predando lagartas de Alabama argillacea em campo. Pesquisas Agropecuarias Brasileiras. 37: 7-14.
Oste L.A., Dolfing J., Ma W.C. & Lexmond T.M. 2001. Effect of beringite on cadmium and zinc uptake by plantas and earthworms: more than a liming effect?. Environmental Toxicology and Chemistry. 20: 1339- 1345.
Picanço M., Leite G.L.D., Guedes R.N.C. & Silva E.A. 1998. Yield loss in trellised tomato affected by insecticidal sprays ans plant spacing. Crop Protection. 17: 447-452.
Pinto J.D., Oatman E.D. & Platner G.R. 1983. The identity of two closely related and frequently encountered species of New World Trichogramma ( Hym.: Trichogrammatidae ) . Proceedings of the Entomological Society of Washington. 85: 588-593.
Querino R.B. & Zucchi R.A. 2003. Caracterizção morfologica de dez espécies de Trichogramma ( Hymenoptera: Trichogrammatidae ) registradas na America. Neotropical Entomology. 32: 597-613.
Rae D.J., Watson D.M., Liang W.G., Li M., Huang M.D., Ding Y., Xiong J.J., Du D.P., Tang J. & Beattie G.A.C. 1996. Comparison of petroleum spray oils, abamectina, cartap, and methomyl for control of citrus leafminer ( Lepidoptera: Gracillariidae ) in Southern China. Journal of Economic Entomology. 89: 493-500.
Rao J.V. & Kavitha P. 2004. Toxicity of azodrin on the morphology and acetylcholinesterase activity of the earthworm Eisenia foetida. Environmental Research. 96: 323-327.
Reddy G.V. & Guerrero A. 2001. Optimum timing of insecticide applications against diamondback moth Plutella xylostella in cole crops using threshold catches in sex pheromone traps. Pest Managment Science. 57: 90-94.
Reis P.R. & Souza J.C.D. 1998. Chemical control of Tuta absoluta ( Meyrick ) in staked tomato plants. Ciencia e Agrotecnologia. 22: 13-21.
Robidoux P.Y., Hawari J., Thiboutot S., Ampleman G. & Sunahara G.I. 1999. Acute toxicity of 2,4, 6- trinitrotoluene in earthworm ( Eisenia andrei ) . Ecotoxicology and Environmental Safety. 44: 311-321.
Robidoux P.Y., Hawari J., Thiboutot S., Ampleman G. & Sunahara G.I. 2001. Chronic toxicity of octanohydro- 1.3.5, 7-tetranitro- |1, 3, 5, 7- tetrazocine ( HMX ) in soil determined using the earthworm ( Eisenia andrei ) . Environmental Pollution. 111: 283-292.
Satyanarayan S., Bejankiwar R.S., Chaudhari P.R., Kotangale J.P. & Satyanarayan A. 2004. Impact of some chlorinated pesticides on the haematology of the fish Cyprinus carpio and Puntius ticto. Journal of Environment Science. ( China ) . 16 : 631-634.
Scott J.G., Geden C.J., Rutz D.A. & Liu N. 1991. Comparative toxicity of seven insecticides to immature stages of Musca domestica ( Diptera: Muscidae ) and two of its important biological control agents, Muscidifurax raptor and Spalangia cameroni ( Hymenoptera: Pteromalidae ) . Journal of Economic Entomology. 84: 776-779.
Scott-Fordsmand J.J. & Weeks J.M. 2000. Biomarkers in earthworms. Review of Environmental Toxicology. 165: 117-159.
Takada Y., Kawamura S. & Tanaka T. 2001. Effects of various insecticides on the development of the egg parasitoid Trichogramma dendrolimi ( Hymenoptera: Trichogrammatidae ) . Journal of Economic Entomology. 94: 1340-1343.
Thomson L.J., Glenn D.C. & Hoffman A.A. 2000. Effects of sulfur on Trichogramma egg parasitoids in vineyards: measuring toxic effect and establishing release windows. Journal of Experimental Agriculture. 40: 1165-1171.
Tillman P.G. & Mullinix B.G. Jr. 2004. Comparison of susceptibility of pest Euschistus servus and predator Podisus maculiventris ( Heteroptera: Pentatomidae ) to selected insecticides. Journal of Economic Entomology. 97: 800-806.
Toia R.E., Christ D.K., Poole R.E., Bent P.E. & Peters G.A. 1981. Effects of selected pesticides on physiological and composition of four Azolla species. Plant Physiology. 67: 81-90.
Torres J.B., Silva-Torres C.S.A., Silva M.R. & Ferreira J.F. 2002. Compatibilidade de Inseticidas e acaricidas com o percevejo predador Podisus nigrispinus ( Dallas ) ( Heteroptera: Pentatomidae ) em algodoeiro. Neotropical Entomology. 31: 311-317.
Torres J.B., Silva-Torres C.S. & Barros R. 2003. Relative effects of the insecticide thiamethoxam on the predator Podisus nigrispinus and the tobacco whitefly Bemisia tabaci in nectaried and nectariless cotton. Pest Managment Science. 59: 315-23.
Van Gestel C.A.M., Van Dis W.A., Breemen, E.M. & Sparenburg, P.M. 1988. Comparison of two methods for determining the viability of cocons produced in earthworm toxicity experiments. Pedobiology. 32: 367- 371.
Vargas R.M. & Ubillo A.F. 2001. Toxicidad de pesticidas sobre enemigos naturales de plagas agrícolas. Agricultura Técnica ( Chile ) . 61: 35-41.
Velásquez M.R. & Terán J. 2003. Los Trichogramma ( Hymenoptera: Trichogrammatidae ) de la región noroccidental del estado de Guárico, Venezuela. Entomotropica. 18: 127-145.
Vega M.M., Urzelai A. & Angulo E. 1999. Minimum data required for deriving soil quality criteria from invertebrate ecotoxicity experiments. Environmental Toxicology and Chemistry. 18: 1304-1310.
Velásquez M.R. & Terán J. 2003. Los Trichogramma ( Hymenoptera: Trichogrammatidae ) de la región noroccidental del estado Guárico, Venezuela. Entomotropica. 18: 127-145.
Vermeulen L.A., Reinecke A.J. & Reinecke S.A. 2001. Evaluation of the fungicide manganese-zinc ethylene bis ( dithiocarbamate ) ( manozeb ) for sublethal and acute toxicity to Eisenia foetida ( Oligochaeta ) . Ecotoxicology and Environmental Safety. 48: 183-189.
Vieira A., Oliveira L. & García P. 2001. Effects of conventional pesticides on the preimaginal development stages and on adults of Trichogramma cordubensis ( Hymenoptera: Trichogrammatidae ) . Biocontrol Science and Technology. 11: 527-534.
Vivan L.M., Torres J.B., Barros R. & Veiga A.F. 2002. Population growth rate of the depredating Podisus nigrispinus ( Heteroptera: Pentatomidae ) and of the Tuta absoluta ( Leptoptera: gelechiidae ) in wintering place. Revista de Biología Tropical. 50: 145-153.
Werner I., Deanovic L.A., Connor V., Vlaming V.D., Bailey H.C. & Hinton D.E. 2000. Insecticide-caused toxicity to Ceriodaphnia dubia ( Cladocera ) in the Sacramento- San Joaquín River Delta, California, USA. Environmental Toxicology and Chemistry. 19: 215-227.
Whu M. 1985. Estudios biosistemáticos de Trichogramma spp. Revista peruana de Entomología. 28: 5-8.
Whu M.P. & Valdivieso L.J. 1999. Distribución y comportamiento de ocho especies de Trichogramma y Trichogrammatoidea ( Hymenoptera: Trichogrammatidae ) en el Perú. Revista peruana de Entomología. 41: 61-68.
Youssef A.I., Nasr F.N., Stefanos S.S., Elkhair S.S. A., Shehata W.A., Agamy E., Herz A. & Hassan S.A. 2004. The side-effects of plant protection products used in olive cultivation on the hymenopterous egg parasitoid Trichogramma cacoeciae Marchal. Journal of Applied Entomology. 128: 593-599.
Xia Q., Tang P., Feng X. Cheng M., Kajihara N., Minai M. & Hosaka Y. 1992. Assessment of the molluscicidal activities of tribromosalan, cartap and chlorothalonil against Oncomelania hupensis. Japanese Journal of Medicine Sciences and Biology. 45: 75-80.
Zacarias M.S., Moraes J.C., Castro-Diniz L., Ciociola A.I. Jr. & Damasceno A.G. 1998. Selectivity of insect growth regulators to eggs and nymphs of Podisus nigrispinus ( Dallas ) ( Hemiptera: Pentatomidae ) . Ciencia e Agrotecnologia. 22: 194-198.