Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Ecología Aplicada
versión impresa ISSN 1726-2216
Ecol. apl. vol.13 no.1 Lima ene. 2014
ARTICULOS DE REVISION
Algunas sugerencias para realizar evaluaciones biológicas de artrópodos terrestres en el Perú
Some suggestions for terrestrial arthropods bioassessments in Peru
Alfredo Edgardo Giraldo Mendoza1
1 Laboratorio de Ecología de Procesos. Universidad Nacional Agraria La Molina. Av. La Molina s/n, Lima 12, Lima-Perú. Dirección electrónica: aegmendoza@gmail.com
Resumen
El territorio peruano tiene una alta diversidad orográfica, climatológica, hidrológica, edafológica, florística y faunística. Se trata pues de una geografía demasiado compleja, cuando se busca prescribir metodologías de campo para las evaluaciones biológicas que se requieren en el ámbito de la evaluación ambiental. En el presente trabajo se proponen algunas sugerencias para realizar evaluaciones biológicas de comunidades de artrópodos terrestres en el Perú, con énfasis en la selección de métodos de captura y de taxones focales para la etapa de trabajo de campo. Dichas sugerencias se obtuvieron interpretando la información de un conjunto de referencias bibliográficas. Las ecorregiones tropicales poseen características climáticas y complejidad estructural que permiten aplicar con pocas restricciones la mayoría de métodos de captura. Asimismo, hay una variedad de taxones que pueden ser propuestos como focales, debido a la elevada riqueza que alcanzan en estas ecorregiones. Por el contrario, en las ecorregiones desérticas y altoandinas es difícil sugerir métodos de captura eficientes y taxones que puedan ser propuestos como focales, debido a los vacíos de información existentes.
Palabras clave: artrópodos terrestres, evaluaciones biológicas, métodos de captura, taxones focales, ecorregiones, Perú.
Abstract
The Peruvian territory has a high orographic, climatological, hydrological, pedological, floristic and faunal diversity. It´s geography is too complex, when looking for field methodologies for the biological assessments that are required in environmental assessment practices. We propose some suggestions for biological assessments of terrestrial arthropod communities in Peru, with emphasis on selection of sampling methods and focal taxa for the fieldwork phase. Such suggestions were obtained by interpreting information from a set of bibliographic references. Tropical eco-regions have climatic characteristics and structural complexity that permit the implementation of most sampling methods with few restrictions. There is also a variety of taxa that can be proposed as focal, due to the high richness found in these eco-regions. By contrast, in the desert and Andean eco-regions it is difficult to suggest efficient sampling methods and focal taxa, due to information gaps.
Key words: Terrestrial arthropods, bioassesments, sampling mehods, focal taxa, ecological regions, Peru.
Introducción.
El Perú es un país ecológicamente diverso. Sintetizar dicha diversidad ha motivado una serie de esquemas de clasificación, de los cuales el más tradicional fue dividir el territorio en tres regiones naturales: la Costa, la Sierra y la Selva o Montaña. Posteriormente, se plantearon esquemas tales como las ocho Regiones Naturales (Pulgar Vidal, 1967), las 84 Zonas de Vida (ONERN, 1976) y las once Ecorregiones (Brack, 1986), las cuales dan cuenta de la variedad orográfica, climatológica, hidrológica, edafológica, florística y faunística que caracteriza al territorio peruano. Es decir, es una geografía extremadamente compleja, cuando se busca prescribir metodologías de campo para las evaluaciones biológicas que se requieren en el ámbito de la evaluación ambiental.
En alusión a las evaluaciones de comunidades de artrópodos terrestres hay pocas investigaciones y experiencias prácticas realizadas en el Perú, entre las que se encuentran la de Córdova & Santisteban (1999) sobre varios taxones de artrópodos en la Reserva Nacional de Paracas, la de Giraldo (2002) sobre los coleópteros epígeos en las Lomas de Lachay, la de Alonso et al. (2001) sobre varios taxones de artrópodos en el Bajo Urubamba, la de Castañeda et al. (2007) con artrópodos epígeos en pastizales de Junín, la de Castro et al. (2008) con hormigas en un gradiente altitudinal de Lambayeque, y la de Castro (2009) sobre insectos epígeos en Tabaconas. Por otra parte, el volumen de monitoreos de artrópodos terrestres desarrollados para hacer evaluaciones ambientales sobre el impacto de actividades extractivas de hidrocarburos y minerales es difícil de determinar debido a la confidencialidad que caracteriza a este tipo de información.
En este trabajo se hacen algunas sugerencias para realizar evaluaciones de comunidades de artrópodos terrestres en el Perú, enfatizando en la selección de métodos de captura y de taxones focales para la etapa de trabajo de campo. Estas sugerencias son formuladas a partir de experiencias documentadas, provenientes de distintas partes del mundo y sobretodo del Neotrópico. En adición, se proporciona una clasificación de ecorregiones que facilita la comprensión y sirve de contexto para las sugerencias metodológicas planteadas en el texto.
Clasificación de ecorregiones
Tomando como punto de partida las nueve ecorregiones terrestres propuestas por Brack (1986) se ha elaborado un diagrama de dispersión utilizando las cifras de temperatura promedio anual y de precipitación total anual de cada una de ellas (Figura 1). En este diagrama se han fijado dos valores referenciales señalados por líneas punteadas, la temperatura mínima de actividad (15ºC) para la mayoría de insectos tropicales (Silveira Neto et al., 1976) y el límite superior de precipitación para los desiertos (500 mm), todo ello con base en la clasificación de biomas del mundo propuesta por Whittaker (Zhang & Wu, 2002). Tomando en cuenta estos límites, se reconocen tres tipos de ecorregiones:
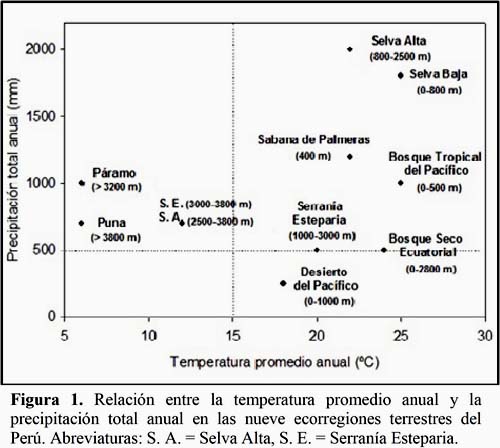
Las tropicales con precipitación y temperatura elevadas, con un límite altitudinal de 2500 m, y ubicadas en su mayoría en la vertiente oriental de los Andes. Incluyen al Bosque Tropical del Pacífico, la Selva Alta (< 2500 m), la Selva Baja y la Sabana de Palmeras.
Las desérticas con precipitación baja y temperatura alta a moderada, con un límite altitudinal de 3000 m, y ubicadas en la vertiente occidental de los Andes. Incluyen al Desierto del Pacífico, la Serranía Esteparia (< 3000 m) y el Bosque Seco Ecuatorial.
Las altoandinas con precipitación moderada y temperatura baja, altitudes por encima de los 2500 m, y ubicadas tanto en la altiplanicie como en ambas vertientes de los Andes. Incluyen a la Serranía Esteparia (> 3000 m), la Puna, el Páramo y la Selva Alta (> 2500 m).
Selección de métodos de captura
La selección de los métodos de captura depende fundamentalmente de dos factores: la actividad de los artrópodos y la complejidad del hábitat. Los métodos de captura pasivos (trampas) funcionan si los artrópodos se desplazan con suficiente intensidad como para ser interceptados o atraídos a los dispositivos diseñados para su colecta. Los métodos de captura activos funcionan cuando el colector encuentra una complejidad de hábitat, estructura de vegetación y microhábitats, que permite aplicarlos de modo eficiente.
Puesto que los artrópodos son ectotermos, su actividad está gobernada por la temperatura, la cual varía durante el año y en el transcurso del día. En el Perú, la fluctuación estacional de la temperatura no es demasiado severa debido a la posición latitudinal y en cambio, la fluctuación diaria puede alcanzar los 30°C en las ecorregiones altoandinas. Los registros de artrópodos en ambientes montanos alrededor del mundo, sugieren que su actividad es mayor en las horas del día con fuerte insolación y menor velocidad de viento, sobre todo para los insectos voladores (Mani, 1968). En ambientes altoandinos de Ecuador, colectas de Carabidae con trampas de caída sugieren que este taxón tiene un corto periodo de actividad crepuscular, antes que la temperaturas se tornen demasiado bajas (Somme et al., 1996). Además, las especies propias de bajas latitudes carecen en general de tolerancia fisiológica al congelamiento (Addo- Bediako et al., 2000).
Para examinar las diferencias en complejidad de hábitat que podrían afectar la ejecución de los métodos de captura se requiere examinar los ecosistemas o formaciones vegetales incluidos en las ecorregiones. A continuación se presenta una lista de ecosistemas presentes en el Perú (Brack, 1986) y sugerencias acerca de los métodos de captura aplicables en ellos según sus distintos grados de complejidad de hábitat. Esta lista se detalla en la Tabla 1 y puede tomarse como una guía para establecer protocolos de muestreo:
Bosques (bosques altoandinos, bosques montanos, bosques secos, bosques tropicales). En este tipo de ecosistemas son aplicables todos o la mayoría de los métodos de captura, debido a la estratificación vertical de la vegetación y la proliferación de microhábitats en el suelo. La fumigación de dosel y la extracción desde la hojarasca pueden realizarse mejor que en cualquiera de los otros ecosistemas (Kitching et al., 2001; Rohr et al., 2007; Missa et al., 2009).
Sabanas (algarrobales, sabanas). La mayoría de métodos siguen siendo aplicables. La existencia de espacios abiertos mejora la aplicación de los censos visuales, la búsqueda directa por unidad de área y las trampas de caída. Cabe tener precaución en utilizar la extracción desde hojarasca, puesto que ésta notiene el mismo volumen que en los bosques (Parr & Chown, 2001; Druce et al., 2004).
Matorrales (lupinares, monte ribereño, tolares). La mayoría de métodos siguen siendo aplicables. Cabe tener precaución al momento de aplicar los barridos con red entomológica, debido a la incidencia de plantas leñosas y cubiertas de espinas es recomendable usar mallas resistentes (Buffington & Redak, 1998; Churchill &Arthur, 1999).
Pastizales (césped de puna, pajonal de la pampa, pajonal de puna). Los métodos de captura aplicables son semejantes a los sugeridos para las sabanas, pero el repertorio es menor puesto que la estructura vegetal no es tan desarrollada (sin árboles). Los métodos recomendables para colectar artrópodos sobre la vegetación son el aspirador y los barridos con red entomológica. La existencia de espacios abiertos mejora la aplicación de los censos visuales, la búsqueda directa por unidad de área, las trampas de caída y las trampas de interceptación aérea (Duelli & Obrist, 1998; Standen, 2000).
Comunidades de herbáceas (dunas, gramadal, loma de hierbas, tilandsial). El escaso porte e inusual arquitectura de la vegetación desértica dificultan o inhabilitan a la mayoría de métodos para colectar sobre vegetación. Los aspiradores mecánicos y los barridos con red entomológica son aplicables, siempre y cuando las hierbas tengan el suficiente porte. Los espacios de suelo desnudo son favorables para la instalación de pequeñas bandejas coloreadas y trampas de caída (Mattoni et al., 2000; Henschel et al., 2010).
Vegetación columnar (cactáceas, rodales, pacales). Este tipo de vegetación inhabilita todos los métodos para colectar sobre vegetación. Es probable que los demás métodos puedan aplicarse sin mayores complicaciones, pero hay un considerable vacío de información al respecto.
Humedales (bofedales, bordes de cochas, bordes de lagunas altoandinas). La presencia de zonas anegadas dificulta la búsqueda directa en el suelo. Si la vegetación es almohadillada (bofedales) o de escaso porte, los métodos para colectar sobre vegetación son ineficientes. Las bandejas coloreadas y las trampas de luz han probado ser particularmente efectivas en estetipo de ecosistemas (Pollet, 1992; Garono & Kooser, 2001).
Bosques inundables (aguajales, bajiales, manglares). El difícil acceso a estos ecosistemas es el principal obstáculo para realizar colectas en ellos. Es probable que las trampas de luz tengan resultados tan buenos como en los humedales, pero hay un considerable vacío de información al respecto.
Zona intermareal (playas arenosas o pedregosas). La búsqueda por unidad de tiempo es el método más recomendable, debido a la distribución agregada de los artrópodos en los depósitos de algas y otros restos orgánicos marinos. Pueden aplicarse también las trampas de caída y la extracción desde sustratos (Camus & Barahona, 2002; Jaramillo et al., 2006).
Cuevas. La búsqueda por unidad de tiempo es el método más recomendable, puesto que las paredes y el fondo de la cueva albergan toda suerte artrópodos. Pueden aplicarse también las trampas de caída y las trampas cebadas (Weinstein & Slaney, 1995; Ferreira & Horta, 2001). La lista de métodos de capturas aplicables en estos ecosistemas podría ampliarse, a medida que se conozca más de la fauna cavernícola en el Perú. Un estudio pionero al respecto, fue realizado en la Cueva de Las Lechuzas (Dourojeanni & Tovar, 1974).
Para llevar a la práctica las sugerencias planteadas para la selección de métodos de captura, cabe considerar que los ecosistemas no siempre están exactamente definidos. Lo usual es hallar paisajes severamente fragmentados, formaciones vegetales mixtas, gradientes y ecotonos. Aparte de ello, la transformación antropogénica del paisaje ha generado todo un mosaico de biomas humanos (urbes, zonas rurales, cultivos, etc.), los cuales ocupan más de ¾ del área continental no cubierta por el hielo (Ellis & Ramankutty, 2008). En consecuencia, lo más probable será hallar parches de una complejidad de hábitat muy disímil, uno al lado del otro. Frente a este panorama, los métodos de captura más convenientes son aquellos que pueden aplicarse en ecosistemas con distinta complejidad, sencillos de implementar y fácilmente replicables en el espacio y en el tiempo. En este sentido, Neville & Yen (2007) recomendaron el uso de 10 trampas de caída (1.8 o 7.4 cm de diámetro) y 3 bandejas coloreadas (18 ×12 cm) como una unidad estándar para el muestreo de artrópodos terrestres en la generalidad de ecosistemas naturales y agrícolas de Australia.
Selección de taxones focales
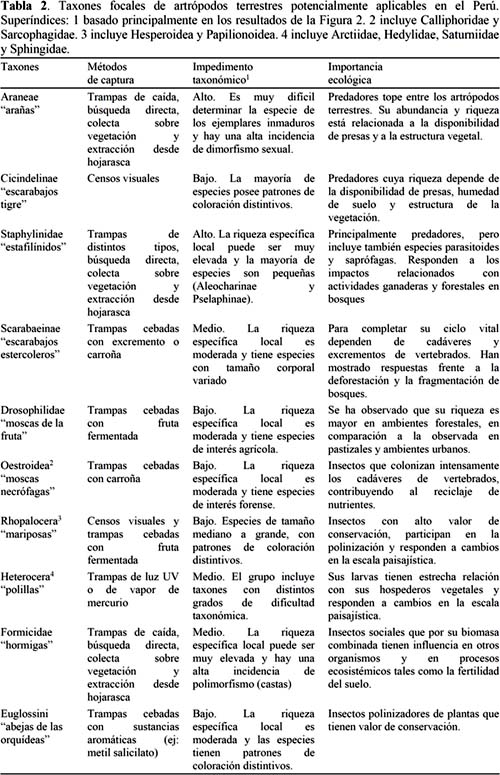
El modo más práctico de proponer taxones focales para las evaluaciones biológicas de comunidades de artrópodos terrestres en el Perú es recurrir a las recomendaciones y evidencia empírica obtenida a través de investigaciones realizadas en países del Neotrópico. Siguiendo esta premisa se elaboró la Tabla 2, la cual presenta diez taxones de artrópodos terrestres previamente sugeridos como taxones focales en el Neotrópico: Araneae (Silva & Coddington, 1996; Lo-Man-Hung et al., 2008), Cicindelinae (Coleoptera; Rodríguez et al., 1998; Franzen, 2004), Staphylinidae (Coleoptera; Sanabria et al., 2008; Gutiérrez-Chacón et al., 2009), Scarabaeinae (Coleoptera; Spector, 2006; Nichols et al., 2007), Drosophilidae (Diptera; Mata et al., 2008), Oestroidea (Diptera; Montoya et al., 2009), Rhopalocera (Lepidoptera; Sparrow et al., 1994; Brown & Freitas, 2000), Heterocera (Lepidoptera; Ferro & Melo, 2011), Formicidae (Hymenoptera; Delabie et al., 2009, Groc et al., 2009) y Euglossini (Hymenoptera; Hedström et al., 2006). En dicha tabla se señalan los métodos de captura más apropiados para su colecta, su grado de impedimento taxonómico y su importancia ecológica. En cuanto a los métodos de captura sugeridos, se observa que la mayoría de taxones cuenta con un método de captura especialmente acondicionado para colectarlos de manera eficiente y a la vez reducir la colecta incidental de otros taxones. La excepción está representada por los Araneae, Staphylinidae y Formicidae, para los cuales hay una amplia variedad de métodos disponibles en concordancia con los distintos estratos (suelo, sotobosque y dosel) y microhábitats (mantillo, vegetación, etc.) que ocupan. Es preciso indicar que los métodos de captura más limitados en su ejecución son los censos visuales propuestos para Cicindelinae y Rhopalocera, los cuales sólo pueden realizarse en caminos, senderos u otros espacios abiertos.
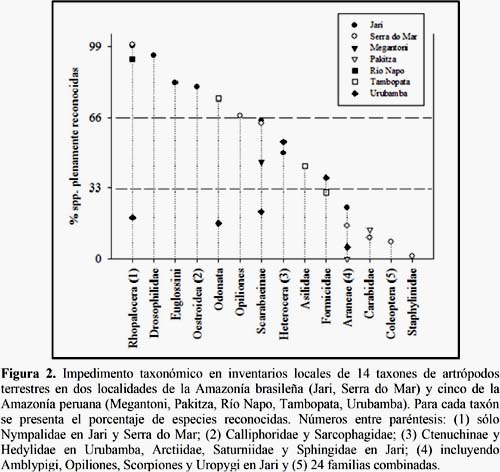
Para ilustrar cómo el impedimento taxonómico afecta a los distintos taxones sugeridos como focales, se elaboró un diagrama con el porcentaje de especies reconocidas (Figura 2). Es decir, sólo las especies que pudieron ser asignadas a un nombre binomial conocido, excluyendo especies afines y no descritas cuya situación taxonómica no está definida. La información se obtuvo de siete localidades amazónicas, Alto Río Napo (Lamas et al., 1996), Bajo Urubamba (Alonso et al., 2001), Jari (Barlow et al., 2007), Megantoni (Vriesendorp et al., 2004), Pakitza (Erwin, 1990; Silva & Coddington, 1996), Serra do Mar (Uehara-Prado et al., 2009) y Tambopata (Fisher, 1985, Paulson, 1985; Wilson, 1987). Los resultados sugieren que el impedimento taxonómico es bajo para Drosophilidae, Euglossini, Odonata, Oestroidea y Rhopalocera, de mediana intensidad para Asilidae (Diptera), Formicidae, Heterocera, Opiliones y Scarabaeinae, y alto para Araneae y Coleoptera (familias por separado y en conjunto). Datos provenientes de otras localidades amazónicas permitirían generalizar estos resultados. Cabe señalar que la calidad en la determinación de las especies también fue afectada por la experiencia de los taxónomos que participaron en las evaluaciones. Por tal motivo, los porcentajes de especies reconocidas para Rhopalocera, Odonata y Scarabaeinae en el Bajo Urubamba fueron más bajos que los observados en otras localidades.
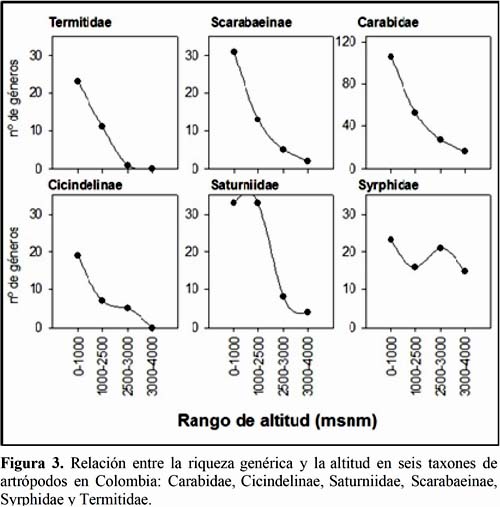
Por otro lado, es importante conocer las condiciones ecológicas que favorecen la abundancia y la diversidad de los potenciales taxones focales. Para esto, se revisó la relación entre la altitud y la riqueza genérica de seis taxones de artrópodos en Colombia, un país andino con ecosistemas similares a los observados en el oriente del Perú (Figura 3), los cuales fueron: Carabidae (Martinez, 2005), Cicindelinae (Vitolo &Pearson, 2003), Saturniidae (Lepidoptera; Amarillo, 2000), Scarabaeinae (Medina et al., 2001), Syrphidae (Diptera; Gutiérrez et al., 2005) y Termitidae (Isoptera; Vargas-Niño et al., 2005). En cinco de los taxones evaluados la riqueza tuvo un marcado descenso alrededor de los 2500 msnm, sólo Syrphidae presentó una riqueza genérica insensible al gradiente altitudinal. A partir de este resultado, la altitud de 2500 msnm puede servir como un valor de referencia para decidir en qué localidades donde es razonable prescribir taxones focales y en cuales no resultaría confiable hacerlo, puesto que la riqueza genérica (y específica) de ellos se deprime considerablemente. Cabe esperar que este patrón sea el mayoritario entre los taxones de artrópodos, en vista que la riqueza específica de varios órdenes de insectos epífitos colectados a 200, 1600, 3550 y 3600 msnm en los Andes venezolanos también se relacionó negativamente con la altitud (Janzen et al., 1976). En este caso, la disminución de la riqueza fue particularmente acentuada para los Formicidae, mientras que los Diptera y los Hymenoptera Parasitica mostraron un descenso de riqueza relativamente más suave.
Si bien la altitud es un factor importante, la riqueza de artrópodos se relaciona de un modo complejo con un conjunto de factores como la precipitación, la productividad o la temperatura que varían a su vez con la orografía. Así por ejemplo, la riqueza específica de artrópodos epífitos en el norte de Chile (50-4100 msnm), fue mayor en lomas y quebradas cuyas condiciones orográficas e hidrográficas contrarrestan la aridez que caracteriza a las vertientes occidentales andinas en esas latitudes (Saiz et al., 2000).
Consideraciones finales
Se requiere todavía una fuerte dosis de ensayo y error para prescribir métodos de captura y taxones focales aplicables en las evaluaciones biológicas de comunidades de artrópodos terrestres en el Perú. En tal sentido, muchas de las sugerencias presentadas aquí deben ser tomadas como hipótesis de trabajo, a partir de las cuales deberían proponerse sendas investigaciones de carácter metodológico. Asimismo, es necesario entrenar un mayor número de profesionales en la taxonomía de artrópodos y realizar estudios para encontrar los taxones focales más adecuados para los ecosistemas peruanos.
Las ecorregiones tropicales ofrecen mayor libertad al momento de seleccionar métodos de captura y taxones focales. En ellas se encuentran ecosistemas cuyas características climáticas y complejidad estructural hacen posible aplicar con pocas restricciones la mayoría de métodos para colectar artrópodos sobre la vegetación, las distintas modalidades de búsqueda directa, la extracción desde el sustrato (hojarasca y suelo) e instalar distintos tipos de trampas con o sin atrayentes. Asimismo, son ecosistemas en los cuales la mayoría de taxones de artrópodos alcanza su mayor riqueza, a la vez altas densidades que tienen su expresión más conspicua en las colonias de insectos sociales (termitas y hormigas). Al margen de estas ventajas, es necesario no perder la precaución al momento de implementar evaluaciones biológicas de artrópodos terrestres en ecorregiones tropicales, pues aunque no hay mayor dificultad en aplicar métodos de captura y encontrar ejemplares de taxones focales, el riesgo es colectar muestras muy voluminosas que sean difíciles de procesar en laboratorio y de convertir en información. Para el caso de los Diptera del Neotrópico, Brown (2005) pone de manifiesto la desproporción entre el volumen de ejemplares que se pueden colectar con trampas Malaise en localidades amazónicas y el lento progreso de las investigaciones referidas a su taxonomía.
Las ecorregiones desérticas y altoandinas presentan ecosistemas cuyas características climáticas y complejidad estructural hacen difícil la ejecución de la mayoría de métodos de captura y reducen la riqueza de la mayoría de taxones de artrópodos. Hay evidentes vacíos de información acerca de los métodos de captura recomendables y de los taxones particulares que pueden ser propuestos como focales. La mayor preocupación al momento de implementar evaluaciones biológicas de artrópodos en estos ecosistemas, es encontrar suficientes ejemplares y especies. Esta afirmación es particularmente válida para el tiempo de operación de las trampas en los ecosistemas altoandinos.
Literatura citada.
Addo-Bediako A., Chown S. L. & Gaston K. J. 2000. Thermal tolerance, climatic variability and latitude. Proceedings of the Royal Society of London. Series B. 267: 739-745.
Alonso A., Dallmeier F. & Campbell P. (eds.) 2001. Urubamba: the biodiversity of a Peruvian rainforest. SI/MAB Series # 7. Smithsonian Institution, Washington DC. 204 p.
Amarillo A. R. 2000. Polillas satúrnidas (Lepidoptera: Saturniidae) de Colombia. Biota Colombiana. 1(2): 177- 186.
Barlow J., Gardner T. A., Araujo I. S., Ávila-Pires T. C., Bonaldo A. B., Costa J. E., Esposito M. C., Ferreira L. V., Hawes J., Hernandez M. I. M., Hoogmoed M. S., Leite R. N., Lo-Man-Hung N. F., Malcolm J. R., Martins M. B., Mestre L. A. M., Miranda-Santos R., Nunes-Gutjahr A. L., Overal W. L., Parry L., Peters S. L., Ribeiro-Junior M. A., da Silva M. N. F., da Silva Motta C. & Peres C. A. 2007. Quantifying the biodiversity value of tropical primary, secondary and plantation forests. Proceedings of Natural Academy of Sciences. 104(47): 18555-18560.
Brack A. 1986. Las Ecorregiones del Perú. Boletín de Lima. 44: 57-70.
Brown B. V. 2005. Malaise trap catches and the crisis in Neotropical Dipterology. American Entomologist. 51(3): 180-183.
Brown K. S. & Freitas A.V. L. 2000. Atlantic forest butterflies: Indicators for landscape conservation. Biotropica. 32(4b): 934-956.
Buffington M. L. & Redak R. A. 1998. A comparison of vacuum sampling versus sweep-netting for arthropod biodiversity measurements in California coastal sage scrub. Journal of Insect Conservation. 2: 99-106.
Camus P. A. & Barahona R. M. 2002. Insectos del intermareal de Concepción, Chile: perspectivas para la investigación ecológica. Revista Chilena de Historia Natural. 75: 793-803.
Castañeda L., Arellano G. &Sánchez E. 2007. Efecto de una quema controlada en los artrópodos epígeos de pasturas en la SAIS Túpac Amaru, Junín– Perú. Ecología Aplicada. 6 (1, 2): 47-58.
Castro S. 2009. Evaluación de la diversidad y composición trófica de los insectos del suelo en parcelas de restauración en Tabaconas (San Ignacio, Cajamarca). Tesis para obtener el grado de Magíster Scientiae. Maestría de Ecología Aplicada. Universidad Nacional Agraria La Molina, Lima.142 pp.
Castro S., Vergara C. & Arellano C. 2008. Distribución de la riqueza, composición taxonómica y grupos funcionales de hormigas del suelo a lo largo de un gradiente altitudinal en el Refugio de Vida Silvestre Laquipampa, Lambayeque- Perú. Ecología Aplicada. 7 (1, 2): 89-103.
Churchill T. B. & Arthur J. M. 1999. Measuring spider richness: effects of different sampling methods and spatial and temporal scales. Journal of Insect Conservation. 3: 287-295.
Córdova S. & Santisteban J. 1999. Evaluación rápida de la biodiversidad de artrópodos en la Reserva Nacional de Paracas, Departamento de Ica, Perú. Reporte GEA. 17pp.
Delabie J. H. C., Céréghino R., Groc S., Dejean A., Gibernau M., Corbara & Dejean A. 2009. Ants as biological indicators of Wayana Amerindian land use in French Guiana. Comptes Rendus Biologies. 332: 673- 684.
Dourojeanni M. J. & Tovar A. 1974. Notas sobre el ecosistema y la conservación de la Cueva de las Lechuzas (Parque Nacional de Tingo María, Perú). Revista Forestal del Perú, 5(1-2): 1-19.
Druce D., Hamer M. & Slotow R. 2004. Sampling strategies for millipedes (Diplopoda), centipedes (Chilopoda) and scorpions (Scorpionida) in savanna habitats. African Zoology. 39(2): 293-304.
Duelli P. & Obrist M. K. 1998. In search of the best correlates for local organismal biodiversity in cultivated areas. Biodiversity and Conservation. 7: 297-309.
Ellis E. C. & Ramankutty N. 2008. Putting people in the map: anthropogenic biomes of the world. Frontiers in Ecology and Environment. 6(8): 439-447.
Erwin T. L. 1990. Natural history of the carabid beetles at the BIOLAT Biological Station, Rio Manu, Pakitza, Peru. Revista Peruana de Entomología. 33: 1-85.
Ferreira R. L. & Horta L. C. S. 2001. Natural and human impacts on invertebrate communities in brazilian caves. Revista Brasileira de Biologia. 61(1): 7-17.
Ferro V. G. & Melo A. S. 2011. Diversity of tiger moths in a Neotropical hotspot: determinants of species composition and identification of biogeographic units. Journal of Insect Conservation.15: 643-651.
Fisher E. M. 1985. A preliminary list of the robber flies (Diptera: Asilidae) of the Tambopata Reserved Zone, Madre de Dios, Perú. Revista Peruana de Entomología. 27:25-36.
Franzen M. 2004. Tiger beetle assemblages in a climatically transitional area of northwestern Costa Rica. Mitt. Münch. Ent. Ges. 94: 87-95.
Garono R. J. & Kooser J. G. 2001. The relationship between patterns in flying adultinsect assemblages and vegetation structure in wetlands of Ohio and Texas. Ohio Journal of Science. 101(2): 12-21.
Giraldo A. 2002. Análisis de los patrones de variación espacio-temporal de las poblaciones de coleópteros en la Reserva Nacional de Lachay, durante el periodo 1998– 2001. Tesis para optar el Título de Biólogo. Universidad Nacional Agraria La Molina. Lima.
Groc S., Orivel J., Dejean A., Martin J.-M., Etienne M.-P., Corbara B. & Delabie J. H. C. 2009.Baseline study of the leaf-litter ant fauna in a French Guianese forest. Insect Conservation and Diversity. 2: 183-193.
Gutiérrez C., Carrejo N. S. & Ruiz C. 2005. Listado de los géneros de Syrphidae (Diptera: Syrphoidea) de Colombia. Biota Colombiana. 6(2): 173-180.
Gutiérrez-Chacón C., Zúñiga M. C. Van Bodegom P. M., Chará J. & Giraldo L. P. 2009. Rove beetles (Coleoptera: Staphylinidae) in Neotropical riverine landscapes: characterising their distribution. Insect Conservation and Diversity. 2: 106-115.
Hedström I., Denzel A. & Owens G. 2006. Orchid bees as bio-indicators for organic coffee farms in Costa Rica: Does farm size affect their abundance? Revista de Biología Tropical. 54(3): 965-969.
Henschel J. R., Grohmann C., Siteketa V. & Linsenmair K. E. 2010. Monitoring tenebrionid beetle biodiversity in Namibia. African Study Monographs. 40: 91-102.
Janzen D. H., Ataroff M., Fariñas M., Reyes S., Rincón N., Soler A., Soriano P. & Vera M. 1976. Changes in the arthropod community along elevational transect in the Venezuelan Andes. Biotropica. 8(3): 193-203.
Jaramillo E., De la Huz R., Duarte C. & Contreras H. 2006. Algal wrack deposits and macroinfaunal arthropods on sandy beaches of the Chilean coast. Revista Chilena de Historia Natural. 79: 337-351.
Kitching R. L., Li D. & Stork N. E. 2001. Assessing biodiversity sampling packages: how similar are arthropod assemblages in different tropical rainforests? Biodiversity and Conservation. 10: 793–813.
Lamas G., Robbins R. K. & Harvey D. J. 1996. Mariposas del alto Río Napo, Loreto, Perú (Lepidoptera: Papilionoidea y Hesperioidea). Revista Peruana de Entomología. 39: 63-74.
Lo-Man-Hung N. F., Gardner T. A., Ribeiro-Júnior M. A., Barlow J. & Bonaldo A. B. 2008. The value of primary, secondary, and plantation forests for Neotropical epigeic arachnids. The Journal of Arachnology. 36:394-401.
Mani M. S. 1968. Ecology and biogeography of high altitude insects. Dr. Junk N. V. publishers. La Haya. 327 p.
Martínez C. 2005. Introducción a los escarabajos Carabidae (Coleoptera) de Colombia. Instituto de Investigación de Recursos Biológicos Alexander von Humboldt. Bogotá. D. C. (Colombia). 546 pp.
Mata R. A., McGeoch M. & Tidon R. 2008. Drosophilid assemblages as a bioindicator system of human disturbance in the Brazilian Savanna. Biodiversity and Conservation.17: 2899-2916.
Mattoni R., Longcore T. & Novotny V. 2000. Arthropod monitoring for fine-scale habitat analysis: a case study of the El Segundo sand dunes. Environmental Management. 25(4): 445-452.
Medina C. A., Lopera-Toro A., Vitolo A. & Gill B. 2001. Escarabajos coprófagos (Coleoptera: Scarabaeidae: Scarabaeinae) de Colombia. Biota Colombiana.2 (2): 131-144.
Missa O., Basset Y., Alonso A., Miller S. E., Curletti G., De Meyer M., Eardley C., Mansell M. W. & Wagner T. 2009. Monitoring arthropods in a tropical landscape: relative effects of sampling methods and habitat types on trap catches. Journal of Insect Conservation. 13(1): 103- 118.
Montoya A. L., Sánchez J. D. & Wolff M. 2009.Sinantropía de Calliphoridae (Diptera) del Municipio La Pintada, Antioquía – Colombia. Revista Colombiana de Entomología. 35 (1): 73-82.
Neville P. J. & Yen A. L. 2007. Standardising terrestrial invertebrate biomonitoring techniques across natural and agricultural systems. Australian Journal of Experimental Agriculture. 47: 384-391.
Nichols E., Larsen T., Spector S., Davis A .L., Escobar F., Favila M., Vulinec K. & The Scarabaeinae Research Network 2007. Global dung beetle response to tropical forest modification and fragmentation: A quantitative literature review and metaanalysis. Biological Conservation. 137: 1-19.
ONERN 1976. Mapa ecológico del Perú. Guía explicativa y mapa. Lima.
Parr C. L. & Chown S. L. 2001. Inventory and bioindicator sampling: Testing pitfall and Winkler methods with ants in a South African savanna. Journal of Insect Conservation. 5: 27-36.
Paulson D. R. 1985. Odonata of the Tambopata Reserved Zone, Madre de Dios, Perú. Revista Peruana de Entomología.27: 9-14.
Pollet M. 1992. Impact of environmental variables on the ocurrence of dolichopodid flies in marshland habitats in Belgium (Diptera: Dolichopodidae). Journal of Natural History. 26: 621-636.
Pulgar Vidal J. 1967. Análisis geográfico sobre las Ocho Regiones Naturales del Perú. Lima.
Rodriguez J. P., Pearson D. & Barrera R. 1998. A test for the adequacy of bioindicator taxa: Are tiger beetles (Coleoptera: Cicindelidae) appropiate indicators for monitoring the degradation of tropical forests in Venezuela? Biological Conservation. 83: 69-76.
Rohr J. R., Mahan C. G. & Kim K. C. 2007. Developing a monitoring program for invertebrates: guidelines and a case study. Conservation Biology. 21(2): 422-433.
Saiz F., Yates L., Núñez C., Daza M., Varas M. E. & Vivar C. 2000. Biodiversidad del complejo de artrópodos asociados al follaje de la vegetación del norte de Chile, IIregión. Revista Chilena de Historia Natural. 73: 671- 692.
Sanabria C., ArmbrechtI. &Gutiérrez-Chacón C. 2008 Diversidad de estafilínidos (Coleoptera: Staphylinidae) en cinco sistemas productivos de los Andes Colombianos. Revista Colombiana de Entomología. 34 (2): 217-223.
Silva D. & Coddington J. A. 1996. Spiders of Pakitza (Madre de Dios, Perú): species richness and notes on community structure. Pp. 253-311. in: Wilson D. E. and SandovalA. (eds.). Manu. The biodiversity of Southeastern Peru. Office of Biodiversity Programs. National Museum of Natural History. Smithsonian Institution, Washington DC.
Silveira Neto S., Nakano O., Barbin D. & Villa Nova N. 1976. Manual do Ecología dos Insectos. Escuela Superior de Agricultura "Louiz de Queiroz". Editora Agronomica Ceres Ltda. Piracicaba, Sao Paulo (Brasil). 420 pp.
Somme L., Davidson R. L. & Onore G. 1996. Adaptations of insects at high altitudes of Chimborazo, Ecuador. European Journal of Entomology. 93: 313-318.
Sparrow H. R., Sisk T. D., Ehrlich P. R. & Murphy D. D. 1994. Techniques and guidelines for monitoring neotropical butterflies. Conservation Biology. 8(3): 800- 809.
Spector S. 2006. Scarabaeine dung beetles (Coleoptera: Scarabaeidae: Scarabaeinae): an invertebrate focal taxon for biodiversity research and conservation. The Coleopterists Bulletin. 5: 71-83.
Standen V. 2000. The adequacy of collecting techniques for estimating species richnessof grassland invertebrates. Journal of Applied Ecology. 37: 884-893.
Uehara-Prado M., de Oliveira Fernandes J., de Moura Bello A., Machado G., Santos A. J., Zagury Vaz de Mello F. & Lucci Freitas A. V. 2009. Selecting terrestrial arthropods as indicators of small-scale disturbance: A first approach in the Brazilian Atlantic Forest. Biological Conservation. 142: 1220-1228.
Vargas-Niño A. P., Sánchez-Muñoz O. D. & Serna-Cardona F. J. 2005. Lista de los géneros de Termitidae (Insecta: Isoptera) de Colombia. Biota Colombiana. 6(2): 181- 190.
Vitolo A. & Pearson D. 2003. Escarabajos tigre (Coleoptera: Cicindelidae) de Colombia. Biota Colombiana. 4(2): 167-174.
Vriesendorp C., Rivera Chávez L., Moskovits D. & Shopland J. (eds.). 2004. Peru: Megantoni. Rapid Biological Inventories Report 15. Chicago, Illinois: The Field Museum.
Weinstein P. & Slaney D. 1995. Invertebrate faunal survey of Rope Ladder Cave, Northern Queensland: a comparative study of sampling methods. Journal of Australian Entomological Society. 34: 233-236.
Wilson E. O. 1987. The arboreal ant fauna of Peruvian Amazon forests: a first assessment. Biotropica. 19(3): 245-251.
Zhang H. & Wu J. 2002. A statistical thermodynamic model of the organizational order of vegetation. Ecological Modelling. 153: 69-80.















