Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Ecología Aplicada
Print version ISSN 1726-2216
Ecol. apl. vol.16 no.2 Lima July 2017
http://dx.doi.org/10.21704/rea.v16i2.1011
ARTICULO ORIGINAL
Asociación de coleópteros xilófagos y predadores en madera de Bolaina blanca (Guazuma crinita Martius) y Cucarda (Hibiscus rosa-sinensis Linnaeus)
Xylophage-predator association of beetles in wood of beetles in wood of Bolaina blanca (Guazuma crinita Martius) and Cucarda (Hibiscus rosa-sinensis LinnaGuazuma crinita Martius) and CUCARDA (Hibiscus rosa-sinensis Linnaeus)
Javier Huanca1, Alfredo Edgardo Giraldo2, Clorinda Elisa Vergara2 y Manuel Soudre3
1 Universidad Nacional Agraria La Molina, Museo de Entomología Klaus Raven Büller, Av. La Molina s/n, Lima 12, Lima, Perú. jhm_be@yahoo.com
2 Universidad Nacional Agraria La Molina, Museo de Entomología Klaus Raven Büller, Av. La Molina s/n, Lima 12, Lima, Perú
3 Reforestadora Amazónica S.A., Jirón Trujillo 560, Lima 17, Lima, Perú
Resumen
Se examinaron dos especies vegetales Hibiscus rosa-sinensis cucarda y Guazuma crinita bolaina blanca con signos de daño causados por insectos xilófagos. Se encontraron dos asociaciones predador-presa: En cucarda, el barrenador Micrapate scabrata (Erichson, 1847) (Coleoptera: Bostrichidae) con el predador Teretrius (Neotepetrius) peruanus Erichson, 1847 (Coleoptera: Histeridae), en bolaina blanca, tres escarabajos de la corteza Euplatypus paralellus (Fabricius, 1801), Xyleborus affinis Eichhoff, 1868 y Xyleborus ferrugineus (Fabricius, 1801) (Coleoptera: Curculionidae) con cinco predadores Aulonium oblitum Pascoe, 1863, Nematidium cylindricum (Fabricius 1801) y Nematidium filiforme Le Conte, 1863 (Coleoptera: Colydiidae), Coptotrophis proboscideus (Fabricius, 1801) (Coleoptera: Histeridae) y Sosylus duplicatus Pascoe 1863 (Coleoptera: Bothrideridae). Se incluye información sobre morfología, hábitos y distribución de las especies.
Palabras clave: Coleoptera, entomología forestal, predadores, xilófagos, asociaciones predador- presa.
Abstract
Two plant species Hibiscus rosa-sinensis "cucarda" and Guazuma crinita "bolaina blanca" with signs of damage caused by wood-boring insects were examined. Two predator-prey associations were found. In Hibiscus rosa-sinensis the powder post beetle Micrapate scabrata (Erichson, 1847) (Coleoptera: Bostrichidae) with the predator Teretrius (Neotepetrius) peruanus Erichson, 1847 (Coleoptera: Histeridae) and in Guazuma crinita, three bark and ambrosia beetles Euplatypus paralellus (Fabricius, 1801), Xyleborus affinis Eichhoff, 1868 and Xyleborus ferrugineus (Fabricius, 1801) Coleoptera: Curculionidae) with five predators Aulonium oblitum Pascoe, 1863, Nematidium cylindricum (Fabricius 1801) and Nematidium filiforme Le Conte, 1863 (Coleoptera: Colydiidae), Coptotrophis proboscideus (Fabricius, 1801) (Coleoptera: Histeridae) and Sosylus duplicatus Pascoe 1863 (Coleoptera: Bothrideridae). Information is included on morphology, habits and distribution of the species.
Key words: Coleoptera, forest entomology, predators, xylophages, predator-prey associations.
Introducción
Los estudios de entomología forestal en el Perú, están referidos mayormente a las plagas potenciales de la madera, es decir a los insectos xilófagos. En comparación, son muy escasos los avances en la búsqueda y reconocimiento de sus enemigos naturales, tales como los predadores que viven en el interior de las galerías.
El desarrollo de la entomología forestal en el Perú ha sido bastante tardío; según el diagnóstico de Dourojeanni (1967), los estudios de esta disciplina fueron prácticamente nulos entre 1892 y 1959. En la década de 1960, dicho autor presentó un listado de los hospederos vegetales para las especies de Bostrichidae, Platypodidae y Scolytidae (Dourojeanni, 1963); estas dos últimas familias, ahora incluidas como Subfamilias de Curculionidae (Arnett et al., 2002). Asimismo, registros de especies de interés forestal de las familias Chrysomelidae, Lyctidae y Curculionidae (Dourojeanni, 1965). La especie Xylosandrus compactus (Eichhoff 1875) (Curculionidae: Scolytinae) ha merecido atención como plaga de frutales y maderables, entre ellas aguacate (Persea americana Mill., 1768) (Wolfenbarger, 1973), camu camu (Myrciaria dubia (Kunth) McVaugh) (Couturier & Tanchiva, 1991) y caoba (Swietenia macrophylla King 1886) (Delgado & Couturier, 2010). En un listado de insectos asociados al algarrobo (Prosopis pallida (Humb. & Bonpl. ex Willd.) Kunth), se incluyó a Micrapate humeralis (Coleoptera: Bostrichidae) (Blanchard, 1851) como barrenador de tallos (Núñez- Sacarías, 1994).
En la literatura mundial, se han registrado asociaciones predador-presa que involucran a varias familias de coleópteros forestales, así por ejemplo: El género Teretrius Erichson 1834 (Histeridae) predador de varias especies de Bostrichidae (Bahillo de la Puebla et al., 2007), Los géneros Laemophloeus Laporte, 1840 (Laemophloeidae), Microsicus Sharp, 1894 (Zopheridae) y Europs Wollaston, 1854 (Monotomidae) predadores de Xyleborus glabratus Eichhoff (Scolytinae) (Peña et al., 2015), la especie Thanasimus dubius (Fabricius) (Cleridae) predador de Platypus flavicornis (Fabricius) (Platypodinae) y Dendroctonus frontalis Zimmerman, 1868 (Scolytinae) (Clarke & Menard, 2006). En este tipo de asociaciones, los predadores presentan adaptaciones morfológicas para vivir en las galerías alimentándose de los estados inmaduros de los xilófagos.
La cucarda Hibiscus rosa-sinensis Linnaeus (Malvales: Malvaceae) es un arbusto de uso ornamental y medicinal. En el distrito de La Molina (Lima) es común encontrarla en jardines de viviendas y parques. La bolaina blanca Guazuma crinita Martius (Malvales: Sterculiaceae), es un árbol de rápido crecimiento cuya madera se utiliza en la construcción de viviendas rústicas, nobles y prefabricadas; así como en la fabricación de postes, listonería, puertas, ventanas y muebles, entre otros. Plantaciones extensas de esta especie se encuentran a orillas del río Pachitea, en la localidad de Puerto Inca (Huánuco).
El objetivo de esta investigación fue registrar las asociaciones de coléopteros predadores y xilófagos en corteza de Hibiscus rosa-sinensis procedente de La Molina (Lima) y Guazuma crinita procedente de Puerto Inca (Huánuco).
Materiales y métodos
Áreas de estudio
Las muestras de cucarda fueron obtenidas en el campus de la Universidad Nacional Agraria La Molina (Lima, La Molina), 12°04′40″S 76°54′40″O, 240 m. de altitud, temperatura promedio anual (10.8 – 31.7 °C), precipitación anual (24 mm), con una vegetación mixta de jardines ornamentales y campos de cultivo.
Las muestras de bolaina blanca fueron obtenidas en una plantación forestal de esta especie a orillas del río Pachitea (Huánuco, Puerto Inca), 9°22′52″S 74°57′51″O, 330 m. de altitud, temperatura promedio anual (20.5 – 32 °C), precipitación anual (1200 mm), con vegetación natural de bosque tropical lluvioso.
Estudio de las asociaciones entre xilófagos y predadores. Las muestras que nos permitieron cumplir con el objetivo de la presente investigación, fueron tomadas en los meses de abril a junio del 2015. En cucarda se examinaron diez secciones transversales (5 cm. de diámetro) y longitudinales (10 cm. de longitud) de ramas secas, extraídas de plantas con signos de daño provocado por insectos xilófagos. Las ramas fueron examinadas inmediatamente después de su extracción (Junio 2015) (Figura 1).

En bolaina blanca se examinaron lugares de ingreso en la corteza (Figura 2 A), en diez secciones transversales (20 cm. de diámetro) (Figura 2 B) y longitudinales (25 cm. de longitud) (Figura 2 C) de troncos semi-secos (70% humedad), un mes después de ser cosechados en campo. (Abril, 2015).

En ambos casos, la infestación de los coleópteros xilófagos fue comprobada a través de la observación de las galerías encontradas en la madera, y el hallazgo de larvas en el interior de éstas. Las asociaciones con los coleópteros predadores fueron establecidas, por ser hallados en las mismas galerías y por los hábitos alimenticios reseñados en la bibliografía consultada.
Fotografías
Las fotos de las especies de insectos fueron obtenidas utilizando un microscopio estereoscópico Carls Zeiss 2000 C, trilocular, al cual se acopló una cámara fotográfica Canon 7D. Se tomaron una serie de fotos en planos diferentes, las cuales fueron apiladas en una sola imagen con el programa Helicon focus 5.1.
Identificación taxonómica
Los insectos colectados fueron matados con acetato de etilo, montados en alfileres entomológicos usando puntas y luego etiquetados, según la técnica descrita por Triplehorn & Johnson (2005) para insectos pequeños.
Para el reconocimiento de los diferentes taxones, se utilizaron las claves taxonómicas de: Familias y géneros de Coleoptera (Arnett et al., 2002; Triplehorn and Johnson, 2005), géneros y especies de Histeridae (Bickhardt, 1916; Mazur, 2001), géneros y especies de Bothrideridae y Colydiidae (Pascoe, 1863; Reitter, 1877), géneros y especies de Scolyitinae, (Wood, 2007), especies de Euplatypus (Atkinson, 1989) y, géneros y especies de Bostrichidae (Lesne, 1899).
Los especímenes debidamente montados fueron codificados (UA-número-año) e incorporados a la colección del Museo de Entomología Klaus Raven Büller (MEKRB) de la Universidad Nacional Agraria La Molina (UNALM)
Resultados
Las especies de coleópteros xilófagos y predadores halladas en los dos hospederos vegetales examinados se enumeran en la Tabla 1. A continuación, para cada especie se presentan datos métricos y morfológicos obtenidos al examinar los especímenes, así como datos de hábitos y distribución basados en la revisión bibliográfica.
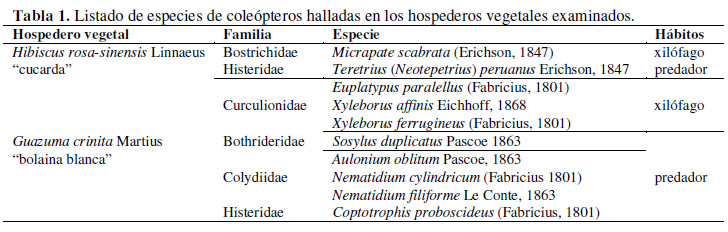
Coleópteros en "cucarda" (Hibiscus rosa-sinensis Linnaeus) Familia Bostrichidae Micrapate scabrata (Erichson, 1847) UA-041-2015 (Figura 3) (Long: 4.09 – 4.28 mm; ancho: 1.36 – 1.5 mm; 3 especímenes). Morfología: Cabeza insertada profundamente en el protórax. Clava antenal con depresiones redondeadas en todos los segmentos, primer y segundo segmento aplanado lateralmente. Clípeo con ángulos anteriores obtusos y frente ligeramente convexa detrás de los ojos. Pronoto con margen anterior ligeramente emarginado, proceso intercoxal de forma triangular, cavidades metacoxales completamente marginadas sobre el primer esternito abdominal visible. Metatarsos tan o más largos que las tibias. Hábitos: Las larvas y adultos del género Micrapate Casey barrenan ramas secas y semisecas de arbustos y árboles (Arnett et al., 2002). Distribución: Panamá, Colombia, Ecuador, Perú, Bolivia y Chile (Blackwelder, 1944-1957; Borowski &Wegrzynowicz, 2007). Familia Histeridae. Teretrius ( Neotepetrius) peruanus Erichson, 1847 UA-035-2015 (Figura 4) (Long: 2.35 – 2.82 mm; ancho: 1.18 – 1.36 mm; 7 especímenes). Morfología: Cuerpo cilíndrico, color negro no metálico y pigidio convexo. Cavidades antenales situadas sobre los hipómeros y élitros sin estrías. Hábitos: Las especies del genero Teretrius Erichson han sido colectadas en galerías de escolítidos, bostríquidos y anóbidos (Mazur, 2001). En Chile, fue encontrada en ramas secas de Prosopis tamarugo F.Philippi, también asociado con M. scabrata (Erichson1847) (Arriagada, 2015). Distribución: Perú (Mazur, 2011). Recientemente reportada para la provincia del Tamarugal en Chile (Arriagada, 2015). Coleópteros en bolaina blanca (Guazuma crinita Martius) Familia Curculionidae Subfamilia Platypodinae Euplatypus paralellus (Fabricius, 1801) UA-042- 2015 (Figura 5 y Figura 6) machos (Long: 3.81 – 4.09 mm; ancho: 1.08 – 1.18 mm; 5 especímenes) hembras (Long: 4.0 – 4.47 mm; ancho: 0.94 – 1.22 mm; 5 especímenes). Morfología: Pronoto sin poros conspicuos en ambos sexos. En los machos, la base del declive elitral con estrías profundamente marcadas y sub-iguales en ancho a las interestrías. Hábitos: Las especies del género Euplatypus Wood son barrenadoras, que pueden dañar incluso la parte medular de los troncos (Atkinson, 1989). Distribución: África, Asia, América, Eurasia y Oceanía. En Sudamérica, fue reportada para Argentina, Bolivia, Brasil, Chile, Colombia, Ecuador, Guyana Francesa, Paraguay, Perú, Surinam, Trinidad, Uruguay y Venezuela. En Perú, su distribución conocida incluye los departamentos de Amazonas, Loreto, Madre de Dios y San Martín (Atkinson, 2016). Subfamilia Scolytinae Xyleborus affinis Eichhoff, 1868 UA- 043-2015 (Figura 7) (Long: 2.02 – 2.35 mm; ancho: 0.75 – 0.85 mm; 5 especímenes) Morfologia: Declividad elitral ocupa entre 30 a 40% de la longitud del élitro y con pequeños tubérculos sobre las interestrías 1 y 3. Hábitos: Las especies del género Xyleborus Eichhoff se alojan debajo de la corteza, perforando galerías en la parte más periférica del cambium, donde pueden observarse agujeros (Viana, 1965) (Figura 2). Distribución: África, Asia, Norteamérica, América, Eurasia y Oceanía. En Sudamérica, tiene distribución en Argentina, Bolivia, Brasil, Chile, Colombia, Ecuador, Guyana Francesa, Paraguay, Perú, Surinam, Uruguay y Venezuela. En Perú, su distribución fue registrada para los departamentos de Huánuco, Junín, Loreto, Madre de Dios, San Martín y Ucayali (Atkinson, 2016). También ha sido hallada en troncos de palmera cola de zorro en Lima (Huanca & Vergara, 2014). Xyleborus ferrugineus (Fabricius, 1801) UA-044- 2015 (Figura 8) (Long: 2.12 – 2.30 mm; ancho: 0.75 – 0.8 mm; 5 especímenes). Morfología: Declividad elitral con un pequeño dentículo en la primera interestría, con dos o más dentículos en la tercera interestría; cerca de la base un dentículo pequeño, en la parte media un dentículo distintivamente más grande que los otros. Hábitos: Las especies del género Xyleborus Eichhoff se alojan debajo de la corteza, perforando galerías en la parte más periférica del cambium, donde pueden observarse agujeros (Viana, 1965) (Figura 2). Distribución: África, América y Oceanía. En Sudamérica, se la ha registrado en Argentina, Bolivia, Brasil, Chile, Colombia, Ecuador, Guyana Francesa, Paraguay, Perú, Surinam, Trinidad, Uruguay y Venezuela. En Perú, es citada para los departamentos de Junín, Loreto, Madre de Dios, San Martín y Ucayali. (Atkinson, 2016). Familia Bothrideridae Sosylus duplicatus Pascoe 1863 UA-037-2015 (Figura 9) (Long: 4.47 - 4.79 mm; ancho: 0.94 - 1.03 mm; 2 especímenes). Morfología: cuerpo moderadamente aplanado, antenas con clava de dos antenómeros, procoxas contiguas, trocánteres pequeños y élitros con costillas. Hábitos: Las especies del genero Sosylus Erichson atacan las larvas de platipodinos. Son hipermetamórficos, es decir presentan estadíos larvales modificados para un estilo de vida como ectoparásitos (Arnett et al., 2002). Distribución: Neotropical (Centro y Sudamérica), México, Guatemala, Panamá, y Brasil (Blackwelder, 1944-1957). Se cita por primera vez para el Perú, incrementándose de esta manera la distribución geográfica de esta especie para Sudamérica. Familia Colydiidae Aulonium oblitum pascoe, 1863 UA-038-2015 (Figura 10) (Long: 3.57 mm; ancho: 1.08 mm; 1 espécimen). Morfología: Cuerpo de color marrón-rojizo oscuro y brillante, con antenas y patas de color rojizo. Cabeza más estrecha que el Pronoto, con puntuación fina y una línea impresa lateralmente y anterior a cada ojo. Pronoto con puntuación fina, casi cuadrado, lados subparalelos, con cuatro líneas impresas, con dos tubérculos anteriores y escutelo transverso. Élitros con puntuación más fina que la pronotal, cada uno con ocho filas de puntuaciones. Hábitos: Las especies del género Aulonium Erichson están asociadas a las galerías de escolitinos, son predadores facultativos de sus larvas (Arnett et al., 2002). Distribución: Neotropical (Sudamérica). Brasil y Argentina (Blackwelder, 1944-1957). Se cita por primera vez para el Perú, incrementándose de esta manera la distribución geográfica de esta especie para Sudamérica. Nematidium cylindricum (Fabricius 1801) UA-039-2015 (Figura 11) (Long: 4.09 mm; ancho: 0.75 mm; 1 espécimen). Morfología: Cuerpo alargado, delgado y cilíndrico. Cabeza con margen arqueado en la frente, antenas con clava de dos antenómeros. Diámetro del ojo equivalente a 2/3 la altura de la base de la cabeza. Pronoto excavado lateralmente. Tarsómeros basales alargados. Hábitos: Las especie del genero Nematidium Erichson han sido halladas en galerías de platipodinos, donde se alimentan de sus larvas. Su forma corporal está bien adaptada a los túneles de sus presas (Arnett et al., 2002). Distribución: Neotropical (Centro y Sudamérica), Cuba, Colombia y Brasil. Se cita por primera vez para el Perú, incrementándose de esta manera la distribución geográfica de esta especie para Sudamérica. Nematidium filiforme Le Conte, 1863 UA-040- 2015 (Figura 12) (Long: 5.73 mm; ancho: 0.89 mm; 1 espécimen). Morfología: Cuerpo alargado, delgado y cilíndrico. Cabeza con margen arqueado en la frente, antenas con clava de dos antenómeros. Diámetro del ojo equivale a 1/2 la altura de la base de la cabeza. Pronoto excavado lateralmente. Tarsómeros basales alargados. Hábitos: Las especie del genero Nematidium Erichson han sido halladas en galerías de platipodinos, donde se alimentan de sus larvas. Su forma corporal está bien adaptada a los túneles de sus presas (Arnett et al., 2002). Distribución: Neártico (Estados Unidos), Neotropical (Centro y Sudamérica) (Blackwelder, 1944-1957). Se cita por primera vez para el Perú, incrementándose de esta manera la distribución geográfica de esta especie para Sudamérica. Familia Histeridae Coptotrophis proboscideus (Fabricius, 1801) UA- 036-2015 (Figura 13) (Long: 2.54 – 2.73 mm; ancho: 0.85 – 0.94 mm; 4 especímenes).










Morfología: Cuerpo alargado, cilíndrico, pronoto casi tan largo como los élitros. Prosterno con escotadura lateral que recibe el funículo antenal. Metasterno con surco longitudinal profundo y con borde anterior redondeado. Protibias con diente fuerte en el margen externo.
Hábitos: Las especies del género Coptotrophis Lewis se alimentan de larvas de platipodinos, en días cálidos y soleados suelen encontrarse en grandes números sobre los troncos infestados (Mazur, 2001).
Distribución: Neotropical (Centro y Sudamérica) (Mazur, 2011). Se cita por primera vez para el Perú, incrementándose de esta manera la distribución geográfica de esta especie para Sudamérica.
Discusión
El presente trabajo es una primera aproximación al estudio de las asociaciones predador-presa para coleópteros de importancia forestal en Perú. Sin duda, inventarios más completos de este tipo de fauna pueden ser obtenidos con colectas sistemáticas, incluyendo variedad de plantas hospederas (ornamentales, maderables, etc.) en ecosistemas con distintas intensidades de manejo y en distintos pisos altitudinales.
El estudio de coleópteros de importancia forestal requiere el uso combinado de métodos especiales de colecta. La revisión de troncos infestados mediante cortes transversales y longitudinales, es útil para establecer asociaciones predador – presa, en tanto los especímenes son extraídos directamente del interior de las galerías. Sin embargo, el uso continuo de trampas de interceptación aérea y de emergencia es recomendable para realizar inventarios de las especies presentes en una localidad (Okland, 1996; Cocciufa et al., 2014). Por otra parte, las trampas embudo con feromonas han sido útiles en la descripción de las dinámicas poblacionales de las plagas forestales (Raty et al., 1995; Hayes et al., 2008).
Si bien las asociaciones entre predadores y presas en coleópteros de importancia forestal pueden establecerse mediante eventos de colecta, es más difícil determinar si los predadores reducen o controlan las poblaciones de xilófagos. Hasta el momento, no se ha descrito el uso de alguna especie de coleóptero predador como controlador biológico de plagas forestales, quizá porque su biología no es apta para la crianza masiva y posterior liberación. En cambio, los estudios a nivel de comunidades sugieren que la abundancia de coleópteros predadores está directamente relacionada con el estado de conservación de los bosques (Weslien & Schroeder, 1999; Erbilgin & Raffa, 2002). En tal sentido, una reciente revisión de este tema sugiere que el control biológico de las plagas forestales puede ser promovido a través de prácticas de manejo forestal que mantengan la estructura y composición vegetal tan próximas como sea posible a su condición natural (Klapwijk et al., 2016).
Conclusiones
1. En cucarda la asociación predador-presa se da entre el xilófago Micrapate scabrata (Erichson, 1847) y el predador Teretrius (Neotepetrius)peruanus Erichson, 1847 en La Molina-Lima.
2. En bolaina blanca la asociación predador-presa está compuesta por los xilófagos Euplatypus paralellus (Fabricius, 1801), Xyleborus affinis Eichhoff, 1868 y Xyleborus ferrugineus (Fabricius, 1801) y los predadores Aulonium oblitum Pascoe, 1863, Coptotrophis proboscideus (Fabricius, 1801), Nematidium cylindricum (Fabricius 1801), Nematidium filiforme Le Conte, 1863 y Sosylus duplicatus Pascoe 1863.
3. Las especies A. oblitum Pascoe, 1863, C. proboscideus (Fabricius, 1801), N. cylindricum (Fabricius 1801), N. filiforme Le Conte, 1863 y S. duplicatus Pascoe 1863 son nuevos registros para la fauna peruana.
Literatura citada
Arnett R.H., Thomas M.C., Skelley P.E. & Frank J.H. (eds). 2002. American Beetles. Vol 2. CRC Press. (U.S.A). 861 p. [ Links ]
Arriagada G. 2015. Nuevos registros de Histeridae para Chile (Coleoptera: Histeridae). Revista Chilena de Entomología, 40: 51 – 55. [ Links ]
Atkinson T.H. 1989. The species of Platypus of Florida (Coleoptera: Platypodidae). Entomology Circular No. 321 Fla. Dept. Agric. & Consumer Services. Division of Plant Industry. [ Links ]
Atkinson T.H. 2016. Bark and Ambrosia Beetles. United States Forest Service. http://www.barkbeetles.info/index.php. [ Links ]
Bahillo de la Puebla P., López-Colón J.I. & Baena M. 2007. Los Bostrichidae Latreille, 1802 de la fauna íbero-balear (Coleoptera). Heteropterus, 7(2): 147 – 227. [ Links ]
Bickhardt H. 1916. Histeridae. In: Wytsman P. (ed). Genera Insectorum, fasc. 166a: 1-112. La Haye. [ Links ]
Blackwelder R.E. 1944-1957. Checklist of the coleopterous insects of Mexico, Central America, the West Indies, and South America. Bulletin of the United States National Museum, 185 (parts 1-6): xii – 1492. [ Links ]
Borowski J. & Wegrzynowicz P. 2007. World Catalogue of Bostrichidae. (Coleoptera). Editorial Mantis. Olsztyn. Poland. 247p. [ Links ]
Clarke S.A. & Menard R.D. 2006. Predation of an ambrosia beetle (Coleoptera: Platypodidae) by a checkered beetle (Coleoptera: Cleridae) congregating on pines containing brood adult southern pine beetles (Coleoptera: Curculionidae). Journal of Entomological Science, 41(3): 257 – 260. [ Links ]
Cocciufa C., Gerth W., Luiselli L., Redolfi de Zan L., Cerretti P. & Carpaneto G. M. 2014. Survey of saproxylic beetle assemblages at different forest plots in central Italy. Bulletin of Insectology, 67 (2): 295 – 306. [ Links ]
Couturier G. & Tanchiva E. 1991. Xylosandrus compactus (Coleoptera: Scolytidae) nueva plaga del camu camu (Myrciaria dubia, Myrtaceae), en la Amazonía peruana. Revista Peruana de Entomología, 34: 31 – 32. [ Links ]
Delgado C. & Couturier G. 2010. Xylosandrus compactus (Coleoptera: Curculionidae: Scolytinae), a new pest of Swietenia macrophylla in the Peruvian Amazonia. Boletín de la Sociedad Entomológica Aragonesa, 47: 441.– 443. [ Links ]
Dourojeanni M. 1963. Introducción al estudio de los insectos que afectan la explotación forestal en la Selva Peruana. Revista Peruana de Entomología, 6(1): 27 – 38. [ Links ]
Dourojeanni M. 1965. Nuevos registros para el Perú de coleópteros de interés forestal. Revista Peruana de Entomología, 8(1): 158 – 159. [ Links ]
Dourojeanni M. 1967. Reflexiones sobre la enseñanza de la entomología forestal en América Latina. Revista Peruana de Entomología, 10(1): 96 – 106. [ Links ]
Erbilgin N. & Raffa K. 2002. Association of declining red pine stands with reduced populations of bark beetle predators, seasonal increases in root colonizing insects, and incidence of root pathogens. Forest Ecology and Management, 164: 221 – 236. [ Links ]
Hayes C.J., De Gomez T.E., Clancy K.M., Williams K.K., Mc Millin J.D. & Anhold J.A. 2008. Evaluation of funnel traps for characterizing the bark beetle (Coleoptera: Scolytidae) communities in Ponderosa Pine forests of North-Central Arizona. Journal of Economic Entomology, 101(4): 1253 – 1265. [ Links ]
Huanca J. & Vergara C. 2014. Insectos xilófagos y ácaros en corteza de palmera cola de zorro (boudyeta bifurcata) en Cieneguilla Lima, Perú. Resúmenes LVI convención Nacional de Entomología. Tumbes (Perú). [ Links ]
Klapwijk M.J., Bylund H., Schroeder M. & Bjorkman C. 2016. Forest management and natural biocontrol of insect pests. Forestry, 0: 1 – 10, doi:10.1093/forestry/cpw019. [ Links ]
Lesne P. 1899. Revision des Coléopteres de la famille des Bostrychides. 3e mémoire. Annales de la Société Entomologique de France, Paris, 67(1898): 438 – 621. [ Links ]
Mazur S. 2001. Review of the Histeridae (Coleoptera) of Mexico. Dugesiana, 8(2): 17 – 66. [ Links ]
Mazur S. 2011. A concise catalogue of the Histeridae (Insecta: Coleoptera). Warsaw University of Life Sciences. SGGW Press. Poland. 332 p. [ Links ]
Núñez-Sacarías E. 1994. Insectos del algarrobo (Prosopis spp.) en el Perú: costa norte (Piura) y costa central (Ica). Revista Peruana de Entomología, 36: 69 – 83. [ Links ]
Okland B. 1996. A comparison of three methods of trapping saproxylic beetles. European Journal of Entomology, 93: 195 – 209. [ Links ]
Pascoe F.P. 1863. List of the Colydiidae collected in the Amazon Valley by H. W. Bates, Esq., and descriptions of new species. Journal of Entomology, 2: 79 – 99. [ Links ]
Peña J.E., Weihman S.W., McLean S., Cave R.D., Carrillo D., Duncan R.E., Evans G., Krauth S., Thomas M.C., Lu S.S., Kendra P. E. & Roda A.L. 2015. Predators and parasitoids associated with Scolytinae in Persea species (Laurales: Lauraceae) and other Lauraceae in Florida and Taiwan. Florida Entomologist, 98(3): 903 – 910. [ Links ]
Raty L, Drumont A, De Windt N. & Grégoire J.C. 1995. Mass trapping of the spruce park beetle Ips typographus L.: traps or trap trees? Forest Ecology and management, 78: 191 – 205. [ Links ]
Reitter E. 1877. Beitrag zur Kenntnis der Colydier. Entomologische Zeitung, 38: 323 – 356. [ Links ]
Triplehorn C.A. & Johnson N.F. 2005. Borror and DeLong's Introduction to the Study of Insects. Seventh Edition. Thompson Brooks/Cole (U.S.A.). 864 p. [ Links ]
Viana M.J. 1965. Datos ecológicos de Scolytidae argentinos (Coleoptera). Revista de la Sociedad Entomológica Argentina. 27(1-4):119 – 130. [ Links ]
Weslien J. & Schroeder L.M. 1999. Populations levels of bark beetles and associated insects in managed and unmanaged spruce stands. Forest Ecology and Management, 115: 267 – 275. [ Links ]
Wolfenbarger D.O. 1973. Ataque del escarabajo Xylosandrus compactus (Eichhoff) al aguacate, con datos sobre su control. Revista Peruana de Entomología, 16(1): 1 – 2. [ Links ]
Wood S.L. 2007. Bark and ambrosia beetles of South America (Coleoptera: Scolytidae). Monte L. Bean Sci. Mus.,Provo, Utah: 1 – 900. [ Links ]
Presentado: 12/10/2016
Aceptado: 12/10/2017














