Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Ecología Aplicada
Print version ISSN 1726-2216
Ecol. apl. vol.18 no.1 Lima Jan./Jun 2019
http://dx.doi.org/10.21704/rea.v18i1.1310
ARTICULO ORIGINAL
Influencia de la temperatura en el crecimiento de un consorcio microbiano y su capacidad bioxidativa sobre el hierro de la calcopirita
Influence of temperature on the growth of a microbian consortium and its bioxidative capacity on the iron of calcopirita
Sandra Delgado1 y Daladier Castillo2
1 Universidad Nacional Jorge Basadre Grohmann de Tacna, Perú. sandraveronicadc@gmail.com
2 Universidad Nacional Jorge Basadre Grohmann de Tacna, Perú. daladiercastillo@hotmail.com
Resumen
Se determinó la influencia de la temperatura sobre el crecimiento microbiano y la biooxidación del hierro presente en la calcopirita por un consorcio microbiano. Se trabajó con muestras de escombreras con calcopirita procedentes de los botaderos de las pilas de lixiviación de la empresa minera Southern Peru Copper. Estas muestras fueron sometidas a cultivo de enriquecimiento y a un subsiguiente cultivo en caldo 9K para obtener el consorcio microbiano biolixiviante como inóculo. Se realizaron 4 tratamientos experimentales a 25, 40, 55 y 70 °C, con una doble repetición. Cada tratamiento contuvo el inóculo microbiano, el medio de cultivo 9K y la calcopirita. El tratamiento que obtuvo una mayor biooxidación de Fe2+ y mayor concentración microbiana fue el tratamiento experimental de 70 °C. Se determinó estadísticamente que la temperatura no tuvo influencia en el incremento de biomasa ni en la biooxidación del hierro de la calcopirita.
Palabras clave : biolixiviación, biooxidación, calcopirita, microorganismos biolixiviantes.
Abstract
The influence of the temperature on the microbial growth and the biooxidation of the iron present in chalcopyrite by a microbial consortium was determined. We worked with chalcopyrite- rich samples from the tailings of the leach piles of the Southern Peru Copper mining company. These samples were subjected to an enrichment culture and a subsequent 9K broth culture to obtain the microbial bioleaching consortium as inoculum. There were 4 experimental treatments at 25, 40, 55 and 70 °C, with a double repetition. Each treatment contained the microbial inoculum, the 9K culture medium and chalcopyrite ore. The treatment that obtained the greatest biooxidation of Fe2+ and the highest microbial concentration was the experiment carried out at 70 °C. It was statistically determined that the temperature had no influence on the biomass increase or on the biooxidation of iron from copper pyrite.).
Key words: bioleaching, biooxidation, copper pyrite, microbial bioleaching.
Introducción
En el Perú la actividad minera es la fuente principal de ingresos, sin embargo, ésta genera una gran contaminación, como es el caso de la explotación de sulfuros que puede producir un elevado drenaje ácido de mina, la cual está siendo afrontada con nuevas alternativas, como el uso de bacterias biolixiviantes. Estas se ubican en el mineral de interés mostrando una adaptación única frente al medio ácido (Quiliche et al., 2017).
La biolixiviación es la solubilización de metales, a partir de minerales, bajo la acción de bacterias y es un método de gran aceptación para la recuperación posterior de los metales (Bosecker, 1997; Olson et al., 2003; Acevedo & Gentina, 2005; Saavedra & Corton, 2014). Este método es una alternativa económica para la recuperación de metales a partir de sulfuros, especialmente en depósitos de baja ley (Porro et al., 1988; Rivera et al., 2011) y es ambientalmente aceptable (Constanza, 2000). Uno de los casos en los que más habitualmente se aplica la recuperación mediante liviviación microbiana es para la obtención de cobre a partir de la calcopirita (Fu et al., 2008; Dorado et al., 2012; Krok et al., 2013). La calcopirita (CuFeS2) es el mineral de cobre más abundante en la naturaleza, pero a su vez es altamente refractaria a la lixiviación; es por eso que aún sigue siendo un reto importante la aplicación de la hidrometalurgia a este mineral (Zy et al., 2000; Bravo, 2016). Es la fuente de cobre más abundante en el mundo.
La existencia de importantes recursos de baja ley, remanentes de la explotación de minerales, sumado a los primeros indicios de agotamiento de las reservas minerales, ha impulsado a los investigadores a buscar técnicas rentables y eficientes para la recuperación de metales, entre ellos, el cobre. Entre estas técnicas, la biolixiviación, un proceso natural de disoluciones, resulta de la acción de bacterias específicas para extraer metales de los minerales. El producto que origina es una solución ácida en donde está el metal en su forma soluble (Agudelo et al., 2002). Esta es un proceso rentable (Ballester et al., 1988). Los microorganismos asociados a este proceso se clasifican según la temperatura a la que se desarrollan de forma óptima en mesófilos (˂ 40 °C), termófilos moderados (entre los 40 y 55 °C) e hipertermófilos (entre los 55 y 85 °C) (Brierley, 2000). En la biolixiviación intervienen bacterias mesófilas Acidithiobacillus ferrooxidans, At. Thiooxidans, Leptospirillum ferrooxidans y Leptospirillum ferrifilium, termófilas moderadas At. Caldus, Leptospirillum thermoferrooxidans y Sulfobacillus y termófilas Sulfolobus, Acidianus, Metallosphaera y Sulfisphaera, entre otras (Rohwerder et al., 2003
En el Perú la biolixiviación es una tecnología que está siendo poco a poco implementada en los diversos yacimientos mineros (Nagy et al., 2007; Schippers et al., 2008). En Tacna, en el yacimiento minero de Toquepala propiedad de la empresa Southern Peru Copper se están dando los primeros pasos en las técnicas de biolixiviación estando aún en la etapa de experimentación en laboratorio.
En un proceso de biolixiviación es importante el uso de consorcios nativos (Saavedra & Corton, 2014). El microorganismo presente en el consorcio, genera un ambiente favorable y adecuado para el desarrollo del otro, logrando una mayor interacción, un espacio adecuado para su desarrollo y su actividad lixiviante (Acevedo & Gentina, 2005). L. ferroxidans y los oxidadores de azufre Thiobacillus thiooxidans o Thiobacillus caldos (termófilos moderados) han mostrado una más eficiente disolución de la calcopirita que en cultivos solos. El proceso de sinergismo propicia sincronía metabólica a las bacterias termófilas moderadas Sulfobacillus spp. y A. ferroxidans que oxidan el azufre (Juárez, 2004).
Entre todos los microorganismos lixiviantes presentes en los consorcios, los más empleados en biolixiviación son Acidithiobacillus ferroxidans y Acidithiobacillus thiooxidans, encontrándose también Leptobacillus ferroxidans. Estos microorganismos presentan, entre sus características principales, que pueden vivir en ambientes hasta de un pH de 1 y son quimiolitoautótrofos, ya que tienen como fuente de energía componentes inorgánicos. Por ejemplo, una de las principales características de Thiobacillus ferrooxidans, que lo hacen el microorganismo más factible para ser utilizado en la oxidación biológica de minerales de hierro y azufre, para recuperar metales de interés económico, es su capacidad para oxidar selectivamente al Fe2+ presente en los minerales refractarios de la clase de los sulfuros como la pirita y la arsenopirita (Orrantia, 1997).
La biolixiviación microbiana ocurre con diferentes factores acondicionados como son el pH bajo (1-2), los nutrientes, la presencia de metales pesados, la temperatura, la luz, oxígeno y dióxido de carbono. La biooxidación guarda relación directa con la biolixiviación (Deng et al., 2017). Estos microorganismos utilizan como fuente primaria de energía las formas reducidas de hierro y azufre, y el CO2 como fuente de carbono para su síntesis celular (Rivadeneira, 2011).
Este trabajo tuvo como objetivo determinar la influencia de la temperatura sobre el crecimiento microbiano y la biooxidación del hierro presente en la calcopirita por un consorcio microbiano.
Materiales y métodos
Materiales
El mineral lixiviado se tomó de los botaderos de lixiviación procedentes del procesamiento de menas de cobre de la mina de Toquepala de la empresa Southern Peru Copper, ubicada en Toquepala en el departamento de Tacna. Se seleccionaron 5 botaderos con mayor actividad microbiana. Se estableció por botadero un área de 1 m2 considerando puntos con actividad microbiana. Se colectaron 5 muestras (una por botadero), cada muestra contuvo 3 kg de mineral lixiviado recogido del área de 1 m2 con ayuda de una pala, se dividió el botadero en subunidades homogéneas dentro de las cuales se tomaron muestras completamente al azar. Estas fueron transportadas en baldes al laboratorio de Micología Virología de la Facultad de Ciencias de la Universidad Nacional Jorge Basadre Grohmann para su procesamiento.
Se tomó, por cada muestra, 1.5 kg del mineral lixiviado, el cual fue sumergido en 4 litros de medio líquido 9K Silverman & Lundgren (1959) modificado, a pH 1.8 ajustado con H2SO4, en baldes de 5 l de capacidad, los cuales se incubaron a temperatura ambiente, durante 15 días con una aireación siguiendo el método de Saavedra (2009).
Obtención del inóculo microbiano biolixiviante
En placas Petri con medio 9K sólido sobre su superficie se sembró, por extensión, diseminando 0.1 ml del cultivo de enriquecimiento de mineral con ayuda de un asa de Drigalsky. Las placas se incubaron a temperatura ambiente (25 ºC) durante 15 a 20 días, tiempo en que aparecieron las colonias bacterianas compatibles a Acidithiobacillus ferroxidans por haberse presentado como gram negativo con precipitados de color rojo naranja.
Del cultivo de enriquecimiento, se tomaron 50 ml y se inoculó a 500 ml del medio de cultivo 9k contenido en un biorreactor de 1 000 ml de capacidad con una aireación de 1 vvm y se incubó a temperatura ambiente hasta que el cultivo estuvo en fase logarítmica, determinada por recuentos en cámara de Neubauer donde se observó que la dinámica de crecimiento fue constante. Se realizó un recuento final de células en cámara de Neubauer para establecer la concentración inicial de células del inóculo.
Preparación del material a lixiviar en la experimentación
Se aplicó la técnica del cono y cuarteo a todo el material para tomar una muestra significativa. La muestra se pulverizó por molienda en el molino de bolas del laboratorio de procesos de la Escuela
Profesional de Ingeniería Metalúrgica de la Universidad Nacional Jorge Basadre Grohmann. El material molido se tamizó, usando la malla Tyler 100 y se separó en cantidades de 77 g. El material fue concedido como calcopirita por Southern Peru Copper.
Se instalaron 12 biorreactores aireados de capacidad de 1 litro de PVC, considerando en la experimentación 4 tratamientos experimentales (25, 40, 55 y 70 ºC) cada una con 2 repeticiones y 4 tratamientos controles sin repetición. En cada biorreactor del tratamiento experimental se adicionaron 700 ml del medio 9K Silverman & Lundgren (1959) modificado, 70 ml del inóculo microbiano biolixiviante, 77 g del mineral calcopirita (10% del volumen total) y aireación de 1 vvm.
El biorreactor de los tratamientos controles de cada temperatura tuvo 70 ml de medio 9K en lugar de inóculo microbiano, y todos los demás componentes presentes en los tratamientos experimentales. La incubación se realizó de manera correspondiente a la temperatura de cada uno de los tratamientos.
Evaluación de la experimentación
Para la determinación de la concentración de biomasa (recuento celular) se realizó el conteo celular cada 24 horas del medio contenido en cada biorreactor con previa dilución de 10-1. El conteo se realizó con ayuda de una cámara de Neubauer y un microscopio de campo claro. Los conteos se graficaron expresados en unidades logarítmicas de cel mL-1 versus el tiempo, para establecer la curva de crecimiento microbiano y en ella el valor máximo, dado por el valor más alto de concentración microbiana.
Para la evaluación del Fe total y Fe III por el método de espectrofotometría se siguió el método propuesto por Cabaña (2005).
Se realizó cada 48 horas desde el inicio de la fermentación en el laboratorio de Química general de la Universidad Nacional Jorge Basadre Grohmann. La determinación de Fe2+ se realizó por diferencia de Fe total con el Fe III:
Fe II = Fe total - Fe III
La evaluación de la biolixiviación del cobre se hizo por absorción atómica. Las muestras fueron tomadas cada 24 horas. Para el análisis estadístico se aplicó en el programa de Excel el ANOVA para establecer la diferencia significativa entre los tratamientos de concentración microbiana como el de los de biooxidación de Fe2+. Se determinó en el programa Excel la correlación entre el crecimiento microbiano, la biooxidación del Fe2+ y la biolixiviación del cobre.
Resultados
Determinación de concentración Microbiana
Se observó que la mayor concentración microbiana se dio a 70 °C y la menor a 25 °C (Tabla 1).
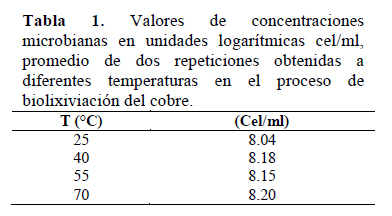
Se observa que la mayor concentración microbiana dada a la temperatura de 70 °C se dio a las 312 horas de iniciado el proceso de biolixiviación del cobre (Figura 1).
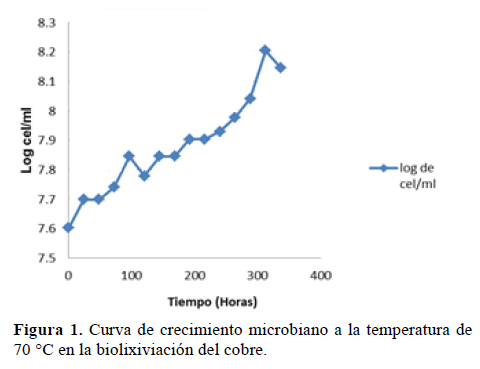
Por análisis de varianza, el Valor- P de 0.77 obtenido indica que no hay una significancia estadística de diferencia entre los valores de máximas concentraciones microbianas de los tratamientos con un 95% de nivel de confianza. Estadísticamente la temperatura no ejerce influencia sobre la concentración microbiana.
Determinación del Hierro III
Se muestra que la mayor concentración de Fe III se dio a 70 °C y la menor a 40 °C (Tabla 2).
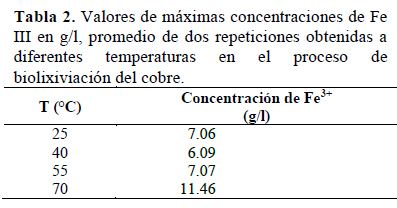
Se observa que la mayor formación de Fe III se dio a la temperatura de 70 °C, a las 144 horas después del inicio del proceso de biolixiviación del cobre (Figura 2) Por análisis de varianza el Valor- P de 0.11 obtenido indica que no hay una significancia estadística de diferencia entre los valores de máximas concentraciones de Fe III de los tratamientos con un 95% de nivel de confianza. Estadísticamente la temperatura no ejerció influencia sobre la concentración de Fe III.
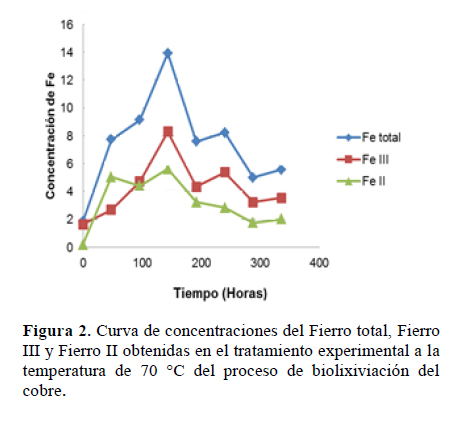
Determinación de la biolixiviación de cobre
Se hizo en el tratamiento experimental donde se apreció una mayor biooxidación del Hierro II, es decir, en el tratamiento de 70 ºC.
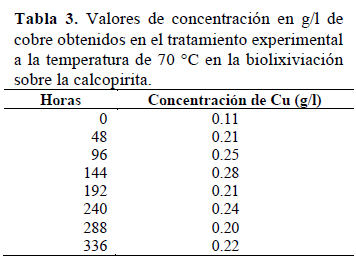
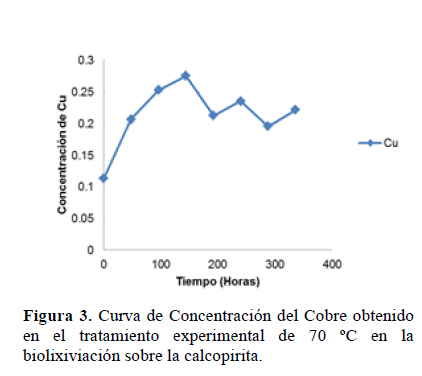
Se observa que la mayor concentración de cobre biolixiviado fue de 0.28 alcanzado a las 144 horas de iniciado el proceso a 70 °C (Tabla 3) (Figura 3).
Determinación de correlación
Se observa una correlación entre el crecimiento microbiano, la biooxidación del Fe II y la biolixiviación de cobre en el tratamiento a 70 °C con un valor de alrededor de 0.9.
Discusión
El medio líquido 9K (Silverman & Lundgren, 1959) modificado, empleado para biolixiviantes, fue apropiado y permitió el crecimiento y desarrollo adecuado del cultivo microbiano biolixiviante; hubo poca producción de jarosita (precipitados amarillo naranja) en el biorreactor, la misma que, impide el crecimiento de las bacterias y por tanto afecta la biolixiviación. En el caso del pH para el proceso de la calcopirita, el comportamiento en el pH fue muy estable en todo el proceso de adaptación, presentando un ligero incremento al inicio de todas las etapas, explicado como la adaptación de los microorganismo al mineral, el cual se estabiliza rápidamente (Meruane & Vargas, 2003). Este comportamiento da indicios de una buena adaptación y actividad bacteriana (Tekeuchi & Susuki, 1994). La aireación de 1vvm utilizada fue la apropiada para la fermentación del desarrollo microbiano; estas bacterias necesitan un ambiente con oxígeno (1-1.5 vvm) para su crecimiento microbiano como para realizar la biolixiviación. La variación estadísticamente no significativa de las concentraciones microbianas a diferentes temperaturas indica que la concentración microbiana no estuvo influenciada por la temperatura. Es posible esto se deba a que los microorganismos presentes en el inóculo microbiano todos fueron mesófilos considerando que para obtener el inóculo tuvo que hacerse un cultivo de enriquecimiento seguido de un subcultivo a temperatura ambiente (temperatura mesofílica) que hizo que prevalecieran los microorganismos mesófilos. Los microorganismos que se presentan en un mineral para la biolixiviación pueden ser mesófilos (desarrollan a menos de 40 oC) y termófilos (desarrollan entre 40 a 85 oC) (Brierley, 2000). Entre los mesófilos se tiene a Acidithiobacillus ferrooxidans, Leptospirillum ferrooxidans, Thiobacillus thiooxidans, Leptospirillum ferrifilium; y entre los termófilos a Sulfolobus, At. caldus, Leptospirillum thermoferrooxidans, Sufobacillus (Ballester et al., 1988) (Menadier & Maurice, 2009).
Es observable que estadísticamente la concentración de hierro III como producto de la biooxidación del hierro presente en la calcopirita tampoco estuvo influenciada por la temperatura. Es de entrever se deba también a que los microorganismos actuantes son mesófilos, una explicación similar a la dada para la falta de variación estadística de la concentración microbiana.
Los incrementos de concentración microbiana y hierro III a medida que aumenta la temperatura es posible se deba a que la actividad microbiana tanto reproductiva como oxidativa se incrementa a medida que aumenta la temperatura. Se tiene el reporte que la actividad microbiana del suelo, a través de la producción de CO2, se incrementó a medida que la temperatura aumentó (Ramos & Zúñiga, 2008).
Conclusiones
En las condiciones trabajadas se concluye que la temperatura no tuvo influencia de incremento en el crecimiento del cultivo microbiano biolixiviante ni en la biooxidación del hierro presente en la calcopirita.
Agradecimientos
Los autores agradecen a la Empresa Southern Peru Copper por haber facilitado el mineral con que se trabajó en esta investigación; así mismo a la Facultad de Ciencias y a la Facultad de Ingeniería, Escuela Profesional de Ingeniería metalúrgica, de la Universidad Nacional Jorge Basadre Grohmann de Tacna, Perú, por el personal técnico, laboratorios y equipos brindados para este trabajo como también al proyecto de investigación Aislamiento y aplicación de microorganismos biolixiviantes para la recuperación de minerales provenientes de la actividad minera en la región Tacna (aprobado con Resolución de Consejo Universitario Nº 10605-2013-UN/JBG) por el apoyo en materiales y logística para la investigación.
Literatura citada
Acevedo F. & Gentina J.C. 2005. Fundamentos y Perspectivas de las tecnologías Biomineras. Ed. Universitarias de Valparaíso. Pontificia Universidad Católica de Valparaíso. Chile. [ Links ]
Agudelo J., Betancur U., Martínez-Nieto W., Castañeda-Peña C.M., Castaño-Galvis M. & Largo M. 2002. Biolixiviación de minerales sulfurosos. Revista Facultad de Ingeniera, 27: 110-122. Universidad de Antioquia. URI:http://aprendeenlinea.udea.edu.co/revistas/index.php/ingenieria/article/view/326414Links ]udea.edu.co/revistas/index.php/ingenieria/article/view/326414" target="_blank">.
Ballester A., Gonzalez F. & Blazquez M. 1988. Biolixiviacion de menas naturales. Posibilidades actuales de utilización. Rev. Metal. Madrid, 24(2): 91-102. URI: http://webs.ucm.es/info/biohidro/Publicaciones%20del%20Grupo/Revista%20Metalurgia%201988,24,91.pdfLinks ]ucm.es/info/biohidro/Publicaciones%20del%20Grupo/Revista%20Metalurgia%201988%2C24%2C91.pdf" target="_blank">.
Bosecker K. 1997. Bioleaching: metal solubilization by microorganisms. FEMS Microbiology reviews, 20(3-4): 591-604. [ Links ]
Bravo D. 2016. Biolixiviación de calcopirita por Sulfobacillus acidophilus. Universidad de Chile. Santiago de Chile. [ Links ]
Brierley J. 2000. 2000 Wadsworth award lecture: Expanding role of microbiology in metallurgical processes. Mining Engineering, 52: 49-53. [ Links ]
Cabaña R. 2005. Determinación de sulfato ferroso por espectroscopia visible. Memoria, Encuentro de jóvenes investigadores. España. [ Links ]
Constanza L. 2000. Estudio piloto de aislamiento y fenotipificación de bacterias que participan en los procesos de biolixiviación, en las zonas mineras del Departamento de Boyaca. Tesis Doctoral. Universidad de Colombia. [ Links ]
Deng S., Gu G., Wu Z. & Xu X. 2017. Bioleaching of arsenopyrite by mixed cultures of iron-oxidizing and sulfur-oxidizing microorganisms. Elsevier. Chemosphere, 185: 403-411. DOI: https://doi.org/10.1016/j.chemosphere.2017.07.037Links ]org/10.1016/j.chemosphere.2017.07.037" target="_blank">.
Dorado A.D., Solé M., Lao C., Alfonso P. & Gamisans X. 2012. Effect of pH and Fe (III) ions on chalcopyrite bioleaching by an adapted consortium from biogas sweetening. Minerals Engineering, 39: 36-38. [ Links ]
Fu B., Zhou H., Zhang R. & Qiu G. 2008. Bioleaching of chalcopyrite by pure and mixed cultures of Acidithiobacillus spp. and Leptospirillum ferriphilum. International Biodeterioration & Biodegradation, 62(2): 109-115. [ Links ]
Juárez A. 2004. Biolixiviación de minerales sulfuro-ferroso en jales: aislamiento y caracterización de cultivos puros y mixtos de microorganismos involucrados. Tesis de Doctor en Biotecnología, Universidad de Colima. [ Links ]
Krok B., Schippers A. & Sand W. 2013. Copper recovery by bioleaching of chalcopyrite: A microcalorimetric approach for the fast determination of bioleaching activity. In: Advanced Materials Research, 825: 322-325. Trans Tech Publications. [ Links ]
Menadier S. & Maurice A. 2009. Biolixiviacion de piritas por Acidithiobacillus ferrooxidans y cepas nativas. Memoria para optar el título de Ingeniero Civil en biotecnología. Universidad de Chile. Chile. [ Links ]
Meruane G. & Vargas T. 2003. Bacterial oxidation of ferrous iron by Acidithiobacillus ferroxidans in the pH range 2.5-7.0. Hydrometallurgy, 71:149-158. [ Links ]
Nagy A.A., Gock E.D., Melcher F., Atmaca T., Hahn L., Schippers A. 2007. Biooxidation and cyanidation for gold and silver recovery from acid mine drainage generating tailings (Ticapampa, Perú). In: Schippers A., Sand W., Glombitza F., Willscher S. (Eds). Biohydrometallurgy: From the single cell to the environment. Advanced Materials Research, 20-21: 91-94. Trans Tech Publications. Switzerlands. [ Links ]
Olson G.J., Brierley J.A. & Brierley C.L. 2003. Bioleaching review part B. Applied microbiology and biotechnology, 63(3): 249-257. [ Links ]
Orrantia E. 1997. Aislamiento y caracterización de cepas de Thiobacillus ferrooxidans con alta resistencia a arsénico y su utilización en la recuperación de oro a partir de concentrados de pirita y arsenopirita. Tesis de doctorado en Ciencias con especialidad en Biotecnología, Universidad Autónoma de Nuevo León. [ Links ]
Porro S., Boiardi J. & Tedesco P. 1988. Biolixiviación de minerales argentinos de cobre. Rev. Metal. Madrid, 24(5): 297-302. URI: http://sedici.unlp.edu.ar/bitstream/handle/10915/29464/ARG-UNLP-0031317_01.pdf%3Fsequence%3D1Links ]unlp.edu.ar/bitstream/handle/10915/29464/ARG-UNLP-0031317_01.pdf%3Fsequence%3D1" target="_blank">.
Quiliche J.P., Rodríguez P., Cortez A., Silva M., Benites E., Díaz A. & Valverde M. 2017. Aislamiento e Identificación de Consorcios Bacterianos Acidófilos y Ferroso - Oxidantes de Entornos Mineros para Procesos de Biolixiviación de Calcopirita. Universidad Nacional José Faustino Sánchez Carrión. Lima Perú. Big Bang Faustiniano, 6(1): 30-34. URI: http://revistas.unjfsc.edu.pe/index.php/BIGBANG/article/download/51/49Links ]unjfsc.edu.pe/index.php/BIGBANG/article/download/51/49" target="_blank">.
Ramos E. & Zúñiga D. 2008. Efecto de la humedad, temperatura y pH del suelo en la actividad microbiana a nivel de laboratorio. Universidad Nacional Agraria La Molina. Lima-Perú. Ecología Aplicada, 7 (1,2). [ Links ]
Rivadeneira D. 2011. Adaptación de una cepa compatible con Acidithiobacillus ferrooxidans sobre concentrados de calcopirita (CuFeS2), esfarelita (ZnS) y galena (PbS). Universidad Nacional de Colombia. Revista Colombiana de Biotecnología, 13(1): 132-143. [ Links ]
Rivera R., Camejo P., Moya F., López-Méndez J. & Munguía-Bravo M. 2011. Estudio de biolixiviación de un mineral de sulfuros de cobre de baja ley con bacterias tio y ferro oxidantes en condiciones témofilas. Universidad Autónoma de México. Revista de la facultad de Ingeniería, 26: 65-73. [ Links ]
Rohwerder T., Gehrke T., Kinzler K. & Sand W. 2003. Bioleaching review part A: Progress in bioleaching: fundamentals and mechanisms of bacterial metal sulfide oxidation. Applied Microbiological Biotechnology, 63: 239-248. [ Links ]
Saavedra A. & Corton E. 2014. Biotecnología microbiana aplicada a la minería. Revista Química Viva, 13(3): 18-32. URI:http://www.quimicaviva.qb.fcen.uba.ar/v13n3/saavedra.pdfLinks ]quimicaviva.qb.fcen.uba.ar/v13n3/saavedra.pdf" target="_blank">.
Saavedra A. 2009. Solubilización del zinc a partir de! mineral esfalerita del Yacimiento minero "María Grimanesa" por lixiviación microbiana con cepas nativas. Tesis de grado. Universidad Nacional Jorge Basadre Grohmann. [ Links ]
Schippers A., Nagy A., Kock D., Melcher F. & Gock E. 2008. The use of FISH and real-time PCR to monitor the bioxidation and cyanidation for gold and silver recovery from a mine tailings concentrate (Ticapampa, Perú). Hydrometallurgy, 94(1-4): 77-81. DOI: https://doi.org/10.1016/j.hydromet.2008.05.022Links ]org/10.1016/j.hydromet.2008.05.022" target="_blank">.
Silverman M. & Lundgren D. 1959. Studies on the chemoautotrophic iron bacterium Ferrobacillus ferroxidans: an improved medium and harvesting procedure for securing high cel yields. Journal of Bacteriology, 77(5): 642-647. [ Links ]
Tekeuchi T. & Susuki I. 1994. Effect of pH sulfite oxidation by Thiobacillus cell with sulfurous acid or sulfur dioxide as posible sustrate. J. Bacteriol, 176(3): 913-916. [ Links ]
Zy L., Jeffrey M. & Lawson F. 2000. An electrochemical study of the effect of chloride ions on the dissolution of chalcopyrite in acidic solutions. Hydrometallurgy, 56(2):145-155. [ Links ]
Presentado: 12/03/2018
Aceptado: 07/06/2019














