Introducción
Xenopus laevis (Daudin, 1802) (Amphibia: Anura) es nativo del África subsahariana que en la segunda mitad del siglo XX fue exportada a otros continentes; en principio para ser usada en pruebas de laboratorio, entre las que destacan las pruebas de embarazo en los años 30 (Shapiro & Zwarenstein, 1934), y posteriormente para ser vendido como mascota (Tinsley & McCoid, 1996). Actualmente se encuentra distribuida como especie exótica invasora en 4 continentes: Asía, Europa, Norteamérica y Sudamérica (Measey et al., 2012). En Chile fue detectada en la zona central (Iriarte et al., 2005), proveniente de la región del Cabo en Sudáfrica (Lobos et al., 2014a). Según Veloso et al. (2004), esta introducción se produjo sólo una vez.
Xenopus laevis es una gran colonizadora de ambientes acuáticos en el centro de Chile (Lobos et al., 1999), desde que se introdujo a la laguna Carén (33°25'50"S; 70°50'29"W) en el año 1973 (Jaksic, 1998). Los primeros informes de la existencia de poblaciones asilvestradas se produjeron en la década de 1980, confinadas a un área alrededor de Santiago de Chile (Veloso & Navarro, 1988, citado por Measey et al., 2012; Lobos et al., 2014b). Desde entonces, ha extendido su rango usando los siguientes mecanismos hipotéticos: a) Dispersión acuática a través de cauces naturales. Usando los corredores que representan los cauces de ríos próximos a su primera liberación (Lobos, 2004). La presencia del valle central de Chile facilita la existencia de cuencas y subcuencas interconectadas. b) Dispersión acuática a través de cauces artificiales. La intrincada y centenaria red de canales de riego existentes en Chile central (Lobos & Measey, 2002), sostiene importantes densidades de Xenopus laevis (Lobos & Jaksic, 2005). Este mecanismo de propagación se ha visto favorecido por el auge de la industria vitivinícola que se favorece de la construcción de tranques, embalses y una ramificada red de canales de riego (Lobos & Solís, 2004). c) Traslaciones con ayuda humana, que explica la existencia de poblaciones aisladas (Lobos & Jaksic, 2005; Lobos, 2004; Measey et al., 2012). d) La migración terrestre, que ha sido reportada en varias oportunidades (Lobos, 2004; Lobos & Jaksic, 2005; Ross et al., 2015). Xenopus laevis posee adaptaciones sensoriales que facilitan esta propagación (Solís, 2004).
De esta manera, el área establecida actualmente incluye las regiones administrativas de Atacama, Metropolitana, Coquimbo, Valparaíso, Libertador General Bernardo O'Higgins y Maule (27 a 35°S), del nivel del mar hasta alrededor de 620 msnm (Mora et al., 2019). Sin embargo, las poblaciones de las regiones de Atacama y Coquimbo, es decir el límite norte de distribución (Measey et al. 2012, Mora et al. 2019), se encuentran presentes en locaciones aisladas, por lo que se considera que proviene de traslaciones por acción humana (Lobos & Jaksic, 2005; Lobos, 2012). Los reportes de la región de Valparaíso muestran que su distribución en cambio es continua y se encuentra entre la cuenca del río Maipo (34°S; Lobos & Jaksic, 2005) y el lado sur de la cuenca del río Aconcagua (33°S; Lobos et al., 2013a, 2014b). Algunos autores han planteado que el río Aconcagua constituiría una barrera efectiva a la expansión de esta especie (Lobos et al., 2013b), pues al norte de la ribera de este río se impide: a) la dispersión acuática en cauces naturales debido al inicio de la secuencia de valles transversales, cuyas cuencas aisladas no permiten las conexiones entre cursos de agua existentes en el valle central; b) la dispersión acuática en cauces artificiales debido a la inexistencia de los sistemas de regadío de canales abiertos asociados a la industria vitivinícola al sur del Aconcagua, los que son remplazados aquí por sistemas basados en captaciones profundas de agua subterránea y una distribución mediante tubos cerrados orientados para los cultivos de Persea americana; y c) la dispersión terrestre debido al límite entre el clima mediterráneo (más próximo al clima presente en su área nativa) y el inicio del clima semi-árido. Sin embargo, Ihlow et al. (2016) sostienen que el cambio climático antropogénico está generando condiciones para la propagación de Xenopus laevis al norte del río Aconcagua.
El 16 de septiembre 2015 a las 22:55 horas (UTC) se produjo un terremoto Mw 8.3 en las cercanías de Illapel (31°34’S, 71°40’W, 25 km profundidad). Contreras-López et al. (2016) midieron los efectos del tsunami en el humedal de Mantagua (32°51’S), registrando en este lugar trepamientos de la onda tsunami sobre tierra de 0.9 a 2.8 m y penetraciones del orden de 200 m, que cubrieron parte del cuerpo de agua. Mientras se efectuaban las mediciones y se registraban los efectos del tsunami en el interior del humedal, se pudo constatar la presencia de 2 individuos muertos de Xenopus laevis.
El hallazgo llama la atención, pues Xenopus laevis se encuentra ligeramente más al norte del límite de su distribución reconocida y puede constituir evidencia que contrasta con la hipótesis de que el río Aconcagua es el límite norte que ha alcanzado su dispersión. El propósito de este trabajo es documentar este hallazgo y discutir la posibilidad que Xenopus laevis pueda estar utilizando una combinación de migración terrestre con dispersión acuática aprovechando la compleja red de humedales costeros de Chile central para ampliar su distribución.
Materiales y Métodos
Área de Estudio
El humedal de Mantagua es parte de un complejo sistema de humedales costeros que se distribuyen en el litoral de Chile central. Entre Coquimbo (29°S) y Concepción (37°S) se han contabilizado más de 400 cuerpos de agua costeros (Marquet et al., 2012), entre las que se cuentan: lagunas costeras, desembocaduras de estuarios, tranques artificiales y charcas estacionales (Contreras-López et al., 2017). El humedal se emplaza entre dos centros urbanos e industriales: Concón y Quintero (Figura 1). Esta región se localiza en el límite del clima templado mediterráneo (por el lado sur) y el semiárido (por el lado norte), con una temperatura ambiente que varía entre 10 °C y 25 °C, y precipitaciones inferiores a 250 mm anuales, que se concentran entre los meses de mayo y agosto. El humedal es parte de una unidad geomorfológica que consiste en un campo de dunas de 1 900 ha de extensión que desvía el curso inferior de los esteros Ritoque y Quintero, formando el humedal compuesto por una laguna costera de 7 ha y la desembocadura del estero Quintero (Castro, 2015). El estuario con una profundidad inferior a 1.5 m está desconectado del mar por un banco de arena (barra de arena) que se abre esporádicamente. El humedal y la duna asociada se han identificado como un área de interés para la conservación de la biodiversidad de Chile central (PUCV-UPLA, 2015).
Trabajo de Terreno
El día posterior al tsunami (17 de septiembre 2015) se visitó el humedal de Mantagua. Se pudo constatar un elevado número de especímenes de ictiofauna muertos y depositados dentro del sector de inundación, aproximadamente 1 km aguas arriba del estero Quilpué, contados desde la barra de arena que separa el humedal del mar (Figura 1). Personal del hospedaje eco-turístico Posada del Parque señalaron la presencia de ranas africanas entre los especímenes depositados, las que fueron encontradas muertas, pero sin lesiones visibles, identificadas morfológicamente y fotografiadas en el lugar de hallazgo. Su identificación se facilitó debido a sus rasgos únicos: piel lisa, patas musculosas, membranas interdigitales, formaciones córneas en los tres dedos de las patas internas, protuberancia cloacal (Lobos, 2004). Para georreferenciar el punto del hallazgo se utilizó un GPS con 3 metros de precisión en la horizontal.
Trabajo en Laboratorio
Ambos especímenes recolectados fueron conservados en Alcohol 95%. Posteriormente se midieron con una cinta milimetrada y un pie de metro digital (±0.1 mm) la longitud hocico-cloaca, ancho de la cabeza, fémur derecho, tibia y radiocubital, siguiendo el protocolo descrito por Wiens (1993); pesados en húmedo con una balanza digital (±0.5 g) y fotografiados antes de ser depositados en el Museo Nacional de Historia Natural de Chile (MNHNCL-HERP 5334 y MNHNCL-HERP 5333).
Resultados y Discusión
Los dos ejemplares de Xenopus laevis fueron hallados en el punto (32°52’59’’S; 71°30’01’’W). En este lugar se encontraban marcas de la inundación provocada por el tsunami: suelo mojado, vegetación aplastada, restos de algas, peces y artes de pesca, entre otros (Figura 2A). Los especímenes estaban aún húmedos y tenían menos de 24 horas de fallecidos (Figura 2B). En la Tabla 1 se muestran los parámetros biométricos de los ejemplares de Xenopus laevis. La longitud hocico - cloaca de 10 y 6 cm de los dos ejemplares se corresponde con una hembra y un macho adulto (Solís, 2004), mostrados en las Figuras. 2C y 2D, respectivamente.
Tabla 1 Parámetros biométricos de los ejemplares encontrados muertos producto del tsunami en el humedal de Mantagua / Región de Valparaíso / Chile.
| Espécimen | 1 | 2 |
| Código STO | MNHNCL-HERP 5334 | MNHNCL-HERP 5333 |
| Sexo | Hembra | Macho (Presumible) |
| Ancho Cabeza (mm) | 35.0 | 21.3 |
| Longitud (hocico-cloaca) (mm) | 102.0 | 61.0 |
| Fémur derecho, longitud (mm) | 44.0 | 25.0 |
| Tibia (rodilla a talón) (mm) | 30.0 | 16.0 |
| Radio cubital (mm) | 21.0 | 13.0 |
| Peso húmedo (g) | 94 | 17 |
Lobos et al. (2013a) publicaron una lista de 73 localidades con presencia de Xenopus laevis; además, Lobos et al. (2014b) publicaron un mapa con la distribución actualizada y Mora et al. (2019) amplían la distribución a 81 localidades. En ninguna de estas referencias se hace mención al humedal de Mantagua. Además, en el catálogo de la colección herpetológica del Museo Nacional de Historia Natural de Chile, solo se consigna un ejemplar de Xenopus encontrado en la región Metropolitana (Núñez & Gálvez, 2015).
El primer reporte no confirmado sobre la presencia de Xenopus laevis en el humedal de Mantagua data de marzo de 2013 (Henríquez, 2013), consistente en un ejemplar encontrado en la misma área donde fueron localizados los 2 especímenes reportados en este trabajo. Sin embargo, no se detalla el proceso de identificación y el material no fue depositado en ningún museo o centro de referencia taxonómico, constituyendo un antecedente que puede ser clasificado como información gris. Existe también un antecedente del año 2006, donde se encontró un ejemplar en el estero Quintero a unos 10 km aguas arriba de la misma cuenca del humedal, pero se trataría de una traslación con ayuda humana (Bustos & Valencia, 2006).
El sistema de humedales costeros de Chile central constituye un verdadero corredor ecológico que usualmente es utilizado por las aves migratorias (Marquet et al., 2012), pero también podría ser usado por especies exóticas invasoras como Xenopus laevis. El humedal de Mantagua pertenece a un conjunto de humedales de la zona semiárida (Figueroa et al., 2009), cuyos rangos de pH entre 8.2 y 8.8, salinidad entre 5 y 20 PSU y temperatura entre 15 a 25 °C (PUCV-UPLA, 2015) son compatibles con los amplios rangos que admite la biología de Xenopus laevis: pH entre 5.6 a 8.7, salinidad < 15 PSU y temperatura entre 18 y 30 °C (Tinsley et al., 1996).
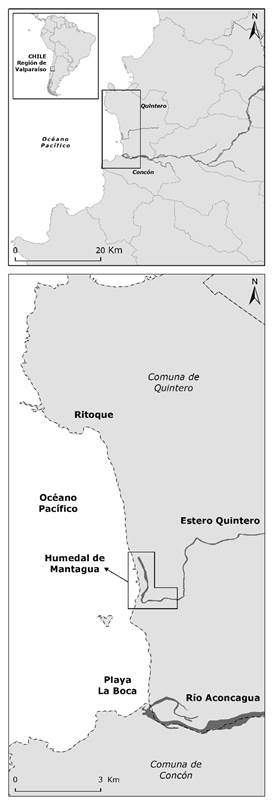
Figura 1 Localización área de estudio. Se ha destacado el entorno del humedal de Mantagua y su emplazamiento respecto al rio Aconcagua.
De Villiers & Measey (2017) muestran que Xenopus laevis no es una especie puramente acuática. Con datos empíricos, sobre el movimiento terrestre, dentro del rango nativo en África subsahariana de esta especie, encontraron individuos capaces de desplazarse 2.42 km entre diferentes cuerpos de agua en un período menor a 6 semanas (es decir 1.6 km/mes). Si Xenopus laevis tiene esta capacidad de desplazamiento terrestre, entonces es posible que utilice los humedales costeros al norte de Mantagua para ampliar su distribución. Lo que ha ocurrido en los últimos años (Mora et al. 2019). En esta zona destacan los tranques de Santa Julia y Valle Alegre (a unos 8 km de distancia del hallazgo reportado aquí), humedales Campiche y Los Maitenes en Quintero (a 14 km), estero Catapilco, laguna de Catapilco y laguna de Zapallar (a 29 km), estero Papudo (a 42 km), sistema humedales Pichicuy - Pullally (a 59 km), por nombrar algunos. Asumiendo las tasas de desplazamiento de 4.4 km/año reportadas por Lobos (2014b), y considerando en forma conservadora que Xenopus laevis se encuentra en Mantagua desde el año 2013, se podría esperar que esta invasión llegue al sistema de humedales Pichicuy - Pullally y alcance el sur de la región de Coquimbo en la próxima década. Entre los años 2015 y 2019, Mora et al. (2019) han podido constatar la presencia de Xenopus laevis en los humedales Catapilco y Los Molles, evidenciando que Xenopus laevis es capaz de desplazarse más rápido que 4.4 km/año, lo que es coherente con las velocidades de 1.6 km/mes encontradas por Villiers & Measey (2017) en el rango de distribución nativa de la especie.
Uno de los efectos colaterales del tsunami fue el varamiento de numerosos especímenes de ictiofauna además de los dos ejemplares de Xenopus laevis aquí reportados. Esto debería ser considerado en los futuros estudios de campo post tsunami en litoral del Pacífico Sur Oriental (costas de Colombia en su cuenca Pacífica, Ecuador, Perú y Chile). Este litoral es afectado en promedio cada 5 años por un tsunami (Lagos, 2000). Así, en áreas protegidas o humedales de interés para la conservación de la biodiversidad, donde normalmente es muy complejo realizar inventarios de especies sin generar perturbaciones, se podrían completar estos inventarios inspeccionando las especies varadas después de la ocurrencia de un tsunami.
Conclusiones
Se confirma la presencia de Xenopus laevis (Daudin, 1802) al norte del río Aconcagua, en el humedal de Mantagua (32°51’S; 71°30’W), por el hallazgo de ejemplares muertos y que, de acuerdo con sus características morfológicas, indican que al menos la hembra se encontraba en edad reproductiva, por lo que podría existir una población de esta especie exótica invasora sin cuantificar en el humedal.
La presencia de Xenopus laevis al norte del río Aconcagua indicaría que esta especie invasora utiliza el mecanismo de migración terrestre, lo que tiene como consecuencia el aumento de su dispersión hacia el norte. Esto ha sido facilitado por los numerosos humedales costeros presentes en esta zona, de tal modo que los especímenes de esta especie pasarían paulatinamente de un cuerpo de agua a otro, tal como lo ha realizado en los ríos al sur del río Aconcagua. Su amplio rango de tolerancia a la temperatura y salinidad posibilita el uso de estos humedales salobres.












 uBio
uBio 


