Introducción
El lago Chinchaycocha (también conocido como Lago Junín) es el segundo lago más grande del Perú, albergando una alta diversidad de especies y endemismos (SERNANP, 2020); sin embargo, este ecosistema ha sido declarado en emergencia desde el año 2002, por lo que se ha implementado un Plan de Manejo Ambiental para su protección (MINAM, 2017).
La situación actual de los anfibios del mundo agrupa más del 40% de especies en alguna categoría de amenaza (UICN, 2020); es así, que las especies amenazadas constituyen el principal enfoque de estrategias para su protección (USFWS, 2005). Telmatobius macrostomus (Peters, 1873) conocida como la rana gigante del lago Junín, es una especie que se encuentra actualmente en peligro de extinción (UICN, 2016; SERFOR, 2018) debido a la presencia de amenazas como la degradación de su hábitat, contaminación, sobreexplotación y la presencia de especies exóticas invasoras (Angulo, 2008; Aguilar et al., 2010).
Existen pocos estudios sobre los renacuajos de T. macrostomus, se han publicado trabajos en ecología (Guevara & Morales, 1991; Manyari & Iannacone, 2006) y taxonomía (Sinsch, 1986; Aguilar & Valencia, 2009), a pesar de su importancia como parte de la cadena trófica en la cuenca del lago Chinchaycocha o como recurso económico y alimenticio (Sinsch, 1986; Watson et al., 2017a).
Telmatobius macrostomus es una especie estrictamente acuática (Vellard, 1951), endémica de Perú y se distribuye por las regiones de Junín y Pasco. Se le puede encontrar en pequeñas lagunas y riachuelos, pero también en el río Mantaro (valle superior) y el lago Junín, con una distribución altitudinal que va desde los 3 400 msnm hasta los 4 660 msnm (Sinsch, 1986).
Los renacuajos de T. macrostomus, alcanzan medidas de hasta 202 mm de longitud total, este gran tamaño es un ejemplo del fenómeno conocido como gigantismo larval (Vellard, 1951). Se conoce que renacuajos, metamorfos, juveniles y adultos coexisten en todas las épocas del año, debido a su extenso desarrollo larvario y actividad reproductiva constante, posiblemente vinculada con la temperatura estable del agua (Vellard, 1951; Sinsch, 1986; Watson et al., 2017b); por esta razón, es importante conocer las variables ambientales que afectan el comportamiento individual, a esto se le conoce como microhábitat (Morris, 1987). Este estudio describe el microhábitat del renacuajo de T. macrostomus en el ecosistema de afluentes del lago Chinchaycocha y enfatiza esfuerzos de conservación inmediatos.
Materiales y métodos
Área de estudio
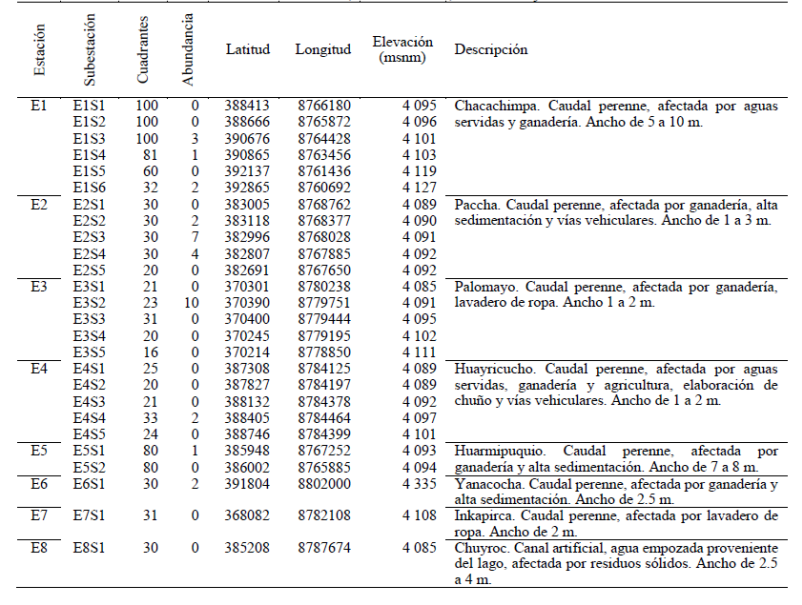
El estudio fue desarrollado en la cuenca del lago Chinchaycocha, en la Región Junín, a una elevación de aproximadamente 4 100 msnm (Figura 1). Fueron examinadas ocho estaciones: siete afluentes del lago (E1-E7) y un canal artificial (E8), distribuidos en la Reserva Nacional de Junín (RNJ) y su zona de amortiguamiento, en los distritos de Carhuamayo, Ondores y Junín (Tabla 1). El clima fue característico de la puna altoandina, con una temperatura ambiental muy variada durante el día (6 a 27 °C), humedad relativa (30 - 79%) e irradiancia solar (0.36 - 239 mW/m2). El área de estudio está afectada por la ganadería intensiva, agricultura y aguas residuales de comunidades aledañas (Tabla 1).
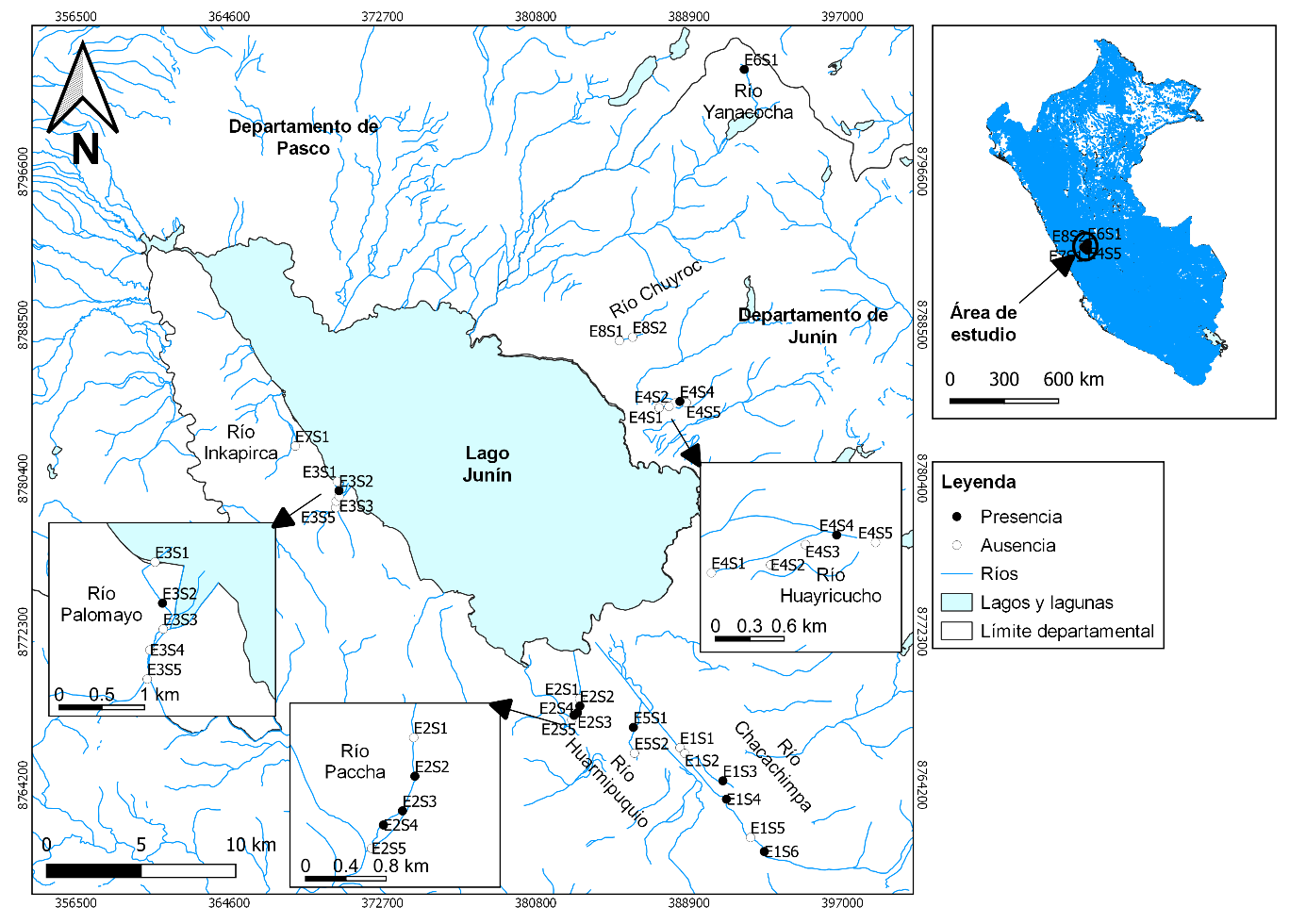
Figura 1 Área de estudio de renacuajos de Telmatobius macrostomus en los afluentes del lago Junín, en los andes centrales del Perú.
Diseño de muestreo
Las ocho estaciones fueron divididas en 27 subestaciones (unidad muestral 1) seleccionadas al azar. Cada subestación tuvo 50 m de longitud y estuvieron separadas por un mínimo de 300 m una de otra para mantener su independencia (Rueda et al., 2006). Cuatro estaciones (E1, E2, E3 y E4) fueron seleccionadas porque existía un registro de presencia de renacuajos (Watson et al., 2017a b), mientras que en las estaciones E5, E6, E7 y E8 se evaluaron una o dos subestaciones por considerarse lugares probables con presencia de renacuajos (según información de pobladores locales).
En cada subestación se establecieron parcelas de 1 x 1 m, denominadas cuadrantes (unidad muestral 2), también seleccionadas al azar y consideradas para caracterizar y comparar a menor escala el microhábitat (Rueda-Solano et al., 2015). La cantidad de cuadrantes dependió proporcionalmente del ancho de las subestaciones.
Colecta biológica
La evaluación se realizó de 09:00 a 17:00 h entre el 11 y 22 de julio del 2016 en época seca; no se realizó la evaluación en época húmeda por problemas logísticos. Los renacuajos fueron capturados con redes cuchara “dip-net” con un desplazamiento en dirección río-arriba - “contracorriente”, examinando cuidadosamente todos los espacios disponibles, como lo indica Watson et al. (2017b); luego la especie fue identificada en campo usando su descripción y claves taxonómicas (Peters, 1873; Sinsch, 1986; Aguilar & Valencia, 2009) y fue agrupada como renacuajo usando la tabla de Gosner (1960).
La evaluación de cada estación en campo se llevó a cabo por uno o dos evaluadores, durante dos horas aproximadamente. En la búsqueda también se registró la presencia de peces del género Orestias (Valenciennes, 1839), y de las especies Trichomycterus oroyae (Eigenmann & Eigenmann, 1889) y Oncorhynchus mykiss (Walbaum, 1792).
Las plantas acuáticas encontradas junto a los renacuajos fueron colectadas y depositadas en frascos de 200 ml con formol al 7%, para la posterior identificación del perifiton asociado. Los organismos identificados fueron agrupados por phyla, en el Laboratorio de Ecología Acuática de la Facultad de Ciencias Biológicas de la Universidad Nacional Mayor de San Marcos.
Evaluación de parámetros en las subestaciones
En cada subestación se evaluaron 10 parámetros fisicoquímicos como temperatura del agua, pH, sólidos disueltos totales (TDS por sus siglas en inglés), conductividad, salinidad, los cuales fueron medidos con un multiparámetro marca Extech PH100 a 50 cm de la orilla aproximadamente; el porcentaje de oxígeno saturado (% OS) fue medido con el equipo EZODO 7031 , el porcentaje de cobertura superficial , porcentaje de vegetación, profundidad promedio y finalmente se calculó el ancho promedio del río con tres medidas, al inicio, medio y final de la subestación.
Evaluación de parámetros en los cuadrantes
Para cada cuadrante se evaluaron seis parámetros. Primero, se estimó el porcentaje (múltiplo de 5) de cobertura superficial y vegetación sumergida. Segundo, se calculó la distancia aproximada a la orilla (0, 1, 2 m a más), la profundidad, el tipo de sustrato: arcilla, limo, arena, grava o piedra (Wolman, 1954) y el nivel estimado de la corriente de agua (baja, media o alta).
Tratamiento de datos
El método usual para determinar la selección de microhábitat es mediante la correlación de variables que muestran una potencial influencia en la selección de microhábitat (Bozeman & Grossman, 2019).
No hubo normalidad en los parámetros, por lo que se usó la prueba no paramétrica de Kruskal-Wallis para comparar las subestaciones y los cuadrantes con y sin presencia de renacuajos. Solo para la subestación E3S2, se desarrolló un análisis escalamiento multidimensional no-métrico debido a la heterogeneidad de sus variables categóricas, comparándose las variables cuantitativas no transformadas (% cobertura superficial, % vegetación sumergida y profundidad) usando la prueba no paramétrica de Kruskal-Wallis.
El resultado fue contrastado con un análisis de similaridad (ANOSIM) basado en 10 000 permutaciones al azar de la matriz de disimilaridad.
Luego, se determinaron los valores mínimos (min), máximos (máx) y promedios de los parámetros fisicoquímicos del microhábitat de las subestaciones. Los análisis fueron ejecutados en PAST 3.15 (Hammer et al., 2001). La vegetación sumergida, cobertura superficial y profundidad fueron analizadas como promedios en las subestaciones.
Los parámetros de los cuadrantes con renacuajos como distancia aproximada a la orilla, tipo de sustrato, nivel estimado de la corriente de agua y presencia de los potenciales competidores acuáticos (peces de Orestias, Trichomycterus oroyae) y depredadores (Oncorhynchus mykiss), fueron representados por frecuencias de ocurrencia (Watson et al., 2017a). El perifiton fue identificado hasta especie y agrupados por phyla usando el AlgaeBase (Guiry & Guiry, 2017).
Resultados
Distribución y abundancia
De las ocho estaciones evaluadas, seis estuvieron ocupadas por un total de 34 renacuajos. La cantidad de renacuajos reportados por subestación está representada en la Tabla 1. También se observó, dentro de una estación con cinco o más subestaciones, que los renacuajos de T. macrostomus no se encontraron distribuidos en todas (Figura 1).
Un total de 1 137 cuadrantes fueron evaluados y de 29 de ellos se registró la presencia de renacuajos de T. macrostomus (cinco cuadrantes con dos renacuajos cada uno). La estación E2 presentó la mayor abundancia (n = 13) en tres subestaciones, seguida de la estación E3 (n = 10) en solo una subestación. Las E1 y E4 fueron las únicas que registraron la presencia de cinco metamorfos en total, junto a renacuajos. En la subestación E1S3, los renacuajos se encontraron junto a un individuo juvenil de T. macrostomus. Mientras, a unos metros de la subestación E3S5, se capturó un adulto.
Descripción del microhábitat
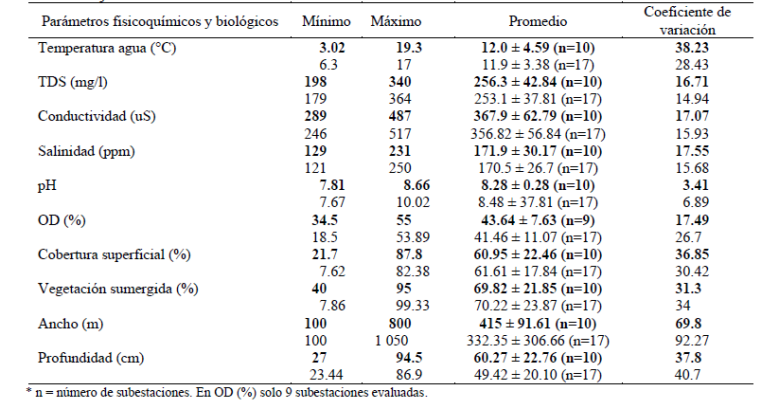
Los diez parámetros evaluados entre las subestaciones con presencia y ausencia de renacuajos no mostraron diferencias significativas (p > 0.05, Kruskal Wallis). El análisis univariado de algunos parámetros para cada subestación reveló que la temperatura del agua, cobertura superficial, vegetación sumergida, la profundidad y el ancho fueron las variables que presentaron un coeficiente de variación mayor a 30 (Tabla 2). La vegetación que predomina en las riberas son pastizales, césped de puna y plantas herbáceas. Las subestaciones con o sin renacuajos fueron caracterizadas por un alto porcentaje de vegetación sumergida y cobertura superficial (Tabla 2). El pH presentó el valor mínimo (7.67) y máximo (10.02) reportados; igualmente, la profundidad (23.4 cm) fue la menor de todas.
Tabla 2 Análisis univariado de los parámetros evaluados en las subestaciones con renacuajos (en negrita) y sin renacuajos.
La mayor abundancia de renacuajos se dio en la subestación E3S2, lo cual permitió obtener un contraste del análisis de escalamiento multidimensional no paramétrico, encontrándose diferencias significativas entre cuadrantes con y sin renacuajos (Stress = 0.18, ANOSIM R = 0.50, p = 0.0004). Las variables que permitieron esta diferencia en E3S2 fueron los promedios del porcentaje de cobertura superficial (presencia: media = 49%, min = 20%, máx = 80%; ausencia: media = 25%, min = 0%, máx = 80%; p-value = 0.03), vegetación sumergida (presencia: media = 74%, min = 20%, máx = 80%; ausencia: media = 41%, min = 0%, máx = 100%; p-value = 0.04) y la profundidad (presencia: media = 40 cm, min = 30 cm, máx = 45 cm; ausencia = 32 cm, min = 25 cm, máx = 40 cm; p-value = 0.003) de los cuadrantes.
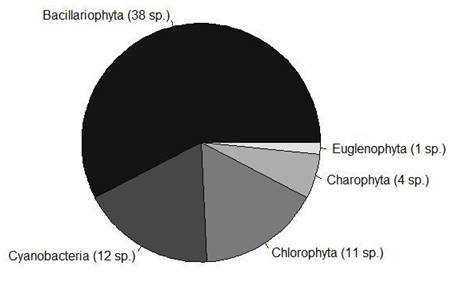
Los parámetros numéricos de los cuadrantes con presencia y ausencia de renacuajos no mostraron diferencias significativas (p > 0.05, Kruskal Wallis). Los 34 renacuajos de T. macrostomus fueron encontrados a menos de un metro de la orilla (100%, n = 29), en sustrato tipo limo (93%, n = 27), arcilla (3.5%, n = 1), grava (3.5%, n = 1), corriente baja (100%, n = 29), también en áreas con presencia de vegetación acuática sumergida como Myriophyllumsp. “cola de zorro”, emergentes como Hydrocotylesp. “sombrero de sapo” y Scirpussp. “totora”. También estaban presentes junto a peces del género Orestias (93%, n = 27) y una alta diversidad de diatomeas - phylum Bacillariophyta (Figura 2, Tabla 3). Los renacuajos no fueron encontrados con T. oroyae (0%, n = 29) u O. mykiss en ninguna de las estaciones evaluadas.
Discusión
Distribución y abundancia
Desde 1998 se reportan subpoblaciones de renacuajos de T. macrostomus en riachuelos alrededor del lago Junín (Camacho, 2001; Loza & Mendoza, 2017; Watson et al., 2017a b). En este estudio se confirma la presencia de renacuajos en las estaciones E1, E2, E3 y E4 (Figura 1) similar a lo registrado por Watson et al. (2017a) en los meses de octubre del 2015 y abril del 2016. Así mismo, en la E5, según guardaparques de la RNJ e investigadores, se confirma la presencia de renacuajos después de 7 años. La E6 tiene el registro más nororiental de la zona de amortiguamiento de la RNJ y se localiza en zona de exploración minera, según pobladores locales.
Se asume que las subpoblaciones de los renacuajos de T. macrostomus están severamente fragmentadas entre subestaciones debido a la ganadería, remoción de vegetación riparia y modificación de los cauces, lo que habría afectado su distribución y actividad natural.
Descripción del microhábitat
La preferencia por lugares con alto porcentaje de macrófitas acuáticas guarda relación con su fuente de alimento de tipo perifítico (Guevara & Morales, 1991), esto se comprueba por la asociación a una alta diversidad de diatomeas en los cuadrantes con renacuajos; y de macroinvertebrados (Watson et al., 2017b). También, la vegetación acuática les brinda protección contra depredadores naturales, como aves.
Se asume que los renacuajos de T. macrostomus, durante el día están posados o alimentándose mayormente de diatomeas y ocultos entre las plantas acuáticas ribereñas. Desconocemos su actividad nocturna, probablemente se encuentren activos desplazándose a lo largo de los riachuelos.
El limo fue el sustrato predominante para T. macrostomus, similar a lo reportado por Watson et al. (2017b), sin embargo, este tipo de sustrato es común en zonas afectadas por malas prácticas (SEPA, 2010) probablemente relacionadas con el embalse del lago Chinchaycocha desde 1932 (Robdell et al., 2014). También, proveen las condiciones necesarias para el desarrollo de individuos de la familia Chironomidae (Dudgeon, 1994), considerados indicadores de pobre calidad de agua y asociados negativamente a la presencia de T. macrostomus (Watson et al., 2017b).
La alta variación de la temperatura del agua está relacionada con la hora del día en el área de estudio; la baja temperatura ocurre en la noche y la alta temperatura durante el día (datos no publicados), así que los renacuajos deben estar adaptados a estos cambios, pero no se conoce alguna relación. Acerca de los parámetros fisicoquímicos, el valor mínimo de vegetación sumergida y el porcentaje de cobertura superficial (21.7% y 40%, respectivamente) indican un microhábitat débil muy similar a la subestación E3S5 con 7.6% (sin renacuajos). Los anchos de los riachuelos no tienen relación con los renacuajos porque fueron encontrados en casi todas las medidas con excepción a 10 y 10.5 metros. Por otro lado, la profundidad mínima de cuadrantes con renacuajos fue de 27 cm, por ello, consideramos este valor como mínimo para su microhábitat.
Valores menores a 6.5 y mayores a 10 de pH alteran el desarrollo de anfibios (Padhye & Ghate, 1988; Pierce, 1985, 1993). Estos valores anómalos indican contaminación de origen minero, como los vertidos en la zona norte del lago Junín, con reportes de entre 2.8 a 6.2 (Camacho, 2001), distantes a las localidades aquí evaluadas, pero cuyos metales ocasionarían una alta mortalidad (Iannacone & Manyari, 2003). En este trabajo, la subestación E8S1 (canal artificial sin circulación de agua) presentó el valor máximo de pH (10.02) que afecta negativamente a los anfibios, representando un mal hábitat para los renacuajos de T. macrostomus. Watson et al. (2017b) registraron un valor promedio de 8.38 para los sitios con T. macrostomus, muy similares a los nuestros; por esta razón, sugerimos un rango óptimo del pH entre 8.3 y 8.4 para los renacuajos de T. macrostomus.
Medidas de conservación
Las estaciones E1, E2 y E3 tienen la mayor cantidad de renacuajos, presencia de metamorfos y adultos, además de adecuados parámetros fisicoquímicos y biológicos (altos porcentajes de vegetación sumergida y superficial) indicando un mayor número de microhábitats para desarrollar esfuerzos de conservación in situ.
En su área de distribución se llevan a cabo diferentes amenazas en todos los afluentes, como la limpieza de riachuelos o canales, donde se extrae la vegetación riparia para aumentar la irrigación y evitar la inundación de áreas de pastoreo, ocasionando la destrucción del hábitat y la extracción de la especie. Por ejemplo, en la subestación E3S1, se notó una poca o nula presencia de vegetación ribereña y ningún renacuajo fue encontrado, aunque a 300 m en la E3S2 se registró la mayor abundancia de renacuajos. También la ganadería, en zonas con presencia de T. macrostomus, altera la estructura de los riachuelos (remoción de vegetación acuática al alimentarse) y la composición química del agua (orina y heces). Ante ambos casos son necesarias medidas de ordenamiento territorial para proteger el hábitat de la especie (Grant et al., 2016) y mantener poblaciones ecológicamente viables de T. macrostomus.
Estas evidencias enfatizan la necesidad de la ejecución de un plan de conservación de la Rana Gigante del Lago Junín, T. macrostomus, el cual está siendo implementado por la Fundación Zoológica de Denver, GRUPO RANA y varios aliados nacionales e internacionales a través de formas estructuradas de investigación, educación y manejo ambiental (Watson et al., 2016).
Conclusiones
Los renacuajos de T. macrostomus están relacionados a un microhábitat caracterizado por un sustrato tipo limo, corrientes bajas, asociación a la orilla, presencia de peces del género Orestias, alta diversidad de diatomeas, a profundidades de más de 27 cm, con vegetación sumergida y superficial generalmente alta. En base a los parámetros evaluados en las subestaciones, los renacuajos de T. macrostomus son considerados generalistas y su preferencia por un microhábitat podría estar delimitado por factores alimenticios, relaciones interespecíficas o por la alteración de su hábitat.












 uBio
uBio