Introducción
El Perú es el segundo país en extensión forestal en América Latina, con 72 millones de hectáreas de bosques y el cuarto con mayor área de bosques tropicales húmedos (MINAM, 2009). Como ocurre en otros países tropicales, sus bosques están sometidos a una extensa deforestación con fines agropecuarios y mineros y, asimismo, sufren severa degradación, especialmente como consecuencia de la explotación forestal, la caza y la contaminación minera. Se estima conservadoramente que en el Perú se han destruido más de 11 millones de hectáreas de bosques y que no menos del 50% de los que aún están en pie han sido degradados (Dourojeanni, 2019b).
La deforestación y la pérdida de fuentes de agua, especialmente en las cabeceras de cuencas, asociadas al impacto del cambio climático, tienen un rol determinante en el proceso de aridización y sabanización de la Amazonia, por lo que los cambios ambientales vienen ocasionando la colonización por parte de especies que responden a hábitats más secos (Dourojeanni, 2019a; Rojas et al., 2019). La deforestación está concentrada en las regiones de San Martín (19.42%), seguida de Loreto (14.68%) y Amazonas (12.30%) (MINAM, 2015). En cambio, la degradación forestal es muy generalizada, afectando todas las regiones, especialmente la de Pucallpa (MINAM, 2013).
La acción acumulada de la deforestación, fragmentación y degradación de hábitats, así como la generación de hábitats sucesionales, están causando cambios en la composición de la biodiversidad en la medida que muchas especies, propias de este ecosistema, están desapareciendo, y que, simultáneamente, otras especies están colonizando estos ambientes (Harvey et al., 2014). Esa pérdida y fragmentación de los hábitats naturales disminuye las poblaciones de las especies y es una de las causas de la desaparición de otras (Granizo et al., 2002). En este escenario, la sucesión se ve influenciada por eventos probabilísticos, por la biología de las especies, por su forma de interactuar con plantas y animales, el suelo y el clima del lugar (Gaston, 2005; Stouffer, 2020). Estos factores dan origen a una determinada composición y, además, influyen en la velocidad a la que un bosque recupera su estructura y funcionamiento original (Sekercioglu et al., 2008). Los estudios sobre el estado de un hábitat sirven de base para señalar prioridades para la conservación de la diversidad biológica y el medio ambiente global (Núñez, 2008).
La biodiversidad amazónica está conformada por millones de especies, entre las cuales las aves constituyen uno de los taxones más conocidos que han sido identificados como indicadores del cambio climático y cuyas poblaciones están siendo afectadas en los bosques tropicales de tierras bajas debido a que algunas especies de árboles proveedores de frutas e insectos se han dispersado hacía hábitats de mayor elevación, donde encuentran microclimas más adecuados para su supervivencia (Mittermeier et al., 2003; Colwell et al., 2008; Locatelli et al., 2009; De Sy et al., 2015). La gran cantidad de datos recolectados, proporcionados por cientos de miles de observadores de aves, ha permitido que se tenga información cada vez más precisa y actualizada acerca de los efectos de la destrucción de los bosques y el cambio climático sobre las poblaciones de aves que habitan en los ecosistemas de los bosques de América Latina, donde se concentra parte de la mayor diversidad de especies del mundo (Sekercioglu et al., 2011).
El conocimiento sobre la relación entre las aves y los factores ambientales permite entender el efecto de los impactos humanos sobre la diversidad de la avifauna. Las aves responden a una serie de condiciones, como la variación de la densidad poblacional, y las respuestas a los diferentes impactos están determinadas por características particulares como el tamaño de los ejemplares, hábitos alimenticios, selección de sitios de nidificación, capacidad de dispersión, etc. De allí que las especies puedan presentar diferentes tipos de respuestas: disminución o aumento de su abundancia, cambios en su distribución, desplazamiento poblacional a lugares con alteraciones ambientales e, incluso, su desaparición local (Lepczyk et al., 2008).
La presencia de las aves contribuye al análisis de los procesos ecológicos complejos como gradientes en la cobertura del dosel de bosques, procesos de fragmentación y urbanización (Stouffer, 2020). Las aves son consideradas como buenos indicadores de los cambios ambientales debido a que vuelan a grandes distancias, están ampliamente distribuidas y son sensibles a cambios en el ecosistema, como la contaminación ambiental, alteración del hábitat y el efecto de las actividades humanas (Lara, 2020). En general, responden a la composición y estructura de la vegetación, por lo que son utilizadas como indicadores de impacto ambiental en los ecosistemas boscosos, revelan el grado de la destrucción o la modificación del hábitat sobre otras especies y grupos, y cumplen un importante rol en el mantenimiento de funciones ecológicas claves dentro de los sistemas forestales, tales como la diseminación de semillas y la polinización (WWF, 2004; Salas & Mancera, 2020). Este aspecto cobra especial relevancia si se tiene en cuenta que cerca al 50% de los árboles en los bosques húmedos tropicales tienen semillas que son dispersadas especialmente por las aves, que también cumplen una serie de funciones ecológicas claves para el mantenimiento de la integridad de los ecosistemas forestales (Canterbury et al., 2000).
En la Amazonía se registran más 1 300 especies de aves, de las que 250 son endémicas. No obstante, familias importantes como Columbidae y Strigidae no incluyen especies endémicas en la Amazonia (Nores, 2000). De un total de 73 especies de aves rapaces en el Perú (Cathartidae 6, Pandionidae 1, Accipitridae 18, Tytonidae 1, Strigidae 29, Falconidae 18), cerca de 30 viven en las tierras bajas del bosque amazónico (Schulenberg et al., 2010; SERFOR, 2018; Plenge, 2021). Sin embargo, muchas de ellas son extremadamente cautelosas, difíciles de ver y ocurren en densidades muy bajas.
La lechuza de los arenales, Athene cunicularia, es un ave de presa terrestre e inconfundible cuyo plumaje se asemeja al color del suelo del hábitat donde reside, de actividad diurna y crepuscular, de dieta generalista y oportunista; se alimenta de pequeños roedores, aves, reptiles, anfibios, artrópodos y gasterópodos (Medina et al., 2013; Mamédio dos Santos et al., 2017). Es sedentaria y tolera niveles considerables de alteración antropogénica en sus hábitats, lo cual es una ventaja porque desarrolla una amplia capacidad para adaptarse a la disponibilidad de presas según su abundancia o escasez, y que influye en su versatilidad para adaptarse a nuevas condiciones y resistir cambios drásticos de hábitat (Wade & Belthoff, 2016; Lincer et al., 2018). Se refugia en madrigueras excavadas en el suelo por otras especies animales, o en termiteros, las cuales son utilizados para la cría y anidamiento (Gomes et al., 2013).
A. cunicularia es de amplia distribución, abarca desde Canadá hasta Tierra del Fuego, en el extremo sur del Continente Americano (Macías & Conway, 2015), y ocupa diferentes hábitats desde el nivel del mar hasta los 4 000 metros de elevación. Comprende 20 subespecies, de las cuales cuatro se han registrado en Perú: A. c. punensis, del suroeste de Ecuador al sur en la costa al noroeste de Perú; A. c. nanodes en la costa del suroeste de Perú al norte de Chile; A. c. juninensis en los Andes de Perú, oeste de Bolivia y noroeste de Argentina; y A. c. boliviana que se distribuye en la Amazonia de Bolivia, en los departamentos de Beni y Santa Cruz y, probablemente, se encuentra también en Madre de Dios, Perú (Lincer, et al., 2018). Los estudios de comportamiento con A. cunicularia permiten comprender cómo sus poblaciones enfrentan el cambio antrópico, principalmente aquel relacionado al avance urbano (Carrete & Tella, 2017; Rebolo-Ifrán et al., 2017). La colonización de entornos humanizados por esta especie se ha relacionado con la variabilidad interindividual en su miedo a los humanos y se ha comprobado que este comportamiento es hereditario y constante a lo largo de la vida adulta de A. cunicularia. ((Carrete & Tella, 2017). Así mismo, utiliza para nidificar, en todo su rango de distribución, áreas abiertas sin árboles cercanos, típicamente zonas donde existen herbívoros que mantienen el pasto corto y mamíferos excavadores que, además de pastar, construyen madrigueras que luego las lechuzas utilizan para ellas (Borsellino, 2017; Rocha et al., 2021).
Hasta el siglo pasado, A. cunicularia no había sido registrada en la Amazonía peruana, sin embargo, en los últimos veinte años se ha reportado la ocurrencia de la especie en estos hábitats. En este sentido, es de particular importancia evaluar la posible modificación del rango de distribución de esta especie en el Perú. El objetivo de la presente investigación es efectuar una revisión bibliográfica y el seguimiento de los avistajes de A. cunicularia a fin de verificar la expansión de esta especie en las zonas boscosas de la Amazonia peruana en proceso de degradación.
Métodos
Desde 1977, se han efectuado evaluaciones en lugares de la selva alta y baja en las Regiones de Madre de Dios, Pucallpa, San Martín, Loreto, Amazonas, Cajamarca y Cusco que incluye la observación directa con binoculares sobre el hábitat, dieta alimenticia, comportamiento, desplazamientos altitudinales, distribución y estado de conservación de A. cunicularia (Pulido & Aguilar, 1979; Pulido, 1982; Pulido et al., 2007; Pulido et al., 2013). Además, se ha consultado la base eBird (TheCornellLab of Ornithology, 2020) en donde se ha registrado a A. cunicularia en diversos lugares de la Amazonia, así como se ha complementado dicha información a través de consultas por correo electrónico a investigadores que trabajan en aves en la Amazonía.
Se realizó una búsqueda sistemática utilizando Scopus, Web of Science, Scielo y Google Académico, en español e inglés, haciendo uso de las palabras clave: “A. cunicularia”, “lechuza de los arenales”, “distribución geográfica”, “Amazonia”, “actividades antropogénicas”, “Strigidae”, “egagrópilas” y “regúrgitos”. Se tuvieron en cuenta 63 artículos científicos relevantes con datos sobre poblaciones en Perú o países aledaños, publicados entre 1973 y 2021. Datos de distribución de la especie fueron obtenidos de la base de datos de GBIF (2020), que incluyen los registros de múltiples bases de datos, tanto de colecciones científicas como de observaciones de campo (i.e. eBird); y también, de la información bibliográfica revisada. Adicionalmente, se utilizó como base el mapa de distribución a nivel mundial de BirdLife International (2016) y a nivel nacional el de Schulenberg et al. (2006).
Resultados y discusión
Athene cunicularia en Brasil y Bolivia
En Brasil la especie se encuentra en campos abiertos, pastizales, bancos de arena, sabanas y gramadales, campos cultivados y ganaderos, y en áreas urbanas es común en ciudades, parques urbanos y canchas de golf; en los bosques de arena blanca (Alonso et al., 2013).
En la Amazonía brasileña se ha registrado en sabanas naturales o en espacios abiertos. El primer registro fue en 1966 en el Estado de Roraima (Gomes et al., 2013); luego, se reportó en 1991, en Alta Floresta, norte de Mato Grosso (Zimmer et al., 1997); en 1992 se recolectó una muestra en Pará (Aleixo & Poletto 2007) y, en ese mismo año, se registró en zonas de pastizales en el Estado de Amazonas, (Cohn et al., 1997); en 1994 se tuvo un nuevo registro en Alta Floresta (Zimmer et al., 1997). En Manaos, el primer registro fue en 1992 por Bierregaard, quien observó a un solo individuo en un área de pastos y en julio de 1994, se registró un individuo en la misma ubicación (Cohn et al., 1997). Entre el 2006 y 2012, fueron reportados, algunos ejemplares en los municipios de Presidente Figueiredo; también ha sido registrada en los bosques de arena blanca, pasturas y áreas modificadas por el hombre en el noroeste de Rondônia, en el sur de la Amazonia de Brasil (Guilherme et al., 2018).
En la Amazonia de Bolivia, el 20 de febrero de 2007, se registraron tres individuos de A cunicularia en el trayecto de la carretera Cobija - Puerto Rico, cerca del poblado del Porvenir, Provincia Nicolás Suárez, Departamento de Pando, en un pastizal de uso agropecuario, que anteriormente fue un bosque y que ha podido favorecer a esta especie para colonizar nuevas áreas (Miserendino, 2007). El segundo registro para la Amazonía boliviana fue el 16 de junio de 2015 en la “Carretera 19 Extrema”, en un área deforestada de la localidad de Mukden, donde se reportaron dos ejemplares, a una elevación de 120 m, en el Departamento de Pando (Richard et al., 2017)
Athene cunicularia en el Perú
En el Perú, ocupa una amplia variedad de hábitats en zonas áridas, bosques de algarrobo, chaparral, campos abiertos, lomas costeras, planicies desérticas, dunas, desiertos con cactáceas o tillandsiales en suelos arenosos de los ríos, humedales, terrenos de cultivo, quebradas, monte ribereño, sabanas, pajonal de puna y estepas; en la vertiente occidental y en las zonas andinas prefiere lugares rocosos (Salinas et al., 2006; Pulido et al., 2013).
La especie ha sido registrada en las vertientes occidentales de los Andes, los valles interandinos y la puna (Schulenberg et al., 2006). Anteriormente desconocida en la Amazonía peruana, esta especie se ha encontrado en pequeñas cantidades en áreas agrícolas y a lo largo de ríos en las Regiones de Loreto, Ucayali y Madre de Dios (Figura 1). Aunque los registros sobre A cunicularia son escasos, se tienen algunas evidencias de que se reproduce en la Amazonia baja del Perú desde los últimos 20 años. El primer registro reportado fue en el Parque Nacional Manu, Región Madre de Dios (Yábar, 2008). En los alrededores de Puerto Maldonado, A. cunicularia fue registrada en los pastizales de Triunfo, Albergue y Palma 1 (Los Ángeles), lo que constituye el primer reporte de esta especie en los alrededores de Puerto Maldonado (Butrón & Tapia, 2010), ampliando así su área de distribución establecida por Schulenberg et al. (2006).
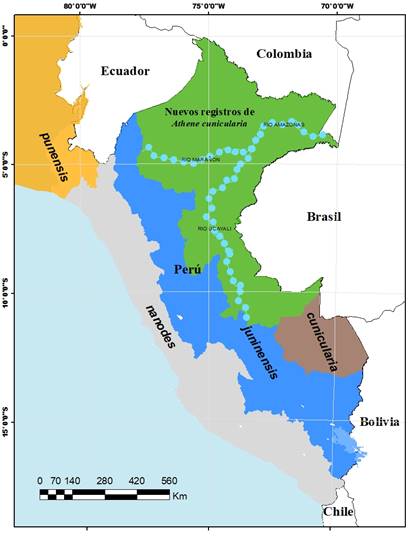
Fuentes: TheCornellLab of Ornithology (2020); Schulenberg, et al. (2006); Harvey et al. (2014); Delzo et al. (2019). y Pulido et al., 2021.
Figura 1 Distribución de subespecies y nuevos lugares de registros de Athene cunicularia en la Amazonia
Posteriormente, Harvey et al. (2014) han observado en tres ocasiones, en campos alrededor del pueblo de Atalaya y en las islas fluviales del río Tambo y Río Ucayali: dos adultos y dos jóvenes apenas capaces de volar, el 17 octubre de 2008 en un campo al sureste de Atalaya; dos adultos, incluida una hembra con un huevo calcificado en el oviducto, y que fueron colectados en una isla en el río Tambo el 24 de julio de 2010. Estos registros constituyen para la Región de Ucayali las primeras observaciones documentadas acerca de su reproducción en la Amazonía peruana.
Delzo et al. (2019) la registra para el Distrito de Calleria, Provincia de Coronel Portillo en Pucallpa, Región Ucayali. Adicionalmente, el 26 de febrero de 2020 se registraron dos individuos adultos de A. cunicularia en un canal de drenaje del Aeropuerto Internacional Capitán FAP David Abensur Rengifo, que se encuentra ubicado en el Departamento de Ucayali, Provincia de Coronel Portillo, en la ciudad de Pucallpa, cuyas coordenadas geográficas son: latitud: 8° 19' 59'' S, longitud 74° 37' 59'' W, elevación de 154 msnm. Aunque no se encuentran documentadas, observadores experimentados de aves la registran para las Regiones de San Martín, Amazonas, Cajamarca, Huánuco, Pasco, Junín, Huancavelica, Ayacucho, Apurímac, Cusco, en chacras, zonas de purmas y jardines de alojamientos (Tabla 1).
Tabla 1 Registro de observaciones de Athene cunicularia de la sierra y Vertiente Oriental de los Andes Peruanos
| Región/Lugar de referencia | Observador y año | |
|---|---|---|
| Cusco: | La Convención | Venero 2020. |
| Urubamba | Walker 2002, 2005, 2015; Venero 2015. | |
| Acjanaco | Drucker 2013. | |
| Sabaluyoc, Hacienda Meli | Tupayachi 2018. | |
| Ayacucho: | Lucanas | Venero & Brokaw 1980. |
| Puno: | Melgar | Venero 2012; Huamán-Tapara 2018. |
| Apurímac: | Antabamba | Venero 2011; Baiker 2011. |
| Aymaraes | Venero 2011; Baiker 2011. | |
| Madre de Dios: | Collpa Mascoitania | Maggini 2017; Bittermann 2017; Padilla 2018; Valdez 2018; Losh 2018; Steele 2018; Svingen 2018; Barton 2018; García 2019. |
| Manu | Yabar 2007. | |
| Boca Manu Pueblo | Rainville 2015. | |
| Manu, Pakitza | Vavrek 2018. | |
| Amazon Manú Lodge | Oullette 2014; Vanier 2014. | |
| Manu Birding Lodge | Salas 2017; Jilahuanco 2017; Molina 2017; Maceda 2017; García 2017; Gonzales 2017; Llactahuaman 2020. | |
| Rio Madre de Dios, Isla Rolin | Schulenberg 2012; Komar 2012; Andersen 2012; Johnson 2012. | |
| Manu Wildlife Center | Ahlman 2005; Hill 2008; Neumuth 2017; Whitebread 2017; Waters 2017; Whitebread 2017. | |
| Ucayali: | Atalaya | Harvey 2014; Johnson 2015. |
| Coronel Portillo | Delzo et al. 2019; Pulido 2020 | |
| Cashibo Ecolodge | Sales 2019; Rodríguez 2019; Bejarano 2019; Escajadillo 2019. | |
| Loreto: | Maynas | Olmos 2012; Cubas 2012; Fong 2018. |
| Amazonian River Islands | Bates 2018. | |
| Explorama Lodge | Reina 2020; Morgan 2020; Beil Morgan 2020. | |
| Islas del Rio Amazonas | Carnes 2011; Olmos 2012; Armas 2018. | |
| Isla Joven Capironal | Arévalo 2020. | |
| Yurimaguas | Mercurio 2016. | |
| Pasco: | Oxapampa, Pozuzo | Galván 2019, 2020. |
| Junín: | Satipo | Chumpitaz 2018. |
| San Martín: | Bellavista | Lane 2016; Johnson, 2016. |
| Tarapoto | Gonzales 2017. | |
| Amazonas: | Chachapoyas | September 2013. |
| Bagua Grande | Beadle 2008; Gonzales 2017, 2018. | |
| Huánuco: | Tingo María | Pinedo 2019. |
| Cajamarca: | Cumbemayo | Bormann 2017. |
| Santa Rosa | Rodríguez 2019; Lozano 2019; Vera 2019. | |
Fuentes: TheCornellLab of Ornithology (2020); Schulenberg, et al. (2006); Harvey et al. (2014); Delzo et al. (2019).
Un aspecto de particular interés es la sucesión de hábitats en el valle superior de Ucayali alrededor del pueblo de Atalaya, en las islas fluviales del río Tambo y Río Ucayali que han sido fuertemente influenciados por la actividad humana. Las áreas abiertas han aumentado como resultado de la colonización y la expansión humana, y esta tendencia estaría impulsando la aparición de una serie de especies de aves que se han considerado raras o locales en la cuenca del Amazonas (Harvey et al., 2014). A. cunicularia sería un colono reciente de la Amazonía peruana, y aunque las actividades antrópicas serían perjudiciales para las especies más especialistas, también podrían aportar beneficios a muchas otras especies más generalistas como lo es A. cunicularia, aprovechando el cambio en la estructura ambiental y aumentando entonces su área de distribución (Pulido et al., 2021).
Los hábitats sucesionales y periféricos podrían ser importantes no solo para los residentes, sino también por la diversidad de los migrantes boreales y australes, y parece probable que estas especies, así como las del interior del bosque, se vean influenciadas a medida que continúa la deforestación. Esa es la situación del alitorcido rufo Cnipodectes superrufus de la familia Tyrannidae, que habita en el suroeste de la Amazonia, en Ucayali, Cuzco y Madre de Dios, en el sur de Perú (Fjeldså, 2020), que tiene una baja capacidad de dispersión y no logra migrar hacia nuevos hábitats. Muchas de las especies registradas en este hábitat están muy extendidas en áreas abiertas en la cuenca del Amazonas, y otras son raras y locales en la Amazonía, incluidas A. cunicularia y Gampsonyx swainsonii (Harvey et al., 2014).
Origen de la población de A. cunicularia en la Amazonía del Perú
El Comité de Registros de Aves Peruanas (CRAP, 2015) considera que las poblaciones amazónicas peruanas de A. cunicularia no pertenecen a ninguno de los taxones de los Andes o de la costa del Pacífico, como es el caso de A. c. punensis, A. c. nanodes y A. c. juninensis, y que los taxones presentes en las tierras bajas de la Amazonia peruana tampoco corresponden a A. c. boliviana. El CRAP (2015) recomienda una reevaluación actual de las taxa que componen A. cunicularia para establecer las poblaciones que podrían haber ampliado su rango de distribución hacia la Amazonía del Perú. Mientras no se tenga mayor información, existiría la incertidumbre de si es una o son más las subespecies que actualmente han ampliado su rango distribución en la Amazonia peruana.
Guilherme et al. (2018) sugiere que en Brasil la expansión de la distribución de la especie no está ocurriendo linealmente, sino indistinta y paralelamente en varios lugares de manera independiente y posiblemente estén relacionados con los factores antrópicos, sumado a factores ecológicos y del comportamiento propio de la especie. Este mismo desplazamiento de A. cunicularia se está dando desde Brasil hacia la selva baja peruana (Gomes et al., 2013). Al respecto, Sick (1997) mencionó que A. cunicularia aprovecha los cambios en el paisaje forestal para ampliar su rango de distribución en colinas con muy poca vegetación en Río de Janeiro y en Brasilia. Los registros de A. cunicularia para la región central del Estado de Amazonas también sugieren que la especie está expandiendo su distribución a través de la Amazonia, luego de la amplia transformación de áreas forestales a pastos y tierras agrícolas (Aleixo & Poletto, 2007). En el Parque Municipal do Sabiá, Uberlândia, Estado de Minas Gerais, un sitio de alta actividad humana, se han identificado lugares de selección y reutilización de sitios de nidificación de A. cunicularia (Martinelli, 2010). Adicionalmente, Cohn et al. (1997) efectuaron una evaluación ocho años después, en un área previamente inventariada, y encontraron 15 especies como nuevos colonizadores en el área; del mismo modo, Gomes et al. (2010) registraron la expansión de la distribución de Anodorhynchus hyacinthinus y Schistochlamys melanops en el Estado de Amazonas. Considerando estos antecedentes y el presente análisis, A. cunicularia podría estar adoptando la misma estrategia de ampliación de su área de distribución.
En el Perú es muy probable que las poblaciones de A. cunicularia hayan ingresado a la selva baja siguiendo la trayectoria de los valles interandinos que atraviesan la selva alta y confluyen, en la selva baja, con la mayoría de los ríos que componen la cuenca hidrográfica del río Amazonas. En las márgenes de los ríos se han establecido terrenos de cultivo, lo que ha traído como consecuencia que progresivamente la vegetación de árboles y arbustos de gran tamaño haya sido eliminada, para dar a paso a una mayor área cultivada. Esta situación podría haber generado condiciones propicias para que a lo largo de los años A. cunicularia progresivamente haya empezado a colonizar nuevos lugares en las partes bajas de la Amazonia.
Esta situación se ve reflejada en el caso de la selva baja sur oriental siguiendo el recorrido del rio Madre de Dios, que nace en las estribaciones orientales de la cordillera de Vilcanota (Cuzco), desciende por Pilcopata, donde se denomina río Alto Madre de Dios, continua su descenso por la llanura hasta la confluencia con el río Manú, donde es llamado río Madre de Dios. Haciendo el seguimiento de los reportes de numerosos observadores de aves, la especie es registrada durante todo el trayecto del rio Madre de Dios hasta llegar a selva baja por el Manu (TheCornellLab of Ornithology, 2020). La otra ruta es la postulada por Yábar (2008), que la especie está colonizando nuevas áreas desplazándose desde Bolivia hacia el Perú. En estas circunstancias, A. cunicularia ha ingresado a Perú desde el Acre, Brasil, donde existe una fuerte deforestación. Al respecto, Guilherme (2012) señala que algunas especies invasoras como Geranoaetus albicaudatus, Caracara plancus, Vanellus chilensis y A. cunicularia, se han ubicado principalmente en el extremo oriental del Estado, en la frontera con Perú, presumiblemente debido a la alta densidad de población humana y la existencia significativa de hábitats alterados. Esta parte de Acre está conectada al Estado de Rondônia por medio de una carretera que atraviesa muchos grandes ranchos ganaderos, lo que explica por qué algunas especies, como A. cunicularia, han colonizado el Estado, desde el Este, hacia Cruzeiro do Sul, así como áreas en el Sureste, en dirección a las ciudades de Brasiléia y Assis Brasil, en la frontera con Bolivia y Perú (Guilherme & Santos, 2009; Guilherme & Dantas, 2011).
Conclusiones
Los cambios ambientales que están ocurriendo en la Amazonia peruana estarían impactando en la diversidad de especies por dos caminos definidos: la destrucción del bosque primario por efecto de las actividades antropogénicas, que está ocasionando la perdida de diferentes especies de vertebrados e invertebrados; y por otra, la generación de nuevos hábitats, como los bosques secundarios en sus diversas caracterizaciones, que favorece la aparición de hábitats propicios para la colonización de especies provenientes de ambientes intervenidos.
Athene cunicularia, especie típica de las zonas áridas en las Vertientes Occidentales, la Puna y los altos Andes, desde hace veinte años está colonizando hábitats específicos producto de las etapas de sucesión como purmas y bosques secundarios, que se han generado como consecuencia de la devastación de los bosques primarios de la Amazonia; lo que sugiere que es una especie indicadora en lugares donde se produce la destrucción de los bosques y probablemente el avance del cambio climático.
Se propone que el avance de A. cunicularia en la colonización de la Amazonia, desde el lado peruano, sería siguiendo la ruta de los ríos que descienden por los valles interandinos, atraviesa la selva alta y llegan a la selva baja, acompañando el proceso de avance del establecimiento de terrenos de cultivo y asentamientos humanos.












 uBio
uBio 

