Introducción
Los riesgos potenciales asociados con la liberación de productos farmacéuticos humanos al ambiente se han convertido en un tema cada vez más importante en la salud ambiental (Pereira et al., 2020). Los analgésicos y los fármacos antiinflamatorios no esteroideos (AINE) se encuentran en los contaminantes emergentes más frecuentes en cuerpos de agua (Żur et al., 2018; Xie et al., 2020; Adeleye et al., 2021) y la toxicidad ha comenzado a manifestarse en diferentes componentes biológicos de los ecosistemas (Muñiz-González, 2021). Asimismo, los barbitúricos pueden inducir enzimas de desintoxicación en invertebrados (Kotze et al., 2014).
El reporte de ibuprofeno en los ecosistemas se debe a la liberación del fármaco no metabolizado en la orina y la directa eliminación de pastillas no utilizadas u obsoletas en las aguas residuales (Buser et al., 1999; Hernando et al., 2006). Parolini (2020) demostró que la exposición al ibuprofeno induce daño celular y genético moderado en el mejillón cebra Dreissena polymorpha. Los AINE pueden tener consecuencias peligrosas para toda la cadena trófica de agua dulce afectando la biodiversidad y el funcionamiento de los ecosistemas. Willoughby et al. (2006) determinaron en poblaciones de Drosophila melanogaster que el barbitúrico fenobarbital induce la expresión de varios genes asociados al citocromo P450 y Glutatión-S-Transferasa (GST).
La aparición de poblaciones resistentes se puede considerar un proceso inevitable debido a la continua presión de selección de moléculas tóxicas como los insecticidas (Brattsten, 1990). Sin embargo, la exposición a contaminantes emergentes, en dosis subletales, tienen un efecto desconocido y a largo plazo sobre la diversidad especifica presente en los ecosistemas (Austin, 1998).
Riaz et al. (2009) demostraron la tolerancia a insecticidas en larvas de Aedes aegypti expuestas a dosis subletales de glifosato y benzo[a]pireno, posiblemente debido a la inducción cruzada de genes que codifican enzimas de desintoxicación. Asimismo, similares resultados obtuvieron Poupardin et al. (2008) al exponer larvas de Ae. aegypti a permetrina previa exposición al fluoranteno y cobre, y al temefos después de la exposición a la atrazina y al cobre. Se ha demostrado que las colinesterasas EST-13 y EST-14 encontradas en larvas pretratadas con fenobarbital están involucradas en la tolerancia al temefos (Sousa-Polezzi & Bicudo, 2004b).
Por otro lado, la exposición de larvas de Ae. albopictus al benzotiazol y al pentaclorofenol aumentaron la tolerancia a diferentes tipos de insecticidas como carbaril, rotenona y temefos (Suwanchaichinda & Brattsten, 2001, 2002).
Los contaminantes emergentes son sustancias no monitoreadas en el ambiente y su impacto en los ecosistemas aún no están descritos (Geissen et al., 2015). Por ello, surge la necesidad de monitorear el impacto de dichos contaminantes en el metabolismo de los insecticidas. El presente trabajo tuvo por objetivo determinar la variación en la tolerancia al larvicida temefos en poblaciones de Aedes aegypti expuestas a los fármacos ibuprofeno y fenobarbital, así como evaluar los efectos en la actividad enzimática de las esterasas.
Materiales y métodos
Insectos
Para la realización de los experimentos se utilizaron colonias de Ae. aegypti criadas en el Laboratorio de Artropodología Parasitaria de la Universidad Nacional de Trujillo (La Libertad / Perú). Los estadios inmaduros se colocaron en recipientes con agua destilada estéril y alimento balanceado estéril, a 26.5 ± 1.0 °C, 60 ± 5% de humedad relativa y fotoperiodo de luz (12 h): oscuridad (12 h). La población Rockefeller (Rock, cepa susceptible de referencia) fue proporcionada por el Instituto Nacional de Salud (INS), Lima / Perú. La población silvestre La Esperanza (LE) fue colectada del Distrito La Esperanza, Provincia Trujillo, Región La Libertad, Perú.
Fármacos e Insecticida
Dos fármacos fueron usados en los ensayos: i) Fenobarbital Sódico® que contiene 200 mg/ 2 ml del ingrediente activo fenobarbital fabricado por CIPA S.A. (Lima, Perú), y, ii) Fredol® que contiene 400 mg del ingrediente activo ibuprofeno fabricado por Laboratorios Naturales y Genéricos S.A.C. (Lima, Perú). El insecticida utilizado fue Tecnilarv G® que contiene 1% del ingrediente activo temefos fabricado por Tecnología Química y Comercio S.A. (Lima, Perú).
Exposición de las larvas a los fármacos
Se establecieron tres grupos: dos experimentales IBU (ibuprofeno 17.7 µg/ml) y PB (fenobarbital 200 µg/ml) y un testigo S/F (sin fármaco). La elección de las concentraciones de los fármacos se basó en las bajas concentraciones reportadas en cuerpos de agua, asimismo en la concentración plasmática del ibuprofeno (Villalva-Rojas et al., 2007) y en la concentración usada por Sousa-Polezzi & Bicudo (2004a).
Para cada grupo, se utilizó un litro de solución donde se expusieron 1 000 larvas I a fin de obtener larvas III que fueron utilizadas en la determinación de la tolerancia al insecticida. A las 48 y 72 h de iniciado la exposición, se le añadió 500 ml más de cada solución. Las soluciones de los fármacos fueron preparadas con agua destilada estéril.
Determinación de la tolerancia al larvicida temefos
El método de la OMS (WHO, 2005) se usó para medir la tolerancia al insecticida. Las larvas III de cada tratamiento fueron expuestas al larvicida temefos (0.005, 0.025 y 0.050 μg/ml) y agua destilada (como solución control). Los ensayos se realizaron por triplicado, bajo condiciones controladas similares a la crianza. La mortalidad se registró a las 1, 2, 3, 4, 5, 6, 12 y 24 h. Las larvas se consideraron muertas cuando no presentaron movimiento al ser tocadas con un estilete en el sifón o región cervical.
Determinación de las esterasas
Para determinar las alfa- y beta-esterasas se utilizó el método propuesto por Rodríguez et al. (2001, 2003). Este protocolo se realizó en las larvas III que sobrevivieron en los ensayos con el insecticida. Las densidades ópticas se determinaron a 630 nm en un lector de microplaca Stat Fax® Modelo 3200 (Awareness Technology; Florida, USA).
Análisis de datos
El porcentaje de mortalidad se expresó como la media ± error estándar. La actividad enzimática de las esterasas de las poblaciones expuestas a fármacos se evaluó mediante la prueba de comparación no paramétrica Kruskal-Wallis, seguido de la prueba post hoc Bonferroni y se expresaron como la media ± error estándar. Los análisis estadísticos se desarrollaron con el software OriginPro® 2021 (OriginLab Corporation, USA) y el nivel de significancia se definió como p ≤ 0.05 para todas las comparaciones.
La dosis letal media (DL50), la dosis letal 90 (DL90) y los límites de confianza al 95% con la prueba de bondad de ajuste de Pearson se calcularon mediante el modelo PROBIT. Este análisis se realizó mediante el software SPSS 22.0 (IBM SPSS Statistics, USA).
Resultados
En las larvas pretratadas con IBU (17.7 μg/ml) y PB (200 µg/ml) no se encontró mortalidad en las poblaciones de Ae. aegypti silvestre LE y de referencia Rock.
En la Figura 1 se muestra la variación del porcentaje de mortalidad de larvas III expuestas al larvicida temefos en las poblaciones LE y Rock de Ae. aegypti pretratadas con ibuprofeno 17.7 µg/ml y fenobarbital 200 µg/ml.
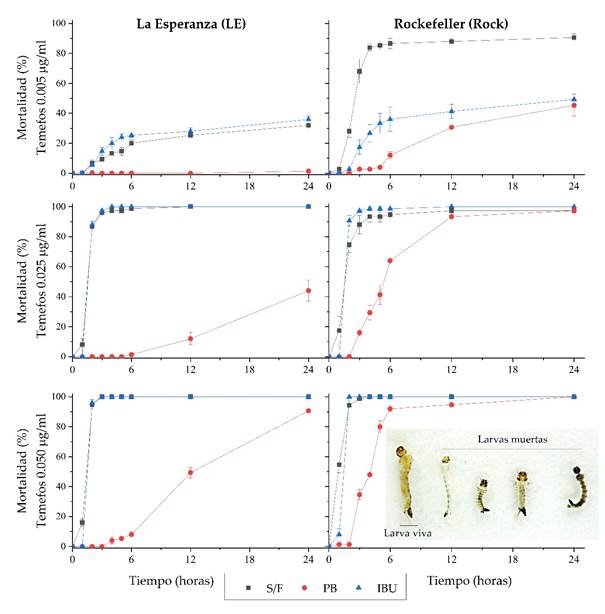
Figura 1 Curvas de mortalidad al larvicida temefos (0.005, 0.025 y 0.050 µg/ml) de dos poblaciones de Aedes aegypti expuestas a ibuprofeno 17.7 µg/ml y fenobarbital 200 µg/ml.
En la población LE expuesta al fenobarbital (LE-PB) y en la población Rock expuesta al fenobarbital (Rock-PB) se evidencia un aumento en la tolerancia al temefos. Al comparar las curvas de mortalidad generadas por temefos se observaron similares patrones entre la población LE expuestas al ibuprofeno (LE-IBU) y la población LE sin fármaco (LE-S/F). Asimismo, las curvas de mortalidad frente al temefos fueron diferentes al comparar las poblaciones Rock expuestas al ibuprofeno (Rock-IBU) y Rock sin fármaco (Rock-S/F).
En la Figura 2 se muestra la actividad enzimática de las alfa y beta-esterasas de las poblaciones LE y Rock. La actividad de las alfa-esterasas en la población LE-PB y LE-IBU muestran diferencias significativas (p < 0.001), al igual que la población Rock-PB y Rock-IBU. Las densidades ópticas de la actividad de las beta-esterasas fueron diferentes entre las poblaciones LE-PB y LE-IBU (p < 0.001) y Rock-PB y Rock-IBU (p < 0.008). El PB disminuye la actividad de las alfa-esterasas y el IBU aumenta las beta-esterasas de la población silvestre LE al ser comparadas con el grupo S/F.
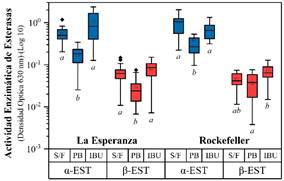
Figura 2 Actividad enzimática de las esterasas presentes en larvas de Ae. aegypti tratadas con ibuprofeno y fenobarbital.
En la Tabla 1 se muestra la toxicidad del larvicida temefos (DL50, DL90 y los respectivos límites de confianza al 95%) de las poblaciones ensayadas. La DL90 de LE-IBU y LE-S/F muestran valores similares; sin embargo, al analizar la DL90 de la población Rock-IBU tiende a ser menor en comparación con el grupo Rock-S/F.
Tabla 1 Toxicidad del larvicida temefos de dos poblaciones de Aedes aegypti.
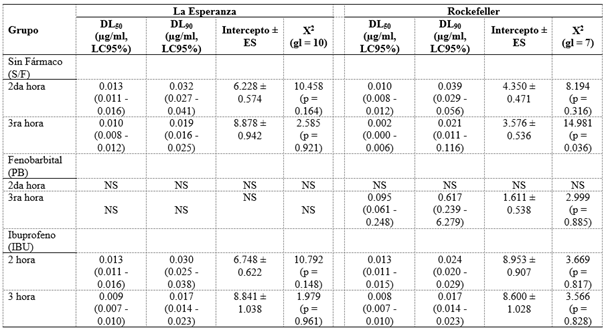
DL50, concentración letal que afecta al 50% de la población. DL90, concentración letal que afecta el 90% de la población. ES, Error estándar. LC95%, límite de confianza al 95%. Prueba de bondad de ajuste de Pearson. X2, Chi-cuadrado. gl, grados de libertad. NS, no se encontró mortalidad
Discusión
La tolerancia de las larvas LE y Rock expuestas a pretratamiento al IBU y PB concuerda con lo reportado por Hu et al. (2017), quienes al realizar un tratamiento continuo de huevos con 0.2 mg/ml de solución acuosa de PB hasta el cuarto estadio y con un tratamiento discontinuo de larvas con 0.26 mg/ml en solución acuosa expuestas por 30 h antes de utilizarlos en los ensayos con un biolarvicida, en ambos no tuvieron mortalidad larvaria.
La mortalidad de larvas LE-IBU (9.0 ± 0.58%) expuestas al organofosforado temefos a la concentración de 0.005 µg/ml fue similar al grupo LE-S/F (8.0 ± 0.58%) hasta las 24 horas. Estos resultados podrían atribuirse a las características que tiene una población procedente de padres silvestres cuyos hábitats contienen ciertas dosis de fármacos y/u otros contaminantes, pues se ha reportado que cada año un gran número de compuestos farmacéuticos son consumidos y luego de su metabolismo parcial y desecho, ingresan al alcantarillado de las plantas de tratamiento (Marchlewicz et al., 2015). Sin embargo, la eliminación de estos compuestos no es eficiente, y se reportan en plantas de tratamiento de aguas residuales, aguas superficiales e incluso en agua de consumo humano (Żur et al., 2018; Xie et al., 2020; Adeleye et al., 2021). Además, el ibuprofeno es uno de los AINE de alto consumo en el mundo y ha sido detectado en el medio ambiente en el rango de concentración de ppt a ppb (Murdoch & Hay, 2015; Marchlewicz et al., 2017; Żur et al., 2018).
Las DL50 y DL90 de las poblaciones LE-IBU y LE-S/F fueron similares con las de Rock-IBU y Rock-S/F, hasta las 3 h de evaluación. Esto se debería a que la cepa Rock es susceptible a insecticidas (Costa-da-Silva et al., 2017) y que por ser una población mantenida en laboratorio ha perdido rasgos originales o la adquisición de características atípicas de una población silvestre, lo que explicaría la diferencia en la respuesta de la población LE y Rock. Los resultados revelaron que el IBU no altera la respuesta en cuanto a la tolerancia al insecticida temefos.
La baja mortalidad al temefos (0.025 y 0.050 µg/ml) en larvas de la población LE-PB se debería a que este producto xenobiótico induce la producción de enzimas detoxificantes como el citocromo P450, GST, entre otras enzimas, con acción detoxificantes (Kotze, 1995). Según Hemingway et al. (2004) la resistencia metabólica generalmente implica el aumento de la actividad de cualquiera de los tres grupos principales de enzimas de desintoxicación: carboxilesterasas, oxidasas multifunción (MFO) y GST en Ae. aegypti.
El sistema enzimático del citocromo P450 juega un papel importante en el metabolismo de una amplia gama de productos químicos endógenos y exógenos, pues están implicados en la resistencia de los insectos a los plaguicidas organofosforados y carbamatos. Se ha demostrado que el PB promueve la resistencia a los insecticidas al inducir la sobreexpresión del citocromo P450 (Hu et al., 2017), lo que respaldaría los resultados encontrados.
Se han implicado tres familias de enzimas metabólicas en el metabolismo de insecticidas: esterasas, GST y P450, dado que la resistencia a los insecticidas en una población de mosquitos podría verse afectada simultáneamente por más de un mecanismo (Kasai et al., 2014).
En la población LE-IBU hubo mayor diversidad en la respuesta a la producción de alfa esterasas en comparación con LE-S/F; sin embargo, no se encontraron diferencias estadísticamente significativas entre ellas, pero sí con la población LE-PB donde hubo una menor densidad óptica en comparación con las anteriores. Estos resultados concuerdan con lo comunicado por Sousa-Polezzi & Bicudo (2004b), quienes investigaron el efecto de PB en la inducción de tolerancia al insecticida organofosforado temefos en larvas de Ae. aegypti encontrando un aumento de tolerancia, lo que sugiere que las oxidasas no están involucradas en el proceso de tolerancia y que PB induce la expresión de esterasas que están involucradas en la tolerancia a temefos, mecanismo responsable del desarrollo de resistencia a insecticidas.
Asimismo, se evidenció la reducción del tamaño en las larvas de Ae. aegypti pre expuestas a los fármacos durante la ejecución de los bioensayos; estos resultados también han sido reportados por Sousa-Polezzi & Bicudo (2004a) quienes determinaron el efecto del PB sobre la emergencia y la longevidad de los adultos.
El PB aumenta la tolerancia al temefos en el mosquito Ae. aegypti, a diferencia del IBU. Estos resultados indican que los contaminantes emergentes deben ser considerados en los programas de vigilancia de susceptibilidad vectorial a insecticidas para evitar resistencia por preexposición a dosis subletales. Asimismo, se deben realizar estudios con otros xenobióticos frecuentemente encontrados en cuerpos de agua y con otros modelos animales de interés médico-veterinario.
Conclusiones
El presente estudio determinó que existe variación en la tolerancia al temefos en las poblaciones de Aedes aegypti La Esperanza y Rockefeller pretratadas con fenobarbital e ibuprofeno; encontrándose un incremento de la tolerancia en las poblaciones expuestas a fenobarbital. Asimismo, se determinó que el ibuprofeno estimula la actividad de las alfa y beta-esterasas.












 uBio
uBio 


