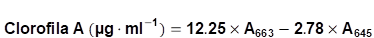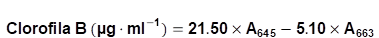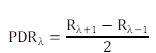Introducción
La clorofila es el pigmento fotorreceptor responsable de la primera etapa en la transformación de energía solar en energía química y, consecuentemente, la molécula responsable de la existencia de vida superior en la tierra. La clorofila cumple un rol central en la cosecha de luz y en la transferencia de energía, desde los sistemas periféricos hacia la parte central de los fotosistemas I y II, iniciando la separación de cargas en el centro de reacción de los fotosistemas (Allen et al., 2011). De las cinco clases de clorofila (A, B, C, D y F), la A es la más abundante, y de aquí su importancia en el aparato fotosintético (Bryant et al., 2020). En general, el metabolismo de la clorofila puede ser dividido en cuatro áreas funcionales, siendo las principales: la síntesis de clorofila A, la biosíntesis tetrapirrólica y la catálisis de la inter-conversión de la clorofila A y la clorofila B, respectivamente (Mochizuki et al., 2010; Tanaka & Tanaka, 2011).
La mayor cantidad de nitrógeno (N) en las hojas está incorporada en la clorofila. Por tal razón, cuantificando el contenido de clorofila obtendremos una medida indirecta del nivel de N en las hojas (Moran et al., 2000; Sui et al., 2018).
Por otro lado, las técnicas más ampliamente utilizadas para la determinación de clorofila en tejidos vegetales se basan en la extracción de clorofila con acetona al 80% (Lichtenthaler & Buschmann, 2001) o con etanol al 95% (Song et al., 2021b). No obstante, aunque precisas, estas técnicas presentan algunas desventajas, como el requerimiento de equipos especializados, elevado número de muestras, reactivos de alto costo, así como el tiempo que exige implementarlas en sus diferentes etapas. Sin embargo, a través de diversos dispositivos óptico-electrónicos es posible estimar la cantidad de clorofila total en los tejidos foliares.
En años recientes, técnicas de percepción remota aplicadas a la agricultura han realizado progresos para desarrollar métodos que estiman parámetros bioquímicos a nivel de hoja, como las concentraciones de clorofila, el contenido de N, carotenoides, etc. Así, tenemos instrumentos comerciales que estiman los contenidos relativos de clorofila midiendo la absorbancia del tejido foliar en específicas longitudes de onda. El SPAD-502 (Minolta corporation, Ltd., Osaka, Japan) en 656 y 774 nm (Minolta, 1989), Greenseeker Handheld (Trimble Navigation Ltd. Sunnyvale, CA, USA) en 656 y 774 nm (Ali et al., 2015), CCM-200 (Opti-Sciences, Inc., Hudson, NH) y MC-100 (Apogee Instruments, Inc., Logan, UT, USA), estos últimos miden en 653 y 931 nm (Parry et al., 2014; Ali & Imran, 2020).
El desarrollo de nuevos detectores portables de concentraciones relativas de clorofila ha tenido éxito a partir de la integración de sensores espectrales compactos de bajo costo, microcontroladores, programas diseñados a medida con pruebas de validación y calibración en condiciones de laboratorio y campo (Song et al., 2021b). Del mismo modo, cámaras integradas en un celular y una fuente de luz LED (por sus siglas en inglés: “light-emitting diodes”) pueden adquirir imágenes en el rango visible (400-700 nm) que estiman los niveles de clorofila en las hojas (Putra et al., 2022).
Estudios realizados en leguminosas, gramíneas, hortalizas, frutales y especies forestales presentaron una alta correlación entre el contenido de clorofila foliar y las unidades SPAD (por sus siglas en inglés: “Soil Plant Analyzer Device”) que brinda el detector de clorofila SPAD-502 (Murillo-Amador et al., 2004; Uddling et al., 2007; Hawkins et al., 2009; Coste et al., 2010; Zhu et al., 2011). Asimismo, diferentes trabajos calibraron el detector SPAD-502 para el cultivo de arroz (Lin et al., 2010; Yuan et al., 2016; Zhang et al., 2017), frijol caupí (Murillo-Amador et al., 2004), trigo (Triticum aestivum L.) (Bürling et al., 2011; Wang et al., 2016), papa (Borhan et al., 2017), con el propósito de detectar posibles deficiencias de N y/o clorofila. Sin embargo, si deseamos monitorear a nivel de dosel o extensas áreas de cultivos, el método basado en absorbancia de dichos instrumentos portables no es de fácil escalar. En estas circunstancias, corresponde utilizar técnicas globalizadoras que permitan monitorear extensas áreas de forma rápida y no intrusiva. En tal sentido, Zhang et al. (2021) estudiaron el contenido de clorofila a nivel de follaje y su relación con el estado fisiológico en remolacha azucarera utilizando un espectroradiómetro para medir la reflectancia del follaje. Ellos encontraron que el índice (R710 - R780)/R780 fue el mejor estimador de clorofila en tres estadios vegetativos.
La radiación solar incidente en el rango de 400 a 700 nm es mayormente absorbida por la vegetación, por esta razón, recibe considerable atención en estudios de reflectancia de las plantas. Adicionalmente, el incremento de la reflectancia en el rojo lejano (región espectral entre 690 - 740 nm) es una respuesta genérica que resulta en un indicador temprano y más consistente de estrés que otras regiones del espectro solar incidente (Carter et al. 1996). Estos estudios han sugerido que alteraciones de la reflectancia en el espectro visible por condiciones de estrés resultan de la sensibilidad de las concentraciones de clorofila en las hojas (Knipling, 1970; Puangbut et al., 2017). Diversos estudios han mostrado que índices basados en reflectancia en el rojo lejano pueden estimar con precisión las concentraciones de clorofila en hojas (Frankenberg et al., 2018; Zheng et al., 2018; Zhang et al., 2022). De este modo, las propiedades ópticas de la hoja cercanas a los 700 nm son cruciales para la detección de estrés en plantas y la estimación de concentraciones de clorofila en hojas.
Experimentos realizados en las plantas Ginkgo biloba y Zelkova serrata, relacionaron las concentraciones de clorofila A por unidad de área (CLA) y la primera derivada espectral de los datos de reflectancia en determinadas longitudes de onda (DRλ), encontrándose una alta correlación en la vecindad del borde rojo (Endo et al., 2001b). En esta misma línea de investigación, experimentos realizados en almendra (Prunus dulcis), álamo (Populus trichocarpa) y manzana (Malus domestica) relacionaron las concentraciones de clorofila en hojas y la primera derivada de la reflectancia foliar respecto a las longitudes de onda, encontrándose que hay un óptimo en las regiones rojo lejano y verde (Ding et al., 2009). Similarmente, experimentos realizados en hojas de pepino (Cucumis sativus), realizados por Endo et al. (2001a), encontraron una alta correlación entre los datos de la primera derivada de los espectros de reflectancia y las concentraciones de clorofila A por unidad de área.
El espectroradiómetro es un instrumento diseñado para medir la radiancia espectral. Las variaciones en la concentración de pigmentos en hojas se pueden medir y diferenciar con espectrómetros portátiles de alta sensibilidad en la región espectral correspondiente al visible e infrarrojo cercano (Song et al., 2021a), especialmente en la región del rojo entre 690 y 740 nm. Shi et al. (2022) estimaron contenidos de clorofila A y B mediante el análisis de redes neurales convolucionales (CNN: “convolutional neural network” por sus siglas en inglés), a partir de la reflectancia de hojas medidas con un espectroradiómetro. Zhao et al. (2022) realizaron un estudio con datos de reflectancia espectral adquiridos de hojas de papa en cuatro etapas fenológicas. Ellos utilizaron tres métodos: 1) la derivada de primer orden, 2) la transformada continua de Wavelet, y 3) un modelo CNN que mostró mejor precisión para la detección de clorofila en papa.
Song et al. (2021a) estimaron el contenido de clorofila en cultivos de maíz mediante la reflectancia espectral utilizando el método de mínimos cuadrados parciales (PLS: “Partial Least Squares”) para optimizar la amplitud del espectro. Luego, aplicando un muestreo competitivo adaptativo ponderado (CARS: “Competitive Adaptative Reweighted Sampling”) y el algoritmo genético (GA: “Genetic Algoritm”) lograron implementar un modelo que estimó el contenido de clorofila.
Este estudio propone utilizar la reflectancia foliar para estimar la concentración de clorofila en el cultivo de tres cultivares de papa (SA-2563, Pumamaqui y Purranca) por ser un indicador de bajo costo con un alto potencial de escalamiento. Para tal fin, se utilizó un espectroradiómetro para implementar un método que permitiera la adquisición de firmas espectrales en hojas de los tres cultivares de papa consiguiendo hallar longitudes de onda sensibles a la concentración de clorofila total. Previamente se implementó un experimento de estrés hídrico por sequía con el propósito de generar una mayor variabilidad en las concentraciones de clorofila de las hojas y así favorecer la validación del método.
Materiales y métodos
Validación de las unidades SPAD del medidor de clorofila SPAD-502
Este experimento se realizó en el interior de un invernadero en las instalaciones del Centro Internacional de la Papa (CIP-Lima), entre los meses de abril y junio, con temperaturas de aire promedio de 18 °C la máxima y 13 °C la mínima. Un tubérculo semilla del cultivar Canchán (CIP Nº380389.1) (CIP, 2022b) se sembró en cada maceta totalizando cinco macetas. Las macetas de plástico de 10” de diámetro (Kord Products Inc, Ontario, Canada) fueron llenadas con 1.2 Kg de PRO-MIX (Premier Tech Horticulture, Canada), un substrato de suelo húmico con una alta capacidad de retención de agua (capacidad de campo de 30% en contenido volumétrico). La fertilización en la siembra se realizó en cada maceta, que recibió 7 g de una mezcla de fertilizantes granulados, compuesta de Urea (46% N), (NH4)3PO4 (18% N y 46% P2O5) y KCl (60% K2O) con una proporción de 0.5:2:1, respectivamente. Luego, semanalmente y por las cinco primeras semanas, se realizó el riego con 500 ml de una solución (1 g·l−1) de fertilizante soluble (Peter fertilizer, Everris International B.V., Geldermalsen, The Netherlands) con 15% de N, 2% de P2O5 y 20% de K2O. Los riegos regulares se realizaron cada 48 horas a las 16:00 horas del día, con cantidades de 400 ml las dos primeras semanas, 800 ml la tercera y cuarta semana, y 1 200 ml en las subsiguientes semanas. Cada maceta tenía un plato que recogía el agua excedente, el cual era reabsorbido el día siguiente.
A las 8 semanas después de la siembra se muestrearon foliolos que presentaban desde clorosis ligera (tercio inferior) hasta un color verde intenso (tercio superior). Con la finalidad de validar las unidades relativas SPAD que arroja el instrumento SPAD-502 se usó la técnica empleada por Zheng et al. (2018). Para ello, se agruparon foliolos en intervalos de lectura de unidades SPAD que abarcaron de: 1) 25 a 29, 2) 30 a 34, 3) 35 a 39, y 4) 40 a 45. Se realizaron 3 lecturas por foliolo, de un foliolo cercano al foliolo impar como lo recomiendan Ramírez et al. (2014). Se obtuvo el promedio de 3 lecturas por intervalo de unidades SPAD, de acuerdo al procedimiento del fabricante (Minolta, 1989). Con la ayuda de un sacabocado, los foliolos fueron cortados en fragmentos de 1 cm2 aproximadamente, teniendo en cuenta conservar una relación área y peso aproximadamente constante entre los fragmentos correspondientes a cada intervalo de unidades SPAD.
Finalmente, las muestras fueron conducidas al laboratorio para determinar su contenido de clorofila por extracción en acetona al 80%, de acuerdo con Lichtenthaler & Buschmann (2001).
Los foliolos, agrupados en intervalos de valores SPAD, permitieron abarcar todas las tonalidades del verde y se guardaron en N líquido. La cuantificación de clorofila A y clorofila B se realizó mediante el método de Arnon, publicado por Bruinsma (1963), para la cual se mezcló 0.5 g de foliolos sin nervaduras con 10 ml de acetona fría al 80%. En seguida, se centrifugó y filtró. Una alícuota de 1 ml del sobrenadante se completó con 4 ml de acetona fría. La dilución fue transferida a una cubeta del espectrofotómetro y leída a absorbancias de 645 y 663 nm de longitud de onda. La cuantificación de clorofila A y B se realizó remplazando las lecturas del espectrofotómetro en las Fórmulas 1 y 2, respectivamente (Lichtenthaler & Buschmann, 2001).
Donde:
A663 y A645 corresponden a las absorbancias del extracto de clorofila en las longitudes de onda de 663 y 645 nm, respectivamente.
Para comparar los gramos de clorofila por unidad de masa de hoja, que brinda la técnica de extracción (Lichtenthaler & Buschmann, 2001), con los gramos de clorofila por unidad de área del SPAD-502, se estableció una relación área/peso aproximadamente constante considerando el mismo número de discos por cada intervalo de valores SPAD.
Estimación de concentraciones relativas de clorofila A y B utilizando la reflectancia del tejido vegetal
Para esta prueba, la colecta de datos se llevó a cabo en un cobertor de malla antiáfida en las instalaciones del Centro Internacional de la Papa (CIP - Lima). Utilizando macetas, se sembraron tubérculos semilla de tres cultivares de papas nativas. Los cultivares evaluados fueron los siguientes: SA-2563 (CIP Nº700234), Pumamaqui (CIP Nº704380) y Purranca (CIP Nº705009) (CIP, 2022a). El tipo de maceta, el substrato, la fertilización y el manejo fue similar a lo descrito anteriormente. Un total de cinco macetas por cultivar, las cuales fueron regadas cada 48 horas las primeras cinco semanas; el mismo procedimiento descrito en la sección anterior. Luego, las plantas fueron sometidas a un tratamiento de estrés hídrico dejándose de regar durante cuatro semanas con el propósito de obtener diferencias en el contenido de clorofila, similar a Van der Mescht et al. (1999). Al final de cada semana se realizaron evaluaciones de reflectancia.
Un espectroradiómetro portátil LI-1800 (LI-COR Inc., Lincoln, NE, USA) y una esfera integradora modelo LI-1800-12S (LI-COR Inc., Lincoln, NE, USA) (LI-COR, 1989, 1990) fueron utilizados para adquirir semanalmente datos de reflectancia en condiciones controladas de los foliolos de los 3 cultivares de papa, con 2 lecturas de reflectancia por cada foliolo. Específicamente, los 2 foliolos correspondían a los pares cercanos al foliolo impar de una tercera hoja completamente expandida. La cámara interior de la esfera integradora estuvo recubierta con una superficie altamente reflectante en la región visible e infrarrojo cercano (NIR: “Near Infrared” por sus siglas en ingles). Esto permitió que la luz que ingresó a su interior se refleje sin pérdidas. Dicha esfera posee 3 puertos y en uno de ellos se atrapa al foliolo que es irradiado con una lámpara de halógeno - tungsteno de intensidad constante. Finalmente, la luz reflejada por el foliolo se dispersa al interior de la esfera integradora y luego es recogida por una fibra óptica y transportada al sensor de luz del espectroradiómetro. El procedimiento seguido es similar al descrito por Castro-Esau et al. (2006) y Ding et al. (2009).
Análisis de los espectros de reflectancia
Utilizando la esfera integradora obtuvimos espectros de reflectancia de foliolos por longitud de onda (Rλ) en condiciones ideales para los 3 cultivares de papas nativas sometidas en este estudio. Mientras, el SPAD-502 proporcionó las concentraciones relativas de clorofila total medidos en los mismos foliolos que fueron usados para obtener las señales de reflectancia. Utilizando esta información, se calculó la correlación entre la primera derivada central de la reflectancia por longitud de onda (PDRλ) y las concentraciones relativas de clorofila proporcionadas por el SPAD-502, similar al procedimiento ensayado por Rao et al. (2008).
Las PDRλ se calcularon según la Fórmula 3.
Donde:
Rλ+1 y Rλ-1: Reflectancia en la longitud de onda λ+1 y λ-1.
Las señales de reflectancia de los foliolos fueron procesadas para resaltar atributos que acentúen su relación con las concentraciones de clorofila. Se aplicó la primera derivada en el dominio de las longitudes de onda y las señales resultantes fueron alisadas utilizando una función B-Spline de tercer grado, de acuerdo con los procedimientos descritos por Lee (1982) y Agoston (2005). La función B-Spline cúbica está compuesta de polinomios cúbicos fragmentarios determinados por una serie de puntos de control (si, pi), i = 1,2,…,n; que no se ajustan a los puntos tabulados con exactitud pero que tienen el objetivo de generar curvas continuas.
Correlogramas se graficaron a partir de las señales correspondientes a la primera derivada de la reflectancia y los valores SPAD adquiridos de foliolos para cada uno de los cultivares de papa (ítem anterior). Un procedimiento similar fue presentado por Rao et al. (2008). La auto correlación cruzada permitió determinar las longitudes de onda correspondientes a la primera derivada de la reflectancia de foliolos con la más alta correlación respecto a los valores SPAD.
Se utilizó el coeficiente de determinación (R2) para evaluar el ajuste entre las medidas SPAD y las amplitudes de la primera derivada de la reflectancia foliar.
Resultados
Validación de las unidades SPAD para estimar contenido de clorofila A, B y total en hojas de papa del cultivar Canchán
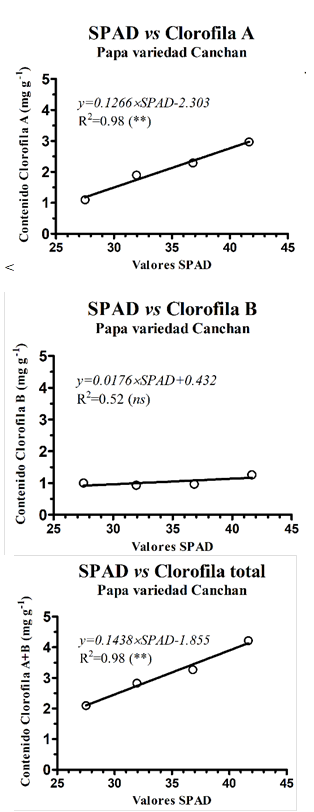
El contenido de clorofila total medidos en foliolos del cultivar Canchán presentaron una correlación lineal significativa R2 = 0.98 y Pvalue = 0.0095 con las evaluaciones SPAD realizadas con el SPAD-502 en grupos clasificados en diferentes tonalidades de verde. Estos resultados representan una gran ventaja, ya que permitiría sustituir métodos tradicionales de cuantificación de clorofila en laboratorio por lecturas rápidas y no destructivas representadas en unidades SPAD. Los resultados de la cuantificación de clorofila A, B, y total, realizadas en laboratorio en intervalos de valores SPAD, se muestran en la Tabla 1.
Tabla 1 Valores SPAD promedio y concentraciones de clorofila A, B y total, respectivamente, en diferentes intervalos de valores SPAD.
| Intervalo de valores SPAD | Valor SPAD (promedio) | Clorofila A (mg·g-1) | Clorofila B (mg·g-1) | Clorofila total (mg·g-1) |
| 25 a 29 | 26.45 | 1.100 | 0.998 | 2.098 |
| 30 a 34 | 31.95 | 1.897 | 0.929 | 2.826 |
| 35 a 39 | 36.81 | 2.294 | 0.973 | 3.266 |
| 40 a 45 | 41.66 | 2.969 | 1.256 | 4.225 |
Las regresiones lineales entre las concentraciones de clorofila A, B, y total versus las unidades SPAD se muestran en la Figura 1.
Clorofila A (mg·g-1) = 0.1266 x SPAD - 2.303 R2 = 0.98 (**)
Clorofila B (mg·g-1) = 0.0176 x SPAD + 0.4316 R2 = 0.52 (ns)
Clorofila total (mg·g-1) = 0.1438 x SPAD - 1.855 R2 = 0.98 (**)
Análisis de los espectros de reflectancia
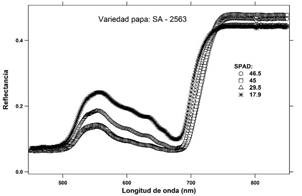
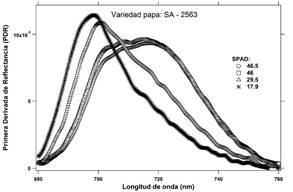
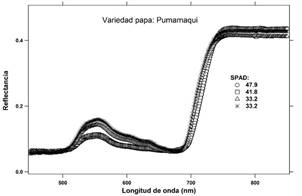
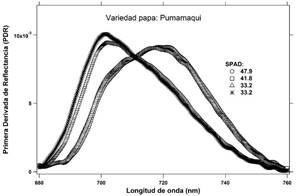
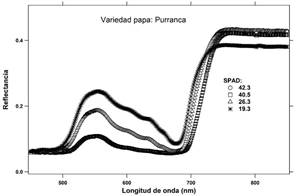
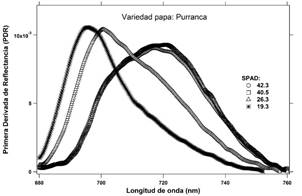
Los espectros de reflectancia correspondiente a los foliolos de los tres cultivares de papa se muestran en las Figuras 2, 4 y 6. Estas señales fueron derivadas con respecto a las longitudes de onda y alisadas mediante una función B-Spline de tercer grado (Lee, 1982; Agoston, 2005), Figuras: 3, 5 y 7.
Para el cultivar de papa SA-2563 se obtuvieron cuatro señales de reflectancia visualmente diferenciadas (Figura 2) y correspondientes a las 4 fechas de evaluación. De manera simultánea se registró para cada fecha un promedio de lecturas de clorofila SPAD que disminuyó de 46.5 a 17.9 unidades SPAD, obteniéndose una amplitud de 28.6 (Figura 2). Para fines de validar el método, resulta ideal contar con un amplio rango de valores SPAD y simultáneamente diferentes espectros de reflectancia. Asimismo, para fines prácticos, se graficó la primera derivada de los espectros de reflectancia por longitud de onda desde 680 nm hasta 760 nm, debido a que dentro de dicho rango se presenta un pico máximo relativo para cada señal de reflectancia procesada (Figura 3).
Con el cultivar de papa Pumamaqui, las cuatro señales de reflectancia formaron dos grupos con una escaza diferencia entre ellos (Figura 4). Por otro lado, las lecturas SPAD presentaron un valor máximo de 47.9 y un mínimo de 33.2 unidades SPAD, un rango de 14.7, que representa casi la mitad de amplitud presentada por el cultivar SA-2563. Esta característica es importante tenerla en cuenta para la validación del método. La gráfica, correspondiente a la primera derivada de los espectros de reflectancia, muestra el mismo patrón de agrupamientos que los espectros de reflectancia, con dos picos que se aprecian en la Figura 5.
El cultivar de papa Purranca presenta tres señales de reflectancia visualmente diferenciados (Figura 6). Con respecto al promedio de lecturas de clorofila SPAD, los valores disminuyen de 42.3 a 19.3 con una amplitud de 23.0 unidades SPAD. En lo que respecta al gráfico de la primera derivada de los espectros de reflectancia, se presentan hasta tres picos centrados en diferentes longitudes de onda, como se observa en la Figura 7.
Las Figuras 8, 9 y 10 se obtuvieron al comparar las amplitudes por longitud de onda de la PDRλ con los valores relativos de clorofila SPAD obtenidos de los foliolos para cada uno de los 3 cultivares de papa, respectivamente. Se encontró que la primera derivada de la reflectancia de los foliolos de papa presentó una alta sensibilidad en la región espectral correspondiente al rojo y al verde. Estos resultados se resumen en la Tabla 2. Sin embargo, para cada uno de los cultivares de papa se encontró una ligera variación en la longitud de onda central correspondiente a los picos de mayor amplitud en los coeficientes de determinación. Así, los picos de mayor amplitud corresponden a longitudes de onda centradas en: 716 nm (Purranca), 722 nm (Pumamaqui) y 724 nm (SA-2563). En tanto, los segundos picos de mayor amplitud corresponden a longitudes de onda central aproximadamente en: 561 nm (Purranca), 562 nm (Pumamaqui) y 563 nm (SA-2563). Resultados similares, con dos picos máximos de coeficientes de determinación, fueron presentados en cultivos de arroz y algodón (Rao et al., 2008), en manzana, almendra y álamo (Ding et al., 2009).
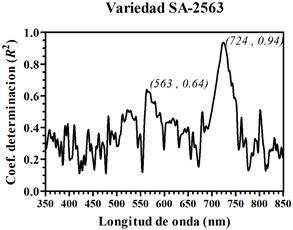
Figura 8 Coeficiente de determinación (R2) entre los valores relativos de clorofila SPAD y la primera derivada de los espectros de reflectancia de foliolos de papa (PDRλ), cultivar SA-2563.
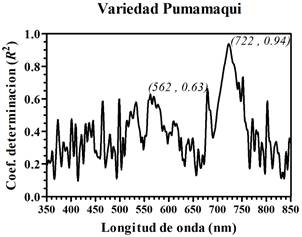
Figura 9 Coeficiente de determinación (R2) entre los valores relativos de clorofila SPAD y la primera derivada de los espectros de reflectancia de foliolos de papa (PDRλ), cultivar Pumamaqui.
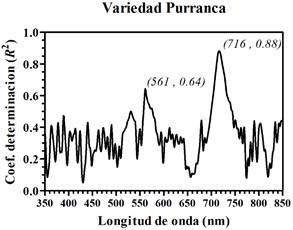
Figura 10 Coeficiente de determinación (R2) entre los valores relativos de clorofila SPAD y la primera derivada de los espectros de reflectancia de foliolos de papa (PDRλ), cultivar Purranca.
Tabla 2 Longitudes de onda que presentaron los más altos coeficientes de determinación para estimar concentraciones de clorofila utilizando la primera derivada del espectro de reflectancia de hojas de papa.
| Cultivar | 1er máximo | 2do máximo | ||
| Longitud de onda (nm) | Coef. De determinación (R2) | Longitud de onda (nm) | Coef. de determinación (R2) | |
| SA-2563 | 724 | 93.68% | 563 | 63.97% |
| Pumamaqui | 722 | 93.77% | 562 | 62.88% |
| Purranca | 716 | 88.31% | 561 | 64.40% |
Discusión
Nuestros resultados confirmaron que el SPAD-502 es un instrumento útil para estimar concentraciones de clorofila total. Este instrumento se validó con datos adquiridos de foliolos de papa del cultivar Canchán, obteniéndose un coeficiente de determinación de 0.98. Resultados similares fueron obtenidos con otras especies como: trigo y papa por Uddling et al. (2007), papa por Bindi et al. (2002) y frijol caupí por Murillo-Amador et al. (2004).
Las altas correlaciones encontradas entre las amplitudes de la primera derivada de los datos de reflectancia evaluadas en determinadas longitudes de onda en la región del eje rojo y las concentraciones relativas de clorofila SPAD para los cultivares de papa SA-2563, Pumamaqui y Purranca, corroboran los trabajos realizados con Ginkgo biloba para λ = 727.5 nm (R2 = 0.85) y Zelkova serrata para λ = 732.5 nm (R2 = 0.78) reportados por Endo et al. (2001b), así como, también, los estudios realizados con maíz para λ = 710 nm (R2 = 0.78) por Schepers et al. (1996). En álamo, almendro y manzano se obtuvieron una alta sensibilidad en las regiones correspondientes al rojo lejano (700 hasta 730 nm) y al verde (550 hasta 580 nm), presentados por Ding et al. (2009). Sin embargo, en el caso del cultivo de pepino se reportó una alta sensibilidad para λ = 678 nm (R2 = 0.81), según Endo et al. (2001a).
Estos resultados se explican a partir de la interacción que existe entre la epidermis de la hoja y la luz incidente en la región correspondiente al infrarrojo cercano desde 700 nm a 740 nm (Ding et al. 2009; Kira et al., 2015; Li et al. 2017). Los valores SPAD con la más alta correlación con la amplitud de los espectros de reflectancia derivados en el dominio de las longitudes de onda correspondieron al rango entre 716 nm y 724 nm, para los tres cultivares de papa nativa sometidos en este estudio. Resultados similares fueron presentados por Kira et al. (2015) en tres especies forestales, y por Zhao et al. (2019) en cuatro especies de manglares.
El SPAD-502 permitió realizar medidas rápidas del contenido relativo de clorofila a nivel de hoja. Así, trabajos como los realizados por Ramírez et al. (2014) y Rolando et al. (2015) relacionaron los contenidos de clorofila como indicadores del rendimiento de tubérculo en condiciones de restricción hídrica, e indicadores de tolerancia al estrés hídrico, respectivamente. Sin embargo, si el objetivo es evaluar extensas zonas de cultivos, sería necesario un gran número de personas e instrumentos incrementando los costos y el tiempo de ejecución. En ese sentido, métodos basados en la reflectancia del tejido vegetal y el procesamiento de señales presentado en este estudio permitirían evaluar el contenido de clorofila de forma rápida, eficiente y no intrusiva. Mejor aún, si utilizamos cámaras con filtros ópticos en las longitudes de ondas de nuestro interés (Rao et al., 2008; Roosjen et al., 2018).
Un método que utilice la información reflejada por la planta en lugar de la absorbancia del tejido foliar, como es el caso del SPAD-502, incrementaría la capacidad de escalamiento de las evaluaciones; más aún, si consideramos el potencial de las cámaras agrícolas multiespectrales, como es el caso de la RedEdge-P (MicaSense Inc., Seattle, WA, USA) o hiperespectrales como el Hyperspec UV-VIS (Headwall Photonics Inc., Bolton, MA, USA), para la adquisición de imágenes de reflectancia de la vegetación desde plataformas aéreas no tripuladas. Estas sinergias resultan potentes herramientas de decisión para los agricultores, permitiendo, por ejemplo, generar mapas de deficiencias o excesos en el uso de fertilizantes en los cultivos.
Conclusiones
El presente trabajo de investigación presenta un método que analiza y procesa señales de reflectancia a nivel de hoja con el propósito de estimar concentraciones relativas de clorofila en foliolos de plantas de papa de forma rápida y no intrusiva. El método aplicado presenta estimaciones de clorofila total con coeficientes de determinación mayores al 88% utilizando valores SPAD como referencia. Nuestros resultados reafirman el potencial y la flexibilidad de las técnicas basadas en reflectancia para estimar rasgos de los cultivos en el marco de la agricultura de precisión.












 uBio
uBio