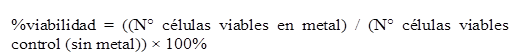Introducción
En la cabecera de cuenca del río Mantaro existe una intensa actividad minera con alta explotación polimetálica de cobre, plata, plomo y zinc. Sin embargo, los desechos generados (relaves) por estas actividades impactan los ambientes naturales; gran parte de los relaves son derivados a lagunas y afluentes del lago Junín. Por ejemplo, el río San Juan, ubicado a 4 200 msnm, recibe efluentes mineros procedentes de la Compañía Minera Volcán S.A.A., la Compañía Minera Aurex y de la Sociedad Minera El Broncal, a través de la quebrada Quiulacocha (Wade et al., 2006).
La evaluación realizada por el Ministerio de Salud (MINSA) en marzo del 2010, determinó que el río San Juan, presentaba contaminación por metales pesados: arsénico, cadmio, cobre, plomo, mercurio, zinc y drenaje ácido de minas (MINSA, 2011). El estudio realizado por Cusiche & Miranda (2019) manifiesta que la calidad del agua del río San Juan, fue impactado por los efluentes de las operaciones mineras de la Compañía Minera Aurex, que deterioraron la biodiversidad del sistema acuático y las poblaciones de aves migratorias y residentes, como el zambullidor de Junín (Podiceps taczanowskii); ave endémica, considerada una especie amenazada. El tamaño de las poblaciones de estas aves disminuyó, debido a la contaminación por efluentes mineros a partir de 1983, presentando un ligero aumento de 250 a 450 individuos entre los años 2010 y 2016 (Dinesen et al., 2018). Otras especies amenazadas son los anfibios, como la rana de Junín (Batrachophrynus microphtalmus), especie endémica cuya población ha descendido drásticamente, por intoxicación con metales pesados, como arsénico, cadmio, hierro, mercurio y plomo (Castillo, 2008; Loza & Mendoza, 2017).
El Lago Junín (Chinchaycocha), situado a 4 080 msnm, abarca la mayor parte de la superficie de la Reserva Nacional de Junín (RNJ), y es el segundo lago más extenso del Perú (MINAM, 2012). Sus aguas son abastecidas por 12 ríos y 20 arroyos que dan origen al río Mantaro, el cual es uno de los principales tributarios de la cuenca del río Amazonas (ANA, 2010). El principal problema de este lago se debe al impacto de la minería; donde a partir del año 1913, la compañía minera Cerro de Pasco Cooper Corporation vertieron sus relaves mineros al río San Juan, afluente del Lago Junín (Vega-Centeno, 2011).
Otra de las lagunas afectadas por la actividad minera es Yanamate, hoy convertida en una relavera, se encuentra a 4 358 msnm y cuenta con un volumen de agua aproximado de 21.26 millones de m3, presenta pH muy ácido, alta conductividad eléctrica y concentraciones elevadas de metales pesados y sulfatos (Aduvire, 2018). Esta laguna ha sido utilizada desde 1981 hasta el 2005 para el vertimiento de aguas ácidas provenientes de la Mina de Cerro de Pasco Cooper Corporation y la compañía minera Volcán S.A.A. (hoy Cerro S.A.C.). Más aún, las empresas han incumplido el “Plan de Cierre de Mina Progresivo” que fue aprobado el 2009 (MINEM, 2009). Hasta el año 2012, no se neutralizaron las aguas ácidas con material calcáreo, como carbonato de calcio (Dold et al., 2009), luego se postergó para el periodo 2014 al 2017. En los últimos monitoreos realizados durante la presente investigación, en los años 2015 al 2018, se determinó que las aguas de esta relavera siguen impactadas, encontrando aguas ácidas de 1.5 a 3 de pH y altas concentraciones de metales pesados.
Para la biorremediación de metales pesados existen varias alternativas biológicas, como el uso de biomasa de hongos filamentosos y levaduras, por su capacidad de bioacumular metales pesados y conservar esta capacidad en condiciones extremas (Bahafid et al., 2017). Estudios realizados con diferentes microorganismos Debaryomyces hansenii, Zygosaccharomyces baili y S. cerevisiae, demostraron que las levaduras son agentes biosorbentes para la captura y eliminación de iones metálicos de aguas residuales. Estos microorganismos, son una alternativa para descontaminar procesos de biomagnificación y/o acumulación de metales en la cadena trófica, que afectan negativamente el entorno biológico (Bahafid et al., 2017).
Las levaduras presentan capacidades intrínsecas asociadas a la biosorción de metales pesados (Hosiner et al., 2014). Uno de los mecanismos para atrapar metales pesados es mediado por la quelación, puede ocurrir en las superficies celulares a través sus grupos fosfatos y carboxilo, estos grupos funcionales se unen a cationes metálicos. Otras moléculas que participan en la quelación y transporte de iones metálicos a nivel del citosol son los tripéptidos glutatión, fitoquelatinas y metalotioneínas (Bahafid et al., 2017; Hosiner et al., 2014). En general, la inmovilización y la movilización son dos de los principales mecanismos, utilizados por las levaduras para la biorremediación de metales.
Las levaduras además de quelar metales, promueven el crecimiento vegetal, tienen potencial aplicación en la agricultura orgánica, mejoran la producción y sostenibilidad ambiental (Higa & Parr, 2013). Se demostró que las levaduras pertenecientes al género Candida, Saccharomyces y Yarrowia, favorecen directa o indirectamente el crecimiento de las raíces de las plantas (Dudeja et al., 2011; Fu et al., 2016; Gizaw et al., 2017). Esto microorganismos aislados de ambientes extremos, también poseen el potencial, como promotores de crecimiento vegetal, en agricultura sostenible y regenerativa (Botha, 2011).
Debido a la importancia y potencial biotecnológico de las levaduras en la biorremediación de suelos y aguas contaminadas con metales pesados, se aislaron cepas nativas de cuerpos de aguas altoandinas, contaminadas con relaves mineros. En este contexto, los objetivos del presente estudio fueron evaluar parámetros fisicoquímicos en el Lago Junín y la relavera Yanamate. Así mismo, determinar, en las cepas, la Concentración Mínima Inhibitoria (CMI) de diversos metales, cinéticas de crecimiento, la CL50 y la capacidad de biosorción de iones Cr+6 y Cu+2.
Materiales y métodos
Localización de las estaciones
Las estaciones de muestreo corresponden a cuerpos de agua de la sierra central del Perú (Junín y Pasco) cuyas aguas han sido afectadas por el vertimiento de relaves mineros, por procesos de filtración o por escorrentía, que transportan el material tóxico de las relaveras hacia los cuerpos de agua estudiados. Las estaciones de muestreo del Lago Junín y la relavera Yanamate fueron georreferenciadas (Tablas 1 y 2) en coordenadas UTM WGS84, mediante el GPS (GARMIN eTrex® 30) en los meses de junio y noviembre del 2015.
Parámetros fisicoquímicos
En cada estación de muestreo, se midieron in situ: pH, temperatura en °C, conductividad eléctrica (CE) en µS/cm y sólidos totales disueltos (STD) en ppt, de acuerdo con el Protocolo de Monitoreo de la Calidad de los Recursos Hídricos del ANA (2011), tomando muestras a una profundidad aproximada de 40 cm en la columna de agua, usando un equipo multiparámetro calibrado EXTECH-DO700.
Análisis de metales
Para el análisis de metales pesados, se colectaron las muestras de agua durante la época de estiaje y de lluvia (junio y noviembre, respectivamente), según el Protocolo de Monitoreo de la Calidad de los Recursos Hídricos del ANA (2011). Para ello, se colectó 1 litro de muestra en envases limpios de primer uso, adicionando 20 gotas de ácido nítrico al 10%, siguiendo la metodología descrita por Skousen et al. (1998). Se determinó la concentración de los metales por Espectroscopia de Emisión por Plasma-Método basado en EPA 200.7 - Rev.4.4-1994 (EPA, 1994), en el Instituto de Corrosión y Protección de la Universidad Católica del Perú.
Aislamiento de levaduras
Para el aislamiento de levaduras del Lago Junín y relavera Yanamate, se recolectaron muestras líquidas, previa remoción y/o agitación de la columna de agua, en frascos estériles de 500 ml de cada estación, siguiendo los procedimientos estándar para la evaluación del agua y aguas residuales (APHA et al., 2012). Las muestras colectadas se conservaron en refrigeración hasta su procesamiento, antes de las 24 horas, en el Laboratorio de Microbiología Ambiental y Biotecnología de la FCB-UNMSM en Lima, Perú. Las muestras se sembraron en caldo YPG (“Yeast Extract Peptone Glucose”) a pH 4.0 y se incubaron por dos semanas a 10 °C y 20 °C, a 150 rpm de agitación (Acosta et al., 2005). La purificación de las cepas se llevó a cabo por agotamiento en placa en agar YPG. Se realizó una tinción con cristal violeta y se determinó la morfología de las cepas aisladas. Luego, se criopreservaron a -20 ºC, en viales de 1.5 ml con medio YPG semisólido (0.75% p/v de agar) a pH 4.0 y glicerol al 20%.
Extracción de ADN genómico
Para la extracción de ADN genómico, las levaduras aisladas se cultivaron en caldo YPG por 48 horas, a pH 4.0, 150 rpm y 20 °C. La biomasa obtenida de cada cepa fue lisada, siguiendo el protocolo de Doyle (1991) y para la extracción de ADN se usó el Kit de Purificación Gene JET DNA (NORGEN BIOTECK CORP), según las especificaciones del fabricante.
Amplificación por PCR de la región LSU D1/D2 del gen 26S ARNr y Secuenciamiento
Para amplificar la región D1/D2 del gen de la subunidad ribosomal ARNr 26S de las cepas aisladas se usaron los iniciadores: F63: (5`GCATATCAATAAGCGGAGGAAAAG-3`) y LR3: (5`GGTCCGTGTTTCAAGACGG-3`) según Orbegozo et al. (2008). La PCR se realizó utilizando un equipo Multigene Optimax (LABNET), según el protocolo del mismo autor. Los amplicones se evaluaron mediante electroforesis en gelde agarosa al 2.0% con un marcador de peso molecular de 100 pb, buffer TAE 1x, a 80 voltios por 1.20 horas y se revelaron los geles en bromuro de etidio. Los amplicones de 10 cepas aisladas fueron enviados a Cloning Laboratories (MCLAB)-USA (www.mclab.com) para su secuenciamiento.
Identificación molecular y análisis filogenético
Las secuencias obtenidas se editaron con el programa Bioedit v7.2.5. y se utilizó la herramienta BlastN para comparar las secuencias de la región D1/D2 LSU de la subunidad ribosomal 26S, con otras levaduras identificadas y suscritas en el Genbank (BankIT -NCBI).
El análisis filogenético se realizó usando la herramienta ClustalW del programa BioEdit v.7.0.5. La comparación de las secuencias obtenidas se realizó con el programa BLASTN v.2 de las secuencias depositadas en Ribosomal Data Project - GenBank, luego se procedió al análisis filogenético con el programa MEGA v.7 (Kumar et al., 2016). Para la determinación del mejor modelo evolutivo se realizó el análisis Best DNA Model empleando el método Neighbor - Joining y el Modelo de Sustitución Kimura 2 parámetros.
Determinación de la Concentración Mínima Inhibitoria (CMI) frente a metales pesados
Las cepas resistentes a metales pesados se seleccionaron según la CMI. Para ello, estas fueron cultivadas en caldo YPG, pH 4, 20 °C a una agitación de 150 rpm, y expuestas a diferentes concentraciones (50 - 400 ppm) de iones metálicos (Cr+6, Cd+2, Cu+2, y Hg+2) y se incubaron por dos semanas. Las soluciones de metales se prepararon a partir de dicromato de sodio (Na2Cr2O7), sulfato de cadmio (CdSO4), sulfato de cobre (CuSO4) y cloruro de mercurio (HgCl2).
Ensayo de citotoxicidad: determinación de la Concentración Letal Media (CL50)
La citotoxicidad se evaluó mediante la determinación de la CL50, siguiendo la metodología propuesta por Hosiner et al. (2014). Las cepas seleccionadas se reactivaron y sembraron en caldo YPG a pH 4.0, 150 rpm, por 48 horas hasta alcanzar la fase exponencial. Al término de las 48 horas, se tomaron inóculos de 1 ml de cada cultivo y se inocularon por triplicado en tubos con 9 ml de caldo YPG con diferentes concentraciones de iones metálicos: Cd+2 (0.53 y 0.63 mM), Cu+2 (1.34 y 1.42 mM), Cr+6 (0.144 y 0.240 mM) y Hg+2 (0.04 y 0.05 mM), y se incubaron por 3 horas. Al término del tiempo de exposición, se tomó un volumen de 1 ml y se realizaron diluciones seriadas (10-1 a 10-5), las dos últimas diluciones se sembraron por diseminación en placas con agar YPG por 48 horas. Finalmente, se realizó el recuento en UFC/ml, determinándose la CL50 para cada metal, mediante el porcentaje de viabilidad con respecto al ensayo control. Se determinó el porcentaje de viabilidad según la Fórmula 1.
Cinética de crecimiento frente a metales pesados
Para determinar la cinética de crecimiento de las cepas seleccionadas, se tomó como referencia la CMI y la CL50, en presencia de iones Cr+6 y Cu+2. De un cultivo de 48 h, se tomó un inóculo promedio de 25 x 107 UFC/ml para la cepa AMJ3 y 50 x 107 UFC/ml para la cepa AMJ6, el inóculo correspondió al 10% del volumen total de los cultivos con tratamiento para cada metal. La evaluación de la cinética de crecimiento de la cepa AMJ3, se realizó a una concentración de 80 ppm (1.26 mM) de Cu+2 y 10 ppm (0.192 mM) de Cr+6. Con la cepa AMJ6 se usó similar concentración de 80 ppm (1.26 mM) de Cu+2 y 15 ppm (0.289 mM) de Cr+6. En ambos casos, se utilizó un control sin metal, las cinéticas para cada tratamiento se trabajaron por triplicado. La incubación se llevó a cabo a 20 °C, 150 rpm por 96 horas en caldo YPG a pH 4.0. La evaluación de la población microbiana se realizó mediante la densidad óptica (λ = 600 nm) y se reportó en UFC/ml; las mediciones se realizaron en un intervalo de 4 a 10 horas, usando la metodología ICMSF cap. 2000 (DIGESA, 2003) para el conteo de las colonias.
Biosorción de metales pesados
Para determinar la capacidad de biosorción de metales pesados, se tomaron como referencia los estudios realizados por Cañizares-Villanueva (2000), Rehman et al. (2007) y Rehman et al. (2008). La biosorción se evaluó en base a los resultados de CMI en ambas cepas, las concentraciones de los ensayos de CL50 y de las cinéticas de crecimiento. Para ello, se cultivaron las cepas seleccionadas (AMJ3 y AMJ6) en caldo YPG, y se tomaron volúmenes de la fase de crecimiento exponencial. Las cepas fueron expuestas a caldos YPG con iones Cr+6 a concentraciones de 0.12 mM (12.5 ppm) y 0.48 mM (50 ppm) respectivamente; las concentraciones de iones Cu+2 para ambas cepas fueron las mismas 1.26 mM (80 ppm). Los ensayos de biosorción de los iones metálicos, se realizaron por triplicado en matraces de 1 l con caldo YPG a pH 4.0, en las cuales se incorporó cada metal por separado. Se inoculó el 10% (v/v) de cada cepa cultivada, a una concentración aproximada de 107 UFC/ml, luego se incubaron por 96 h a 20 °C y 150 rpm. Se tomaron muestras de 50 ml del cultivo cada 24 h, los volúmenes tomados se centrifugaron a 4 500 rpm por 20 minutos, los sobrenadantes se utilizaron para medir la concentración del metal, mediante Espectroscopia de Emisión por Plasma-Método basado en EPA 200.7 - Rev.4.4-1994 (EPA, 1994).
Resultados y discusión
Georreferenciación, parámetros fisicoquímicos y metales pesados
La georreferenciación y la evaluación de la calidad fisicoquímica de los cuerpos de agua de las estaciones de muestreo del Lago Junín se muestran en la Tabla 1 y de la relavera Yanamate Tabla 2. Para el análisis se tomó como referencia los ECA del D.S. Nº 004-2017-MINAM-PERÚ (MINAM, 2017).
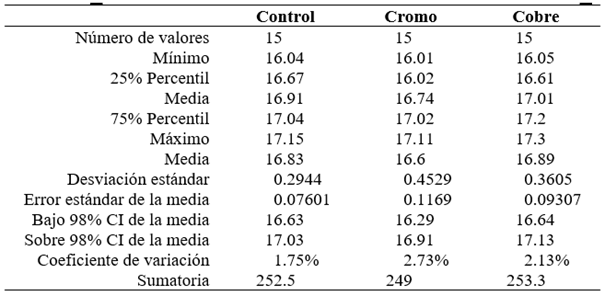
Tabla 1 Georreferenciación de las estaciones de muestreo y promedios de parámetros fisicoquímicos del Lago Junín (junio y noviembre 2015).
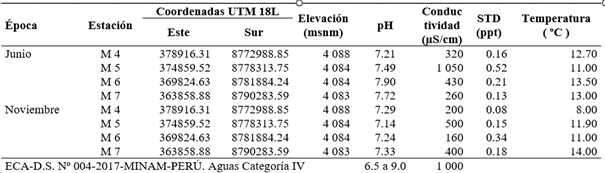
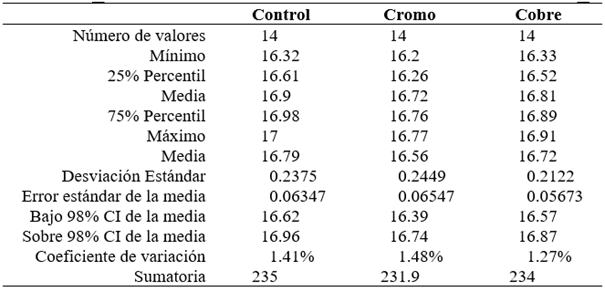
Tabla 2 Georreferenciación de las estaciones de muestreo y promedios de parámetros fisicoquímicos de la relavera Yanamate (junio y noviembre 2015).
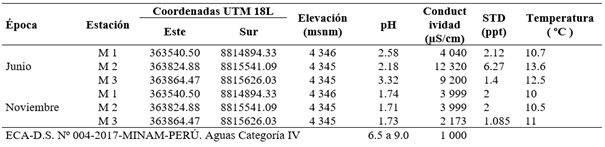
Los resultados de los monitoreos realizados en los meses de junio y noviembre del año 2015 en el Lago Junín fueron similares a los reportados por Bianchini (2009), los resultados obtenidos de conductividad para el tributario principal (río San Juan) del Lago Junín, fue de 320 µS/cm. En el presente estudio, encontramos en 7 de las 8 estaciones muestreadas, valores entre los 200 y 500 µS/cm, solo la estación M5 presentó conductividad 1 050 µS/cm, ligeramente por encima del ECA del MINAM (Tabla 1). Por otro lado, Bianchini (2009) reporta una temperatura media de 12.75 °C y pH de 9.4, mientras que, en la presente investigación, las temperaturas en las estaciones muestreadas estuvieron en el rango de 8 °C a 14 °C y los valores promedio del pH fueron cercanos a 7.52.
Tabla 3 Concentración de metales pesados en la relavera Yanamate y en el Lago Junín.
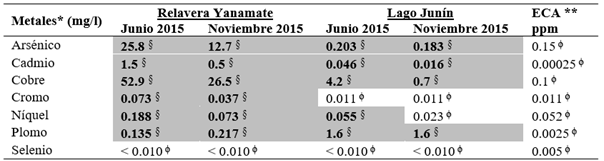
*Método: Inductively Coupled Plasma Mass Spectometry (ICP-MS) o Espectrofotometría de masas con plasma acoplado inductivamente - Instituto de Corrosión de la Pontificia Universidad Católica del Perú.
** (Decreto Supremo Nº 004-2017-MINAM). Categoría de agua IV.
§ Parámetros dentro de los Estándares de Calidad Ambiental (ECA)-Decreto Supremo Nº 004-2017-MINAM.
ϕ Concentraciones de metales que superan los ECA Nacionales por ICP-MS.
En la estación M7 se encuentra la desembocadura del río San Juan en el Lago Junín, en esta estación se determinó el pH de 7.72 en junio del 2015 y 7.33 en noviembre 2015. Cusiche & Miranda (2019), reportaron 2 puntos de muestreo para el río San Juan (100 m aguas arriba del afluente de las operaciones de CIA Minera Aurex S.A.) con una temperatura promedio de 10 °C, pH 8.28; y 100 m aguas abajo a una temperatura de 12.4 °C con un pH de 7.55. Las estaciones de muestreo del Lago Junín presentaron niveles de pH cercanos al neutro, probablemente porque los efluentes reciben tratamiento alcalino o neutralizante, mientras que algunos resultados de las mediciones de metales pesados para el Lago Junín estuvieron ligeramente por encima del ECA establecido para aguas continentales de clase IV, como se reportan en la Tabla 3. Los resultados de los parámetros fisicoquímicos, a excepción de la estación M5, en el Lago Junín estuvieron dentro de los ECA del MINAM.
En el caso de la relavera Yanamate, se registraron temperaturas entre 10.60 °C y 12.27 °C, pH de 1.30 a 3.32 (ácido), conductividades eléctricas altas, de 5 200 a 12 320 µS/cm, todos los parámetros fisicoquímicos y las concentraciones de metales pesados se encontraron por encima del ECA del MINAM (Tablas 2 y 3). Este cuerpo de agua ubicada en la región Pasco, fue contaminada por décadas por relaves mineros, causando impactos negativos, hasta convertirla en la actualidad, en una relavera, con pH muy ácido y altas concentraciones de metales pesados, según lo reportado por Aduvire (2018) y en la presente investigación. Esta laguna fue utilizada hasta el 2005 para el vertimiento de aguas ácidas provenientes de la Mina de Cerro de Pasco Cooper Corporation y la compañía minera Volcán S.A.A., actualmente, es una relavera altamente contaminada (Dold et al., 2009).
Aislamiento y selección de levaduras resistentes a metales pesados
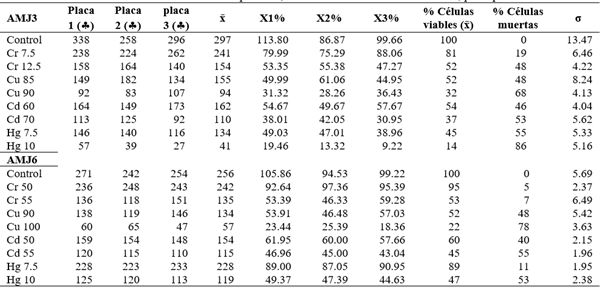
A partir del muestreo, se aislaron 10 cepas de levaduras que crecieron a diferentes concentraciones de metales pesados (50 a 400 ppm) (Tabla 4). Las cepas seleccionadas para este estudio fueron AMJ3 y AMJ6, las cuales presentaron mayor CMI frente al ion Cu+2 y a los otros, tres iones metálicos (Cr+6, Cd+2 y Hg+2) (Tabla 4). Ambas cepas AMJ3 y AMJ6 crecieron en presencia del ion Cu+2 hasta 250 ppm y 400 ppm, respectivamente; la CMI frente a los iones Cr+6 y Hg+2, fue de 50 ppm, para ambas cepas; con el ion Cd+2 la cepa AMJ3 creció hasta 100 ppm y la cepa AMJ6 hasta 150 ppm. Se sabe que algunos metales son oligoelementos para los organismos, importantes para el funcionamiento de algunas proteínas, como cofactores. Sin embargo, el exceso del metal, aun siendo esencial, en altas concentraciones, son tóxicos, tanto para los organismos eucariotas como procariotas (Hodson, 2004). Autores como Fu et al. (2010); Wang & Chen, (2006), realizaron estudios de resistencia con Cryptococcus neoformans frente a siete metales pesados (Pb, Zn, Co, Hg, Cr, Cd, y As), encontrándose que esta levadura era más resistente a Pb (2000 ppm) y Zn (1000 ppm), pero con mayor sensibilidad a As, Cd, Cr y Hg (100, 150, 250 y 50 ppm). Las levaduras seleccionadas (AMJ3 y AMJ6), presentaron CMI similares para los iones Cd+2 y Hg+2. Los resultados obtenidos de resistencia a metales pesados, mediante ensayos de CMI, fueron referenciales para determinar la CL50 y la biosorción de los iones Cu+2 y Cr+6.
Tabla 4 Concentración Mínima Inhibitoria (CMI) de levaduras en caldo YPG a diferentes concentraciones de metales pesados, sembradas a 20 °C, 150 rpm, pH 4 por 14 días. Aisladas de las regiones altoandinas de Junín y Pasco. Las cepas seleccionadas se encuentran sombreadas.
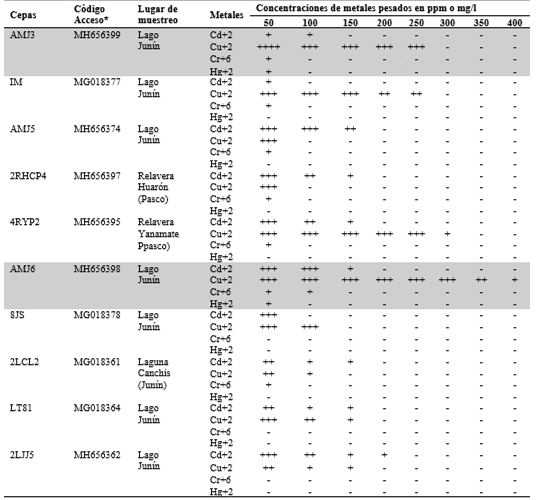
-: Ausencia de turbidez. +: Presencia de turbidez. ++: Regular turbidez. +++: Buena turbidez. +++: Excelente turbidez. La turbidez se midió a una densidad óptica (λ = 600 nm).
* Código de acceso de levaduras identificadas subidas a la base de datos "National Center for Biotechnology Information" (NCBI).
Identificación Molecular y Filogenia
El análisis filogenético realizado con las 10 cepas aisladas fue inferido a partir de 450 bases nucleotídicas, aplicando el método de Kimura 2 parámetros, con 1 000 réplicas (bootstraps) (Figura 1). Todas las cepas analizadas formaron un mismo clado con la levadura Y. lipolytica. Las secuencias de las cepas AMJ3 y AMJ6 identificadas se depositaron al NCBI del GenBank, con código acceso MH656399 y MH656398, respectivamente. En la Tabla 4, se muestran la procedencia de las 10 cepas, la CMI, así mismo su identificación, según el código de acceso (BankIT) en el "National Center for Biotechnology Information" (NCBI).
Actualmente, la levadura Y. lipolytica es considerada como un modelo expresión y producción de lípidos y proteínas (Ito et al., 2007; Nicaud, 2012; Michely et al., 2013). También se menciona Y. lipolytica, como un microorganismo generalmente seguro, presenta versatilidad para degradar diferentes sustratos, tasas de crecimiento rápidos, diversidad y flexibilidad metabólicas, capacidades únicas para tolerar ambientes extremos (ácidos, alcalinos, hipersalinos, contaminación por metales pesados y otros) y su capacidad secretora de metabolitos. (Mamaev et al., 2021).
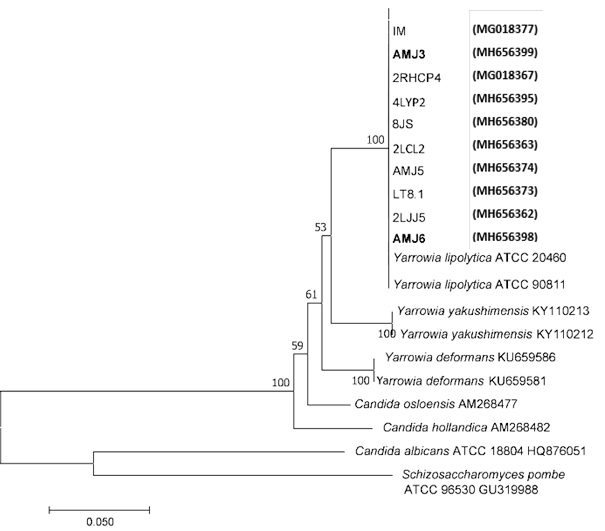
Figura 1 Árbol filogenético de 10 cepas construido por el método Neighbor Joining utilizando la región D1/D2 LSU de los aislados de levaduras resistentes a metales pesados. Se utilizó el modelo Kimura 2 parámetros y Bootstrap de 1 000 repeticiones. Las cepas AMJ3 y AMJ6 identificadas se emplearon en los diversos ensayos, del presente estudio, las cepas están con su código de acceso al GenBamk.
Cinéticas de crecimiento de las cepas AMJ3 y AMJ6 (Y. lipolytica) en presencia de metales pesados.
Para evaluar la cinética de crecimiento se utilizaron los inóculos de la fase exponencial de cada uno de los cultivos. Los ensayos con la cepa Y. lipolytica AMJ3 exhibió una cinética de crecimiento con pendientes similares, para el control y con iones Cu +2. Las fases de la cinética fueron continuas tanto en la fase de adaptación y exponencial, aproximadamente hasta las 60 h; sin embargo, se visualizó que la pendiente de AMJ3 con iones Cu+2 sobrepasó al control; después de las 40 h, en la fase estacionaria presentaron un pequeño incremento hasta las 96 h. La cinética de la cepa AMJ3 cultivada con iones Cr+6, fue muy diferente, presentó una fase Lag hasta las 25 h, con pendiente cercana a cero, posteriormente se dio la fase exponencial, hasta aproximadamente las 60 h, con un ligero incremento en la fase estacionaria hasta las 96 horas (Figura 2A). Las fases exponencial y estacionaria con la cepa AMJ3, no estuvieron bien definidas. Los resultados de las réplicas de la cinética realizada, y su correspondiente análisis estadístico, se encuentran en las Tablas 5.1_2 y 5.2_2. Los iones Cr+6 son más tóxico que los iones Cu+2, no obstante que la concentración de este último, fue ocho veces mayor que la del ion cromo. Estos resultados demuestran la baja toxicidad del cobre para ambas cepas, y sugieren que este metal, estimula el crecimiento en estas condiciones o se presentaría como un cofactor de síntesis de proteínas (Chen et al., 2021). Se debe tener en consideración que el ion cobre es necesario para que los diversos complejos citocromo oxidasas se mantengan activos, esto permitiría que las levaduras tengan la capacidad de crecer en diversos medios de cultivo con fuentes de carbono no fermentables (Gross et al., 2000). Por otro lado, Arinbasarova et al. (2015) mencionan que el cobre es un elemento vital que puede llegar a extender la viabilidad de las levaduras.
Tabla 5.1_2. Cinéticas de crecimiento de las cepas AMJ3 en caldo YPG pH: 4. UFC/ml. 150 RPM, inoculo10% (v/v). (Análisis en Tabla 5.2_2).
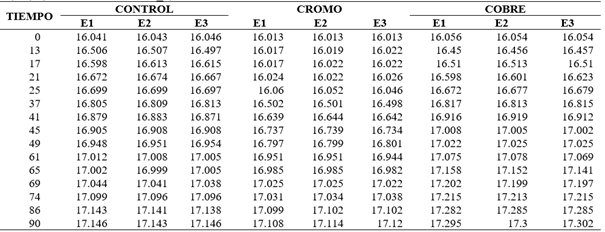
Los valores expresados se encuentran en base logaritmo neperiano (Ln) de las UFC/ml.
Según se observa en la Figura 2B, la cepa Y. lipolytica AMJ6 sin metal (control), no presentó una fase de adaptación, pero con pendiente fue menor, en la fase exponencial, en relación con la cepa AMJ3, la fase Log fue constante desde el inicio hasta las 30 h aproximadamente. Posteriormente, se incrementó hasta las 50 h, luego la fase estacionaria se mantuvo constante, hasta las 96 h. La cinética de la AMJ6 con los iones Cu+2, fue menor, con relación al control, continuó con la fase exponencial, hasta las 50 h, después entró en fase estacionaria hasta las 96 h. La cinética de la cepa AMJ6 cultivada con iones Cr+6 , fue menor en comparación al cultivo control y con iones cobre. Presento fase Lag de 20 h; luego, la fase exponencial continuó hasta las 35 h aproximadamente, con una duración menor (15 h), continuó la fase estacionaria, hasta las 96 h. La cinética del control fue mayor a la cepa AMJ6 cultivada con iones Cu+2 y con iones Cr+6 (Figura 2 B). Las réplicas de la cinética realizada, y su correspondiente análisis estadístico, se encuentran descritas en las Tabla 6.1_2 y 6.2_2, respectivamente. Para la cepa AMJ6, los resultados muestran que el ion cromo también resultó ser más tóxico que el cobre, aunque la concentración del ion cobre fue cinco veces mayor, en comparación con el ion cromo. Los análisis estadísticos de tendencia central, de las réplicas de las cinéticas, en cada tratamiento, se reportan en las Tablas 5 y 6.
Tabla 6.1_2 Cinéticas de crecimiento de las cepas AMJ6 en caldo YPG pH: 4. UFC/ml. 150 RPM, inoculo 10% (v/v). (Análisis en Tabla 6.2_2).
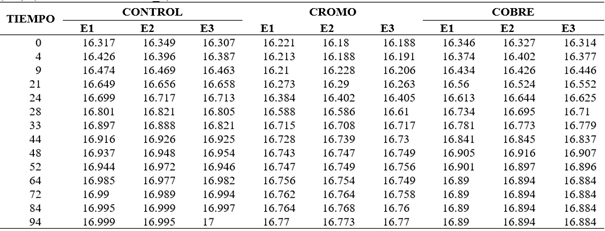
Los valores expresados se encuentran en base logaritmo neperiano (Ln) de las UFC/ml.
Ensayo de Citotoxicidad-Concentración Letal Media (CL50).
El análisis de citotoxicidad se realizó en las dos cepas seleccionadas de Y. lipolytica (AMJ3 y AMJ6) frente a cuatro iones metálicos, en el siguiente orden: Cr+6, Cu+2, Cd+2 y Hg+2. Los controles fueron cultivados en medio YPG sin metal, en condiciones similares, obteniéndose una concentración final de 6.5 x 107 y de 11 x 107 UFC/ml para las cepas Y. lipolytica AMJ3 y AMJ6, respectivamente. La CL50 de Y. lipolytica AMJ3 fue 12.5 ppm (0.24 mM), 85 ppm (1.34 mM), 60 ppm (0.54 mM) y 7.5 ppm (0.04 mM) en el orden descrito (Cr+6, Cu+2, Cd+2 y Hg+2) (Figura 3A); en tanto, la cepa Y. lipolytica AMJ6 mostró una CL50 de 55 ppm (1.06 mM), 90 ppm (1.42 mM), 55 ppm (0.49 mM) y 10 ppm (0.05 mM) en el mismo orden (Cr+6, Cu+2, Cd+2 y Hg+2) (Figura 3B). Los resultados de la CL50 muestran que el metal más letal para ambas cepas fue el Hg+2, seguido del Cr+6, Cd+2 y finalmente el Cu+2. Los resultados de las réplicas y las desviaciones estándar de cada metal se encuentran en la Tabla 7.
Tabla 7 Resultados en UFC/ml de la concentración letal media (CL50) cercanas al 50%, de las cepas AMJ3 y AMJ6, frente a diferentes concentraciones de metales pesados, sembradas en caldo YPG a 20 °C, pH 4 por 48 horas.
(: UFC/ml. x̄: Promedio. σ: Desviación estándar.
Para la cepa AMJ3 se realizó el análisis de varianza por Brown- Forsythe (P = 0.7320) y el análisis de ANOVA de una cola (one way - ANOVA) (P < 0.0001); indicaría que las varianzas de las poblaciones son iguales para estos datos paramétricos y que las diferencias de los tratamientos de las medias son significativas con respecto al grupo control, de igual forma, para la cepa AMJ6. Los asteriscos en la figura muestran las diferencias significativas de las medias, de acuerdo a Brown- Forsythe (P = 0.5640) y ANOVA de una cola (one way - ANOVA) (P < 0.0001); indicaría que las varianzas de las poblaciones son similares, para estos datos paramétricos y que las diferencias de los tratamientos de las medias son significativas con respecto al grupo control.
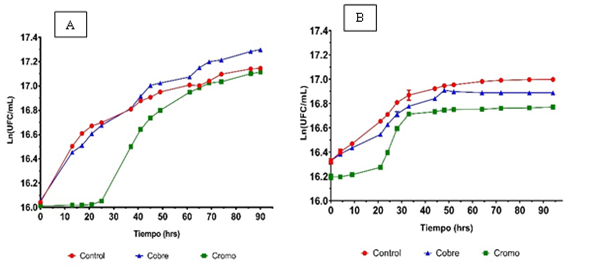
Figura 2 Cinética de crecimiento de las cepas AMJ3 y AMJ6 (Y. lipolytica). Los valores son los promedios de tres réplicas y tratamientos en caldo YPG A) Cepa AMJ3: control (-●-), 80 ppm (1.26 mM) de Cu+2 (-▲-) y 10 ppm (0.192 mM) de Cr+6 (-■-) B) Cepa AMJ6: control (-●-), 80 ppm (1.26 mM) de Cu+2 (-▲-) y 15 ppm (0.29 mM) de Cr+6 (-■-).; D.O (λ = 600 nm).
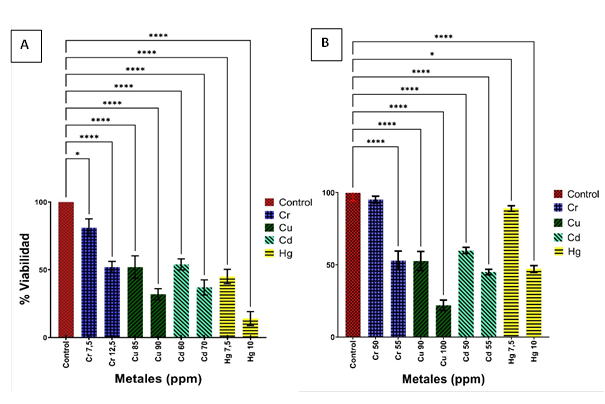
Figura 3 Valores promedio de CL50 de las tres réplicas de la cepa AMJ3 (A) y AMJ6 (B) de Yarrowia lipolytica, expuestas por 3 horas a diferentes concentraciones frente a los iones metálicos (Cr+6, Cu+2, Cd+2 y Hg+2). Los asteriscos en la figura muestran las diferencias significativas de las medias con relación al control.
Jin et al. (2008), trabajaron con una cepa mutante de Saccharomyces cerevisiae frente a los mismos iones metálicos: Cr+6, Cu+2, Cd+2 y Hg+2, reportaron valores de CL50 en el orden descrito de: 90 ppm (0.9 mM), 445 ppm (7.0 mM), 3.4 ppm (0.03 mM) y 0.64 ppm (0.05 mM) respectivamente; comparadas con la CL50 del presente estudio, fue mayor para los iones Cr+6 y Cu+2; y, menor con los iones Cd+2 y Hg+2. La mayor CL50 para los metales Cr+6 y Cu+2 se dio, en la cepa mutante S. cerevisiae, donde se incorporaron genes marcadores kanMX (resistencia a Kanamicina), ADE2 (enzima que cataliza la biosíntesis de nucleótidos de purina) y MET15 (enzima que cataliza la biosíntesis de nucleótidos de metionina).
Los estudios de Mesquita et al. (2015) enfrentaron una cepa de Pichia kudriavzevii a múltiples metales, entre ellos Cd+2 a una concentración de 0.045 mM por 6 h, mostraron una CL50 de 10 a 12 veces menor, que las cepas de Y. lipolytica AMJ3 y AMJ6. Igualmente, Hosiner et al. (2014) reportaron para S. cerevisiae la CL50 de 0.01 mM de Cd+2 en 12 h, donde la CL50 fueron de 54 y 49 veces menor, comparada con las cepas Y. lipolytica AMJ3 y AMJ6, expuestas por 3 h.
Los valores de la CL50 en estas cepas fueron fundamental para determinar su capacidad de biosorción de iones Cu+2 y Cr+6, por lo cual se determinó la viabilidad celular frente a estos dos metales en las cepas Y. lipolytica AMJ3 y Y. lipolytica AMJ6; caso contrario, concentraciones mayores de metales en los ensayos de biosorción, podrían dar falsos negativos.
Biosorción de cromo y cobre.
La biosorción es un proceso en el cual participan mecanismos pasivos y activos, incluye la bioadsorción, referida como la incorporación de metales por los microorganismos a nivel de superficie celular, el cual es un mecanismo pasivo (proceso fisicoquímico), sin gasto de energía; en la bioabsorción y/o bioacumulación participan células vivas, mecanismo de transporte activo, con gasto de energía (Cañizares-Villanueva, 2000; Rehman et al., 2008; Sun et al., 2015).
Para determinar la biosorción de cada metal, se utilizaron concentraciones tomando como referencia los resultados de la CMI, las cinéticas de crecimientos y las CL50. Las concentraciones con el ion Cr+6 fueron de 0.24 mM y 0.96 mM para las cepas Y. lipolytica AMJ3 y AMJ6, respectivamente; obteniéndose a las 72 h una biosorción promedio de las réplicas del 90% con la cepa Y. lipolytica AMJ3 y 92% con la cepa Y. lipolytica AMJ6; a las 96 h, fueron alrededor del 88% en ambas cepas (Figura 4); en las Tablas 8 y 9, se muestran los porcentajes de biosorción de cada replica y sus promedios. Asimismo, es importante mencionar, que la mayor biosorción se obtuvo con Y. lipolytica AMJ6, a una concentración cuatro veces mayor del ion Cr+6, en comparación con la cepa AMJ3. Bankar et al. (2009) emplearon biomasa muerta de Y. lipolytica en una solución de 50 ppm de Cr+6, temperatura de 35 °C a pH 1, agitación de 130 rpm, reportaron una eficiencia máxima de bioadsorción de 95.84% después de 2 h de exposición al metal. En comparación, en el presente estudio la biosorción de Cr+6, a las 72 h de cultivo, fue cercano al 92% con la cepa Y. lipolytica AMJ6 (Figura 4).
Para determinar la biosorción del ion Cu+2 en ambas cepas, se empleó una concentración de 1.26 mM (80 ppm), la biosorción promedio fue de 90% con la cepa Y. lipolytica AMJ3 y de 92% con la cepa Y. lipolytica AMJ6 alrededor de las 72 h; posteriormente en la fase estacionaria, ambas cepas los porcentajes de biosorción disminuyeron por debajo del 75%, debido al envejecimiento, acumulación de metabolitos y muerte celular (Figura 5). Los valores de los porcentajes de biosorción de las tres réplicas en cada ensayo, se encuentran en la Tabla S 4.
Tabla 8 Porcentaje de biosorción de cromo en las réplicas (E1, E2 y E3) con las cepas AMJ3 y AMJ6 en cultivos de 96 horas.
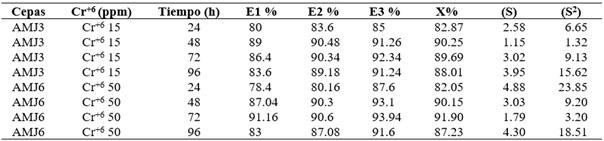
Promedio (X), desviaciones estándar (S) y varianzas (S2).
Tabla 9 Porcentaje de biosorción de cobre en las réplicas (E1, E2 y E3) con las cepas AMJ3 y AMJ6 en cultivos de 96 horas.
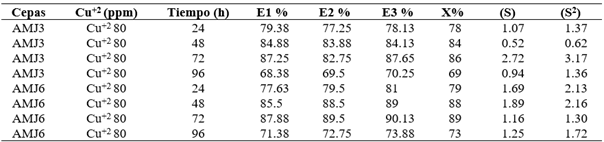
Promedios (X), desviaciones estándar (S) y varianzas (S2).
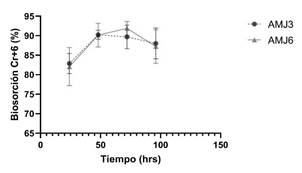
Figura 4 Porcentajes de biosorción de las réplicas de iones Cr+6, cepas Y. lipolytica AMJ3 con 12.5 ppm (0.24 mM) (σ=2.68) y AMJ6 con 50 ppm (0.96 mM) (σ=3.50). Tiempo de incubación 96 horas, 20 °C a 150 rpm.
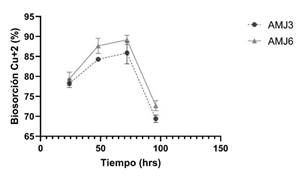
Figura 5 Porcentajes de biosorción de las réplicas de iones Cu+2 , cepas Y. lipolytica AMJ3 (σ=1.31) y AMJ6 (σ=1.49) a 80 ppm (1.26 mM). Tiempo de incubación 96 horas, 20 °C a 150 rpm.
Acosta et al. (2005) reportaron la bioadsorción de Cr+6 por biomasa muerta de las cepas de los hongos Cryptococcus neoformans y Helminthosporium sp., sumergidos en una solución acuosa de 0.2 ppm de Cr+6; C. neoformans fue más eficiente en la remoción de Cr+6 (98%) que Helminthosporium sp. (65%). Es importante recalcar que en dicho estudio se utilizó un método de medición del ion Cr+6 similar al reportado en la presente investigación, en ambos estudios se cuantificaron los iones Cr+6 en los sobrenadantes. Sin embargo, las concentraciones de exposición al ion Cr+6 fueron mayores, 12.5 ppm (0.24 mM) con Y. lipolytica AMJ3 y 50 ppm (0.96 mM) con Y. lipolytica AMJ6, los porcentajes de biosorción estuvieron alrededor de 90% en ambas cepas, además nuestro trabajo fue realizado con células vivas, cultivadas hasta las 96 h. Así mismo, Campaña- Pérez et al., 2019 señalan la capacidad de biosorción frente a los iones metálicos Cr+6 en caldo YPG a 100 ppm, con levaduras nativas de Ecuador, reportadas como Kazachstania yasuniensis, Kodamaea transpacifica, y Saturnispora quitensis, quienes reportan la capacidad de biosorción del 40%, en promedio, en las cepas sin tratamiento y mencionan un aumento significativo de biosorción del 80%, en tratamiento con surfactantes catiónicos (cloruro de benzalconio).
Dil et al. (2017) utilizaron biomasa viva de Y. lipolytica 70562 expuestas a 25 ppm de Cu+2 a pH 6.4, 25 °C por 8.1 h, reportaron 99.74% de biosorción. Si bien estos resultados fueron superiores a los obtenidos con las cepas de Y. lipolytica AMJ3 y AMJ6 (90% y 92%), es importante señalar, que en nuestros ensayos se enfrentaron ambas cepas con 80 ppm de iones Cu+2 donde las concentraciones fueron 3.2 veces mayores (Figura 5). Sun et al. (2015), trabajaron con la cepa de S. cerevisiae AWR1R2 en Medio Sintético Modelo (MSM), con 0.5 mM (32 ppm) de iones Cu+2 a 28 °C, 120 rpm, la eficiencia de biosorción fue de 67.37%. Por otro lado, realizaron análisis de microscopía electrónica diferencial y de ICP-AES, demostraron que la bioadsorción dominó al proceso de bioabsorción de Cu+2.
Los estudios de Rehman et al. (2007), sobre tolerancia y biosorción de iones Cu+2 a una concentración de 100 ppm, por Candida tropicalis, demostraron una eficiencia de biosorción de 82% a las 96 h; valor cercano al obtenido con las cepas Y. lipolytica AMJ3 y AMJ6 (90% y 92%) a las 72 h. Otros estudios de Rehman et al. (2008) sobre biosorción de iones Cu+2 a 0.1 ppm, pH 8.0 a 30 °C por Loddermyces elongisporus, obtienen 81% de biosorción después de 96 h, resultados similares a la presente investigación; sin embargo, las concentraciones de iones Cu+2 fueron 800 veces superiores (80 ppm) en las cepas Y. lipolytica AMJ3 y AMJ6. También Dönmez & Aksu (2001) evaluaron la biosorción del ion Cu+2 en medio YPG, a pH 4.0 con Candida sp., adaptada (expuesta previamente al metal) y no adaptada (no expuesta previamente al metal) frente al ion Cu+2. Observaron una biosorción de 52.1% a una concentración de 92.2 ppm, con la cepa no adaptada y de 67.6% a una concentración de 97.6 ppm, con la cepa adaptada en un tiempo de exposición de 8 días. En los ensayos realizados se obtuvieron resultados superiores, con las cepas Y. lipolytica AMJ3 y AMJ6 (90% y 92%) en un cultivo de 72 h, a una concentración de 80 ppm.
Para los ensayos de biosorción, se tomó como referencia a Rehman et al. (2008), algunos autores, difieren a los reportados en la presente investigación, la mayoría de los estudios de biosorción de metales, trabajan con biomasa muerta o viva (pellets celulares), por lo cual los resultados, se reportan en mg/gramo de biomasa (peso seco), en la presente investigación cuantificamos la capacidad biosorción frente a un metal, a partir de los sobrenadantes en mM o ppm.
Conclusiones
En la presente investigación se estudiaron dos levaduras extremófilas de aguas altoandinas contaminadas con relaves mineros, se determinó la Cinética de Crecimiento, CMI, la CL50 frente a cuatro iones metálicos (Cr+6, Cu+2, Cd+2 y Hg+2), donde el ion Hg+2 fue el más tóxico para ambas cepas, seguido de los iones Cd+2 y Cr+6, el metal menos tóxico fue el ion Cu+2. La biosorción de los iones Cu+2 y Cr+6 fueron cercanas al 90% en ambas cepas de Y. lipolytica AMJ3 y AMJ6. Los resultados obtenidos de CMI y CL50 nos indican que las levaduras son tolerantes a varios iones metálicos; además, tienen alta capacidad de biosorción de estos metales, por lo cual, podrían ser candidatas potenciales en la biorremediación de aguas y suelos agrícolas, contaminados con metales pesados. Por otro lado, es importante recalcar que, en algunos parámetros fisicoquímicos, los ECA del lago Junín mostraron ligera contaminación para los metales (arsénico, cadmio y cobre); sin embargo, en Yanamate los resultados del análisis de metales pesados fueron muy altos y con pH muy ácidos, fuera a los ECA establecidos para cuerpos de agua de tipo IV.












 uBio
uBio