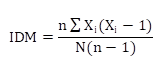Introducción
La Reserva Nacional del Titicaca (RNT), se ubica en el lago homónimo, en la Región de Puno (Perú), a 3 810 msnm (IANP, 2005). Posee una gran diversidad de flora, fauna y recursos naturales (CIRNMA & CEDAFOR, 2001). En los bentos del perifiton se encuentran los poríferos (PNUD & TDPS, 2003). Es probable que la esponja Balliviaspongia wirrmanniBoury - Esnault & Volkmer Ribeiro 1991 haya disminuido su población ya que actualmente está ausente en la bahía interior del lago Titicaca en las proximidades de la ciudad de Puno debido, probablemente,e a la presencia de aguas residuales y contaminantes antrópicos (INRENA, 1996; Beltrán et al., 2015) y mediante observaciones in situ, las esponjas se encuentran ubicadas en zonas con poca influencia humana.
Las esponjas (filo Porifera) son organismos multicelulares muy primitivos y de estructura simple, que manifiestan la evolución de los metazoarios (Erpenbeck & Worheide, 2007). Son exclusivamente acuáticos, ya sean de ambientes marinos, de estuarios o de agua dulce, de vida bentónica sésil, y crecen adheridos a la vegetación, sobre troncos o rocas, pudiendo establecerse perfectamente en ríos y lagunas temporales o permanentes (Rueda & Mesquita, 2018). Las esponjas de agua dulce producen gémulas, como formas de resistencia, que están constituidas por espículas especiales, o gemoscleras, para sobrevivir a fuertes cambios en las condiciones ambientales, como puede ser la temporalidad del sistema. Las gémulas pueden desempeñar un papel de dispersión pasivo facilitado por el viento, las aves o por el flujo del agua (Manconi & Pronzato, 2016).
El tipo de reproducción sexual y/o asexual, desarrollado por las esponjas en las aguas epicontinentales durante el proceso evolutivo, explican parte de la causalidad del alto grado de endemismo de algunas familias y/o géneros y/o especies y los muy escasos taxa de distribución cosmopolita. Las esponjas del lago Titicaca fueron poco estudiadas y la única especie Balliviaspongia wirrmanni debe su nombre al lago Ballivián, que fue un lago del pleistoceno del Altiplano boliviano (Lavenu, 1981). A su vez, Denis Wirrmann fue el investigador que realizó muestreos y observaciones ecológicas (Boury & Volkmer, 1991). Balliviaspongia wirrmanni habita a profundidades de 0.1 y 20 m, generalmente se adhiere a los tallos de las totoras (Schoenoplectus tatora [Kunth] Palla), aunque también se la encuentra adherida a rocas. Aun así, la mayor abundancia de esponjas está asociada a los totorales (Richard & Contreras, 2011), pero la cosecha de totorales con las esponjas adheridas, la quema de los mismos para lograr su rebrote y la contaminación por metales pesados a causa de residuos mineros que llegan al lago Titicaca han, disminuido inmensamente su población (Richard, 2010c). En tal sentido, los objetivos de la investigación fueron determinar la distribución espacial y la abundancia de la esponja Balliviaspongia wirrmanni en la Reserva Nacional del Titicaca, sector Puno.
Materiales y métodos
Área de estudio
La RNT - sector Puno, institución protegida por el Estado Peruano, está ubicada en la Provincia y Región de Puno (Perú) a una elevación de 3 810 msnm; posee la flora y fauna del lago Titicaca (Dejoux & Iltis, 1991) con los que las poblaciones humanas desarrollan actividades socioeconómicas. Está reconocida por la Convención Ramsar de 1997 como un humedal internacional como hábitat de aves acuáticas. El clima es frío y semiseco, con un promedio de temperatura de 9 °C, siendo menores en los meses de junio y julio, y presenta épocas de lluvia (enero a marzo) y época seca (mayo a agosto). Posee un área de 29 150 ha, abarca totorales entre la isla Estévez y la península de Capachica (Figura 1). Sus coordenadas geográficas son 15°50’22’’, 15°43’10’’ S y 70°01’13’’ W. La presencia humana es escasa, y está destinada a la investigación científica, ámbito educativo y recreación familiar (SERNANP, 2019).
Muestreo y evaluación de esponjas
Para llegar a las zonas de evaluación de esponjas se utilizó una lancha de madera de 10 m de eslora y 2.5 m de manga con motor fuera de borda. En cada zona se evaluó un área total de 799 m2. Las esponjas adheridas a los tallos sumergidos de las totoras, y observadas a 50 cm de profundidad, fueron cuantificadas por cuadrantes (C) de 1 m2. La ubicación de los cuadrantes tuvieron una disposición tal como se muestra en la Figura 2, donde cada cuadrante tuvo una separación de 3 m, siendo 5 cuadrantes por transecto, el primer transecto conformado por los primeros cinco cuadrantes tuvieron una disposición longitudinal (C1 al C5); mientras tanto en los siguientes dos transectos los cuadrantes intercalados C7 y C9 estuvieron ubicados a la izquierda del transecto separados por 3 m y 2 m respectivamente; por otro lado, los cuadrantes C12 y C14 fueron establecidos a la derecha del tercer transecto separados por 3 m y 2 m respectivamente, con la finalidad de aleatorizar los puntos de muestreo.
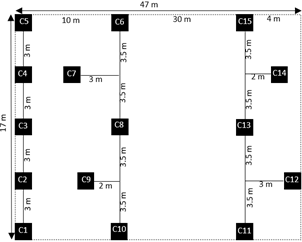
Figura 2 Ubicación de los cuadrantes para la colección de esponjas en las zonas de estudio de la Reserva Nacional del Titicaca - sector Puno.
Los cuadrantes C1, C2, C3, C4 y C5 se evaluaron durante los meses de julio a agosto (periodo I), caracterizado por la escasez de lluvias y temperaturas bajas llegando a -1.3 °C; los cuadrantes C6, C7, C8, C9 y C10 se evaluaron durante los meses de setiembre y octubre (periodo II), meses de transición entre la estación de invierno y de primavera; mientras que los cuadrantes C11, C12, C13, C14 y C15 durante los meses de noviembre y diciembre (periodo III), donde la temperatura es más alta, llegando a los 16.8 °C, el clima más lluvioso con una precipitación promedio de 173.72 mm (SENAMHI, 2020), sumando 90 muestreos en la investigación.
Las esponjas fueron colectadas según las recomendaciones de la UNMSM-MHN (2014). Para ello se realizaron cortes con un bisturí de los tallos de totora que presentaron adheridas las esponjas, con ayuda de pinceles se retiró de las esponjas todo tipo de residuos vegetales procedentes del agua, luego se realizaron enjuagues suaves con la misma agua del Lago Titicaca. Las esponjas colectadas fueron dispuestas en frascos de vidrio conteniendo etanol de 70% para su identificación (Rueda & Mesquita, 2018; Morales et al., 2020). La evaluación externa se realizó en un microscopio estereoscópico OPTICA ST-30 y observaciones microscópicas en un microscopio Zeiss™ LED Primo Star. Para ello se realizaron preparaciones simples extendiendo estructuras de esponjas en suero fisiológico sobre láminas portaobjetos y sobre la preparación se dispuso una lámina cubreobjetos. Las muestras fueron visualizadas a 10X y 40X, la presencia de espículas acantoxas, las formaciones irregulares de 15 cm de longitud por 3 cm de ancho, sin superar el 1.5 cm de espesor, color característico variable del verde vivo al ocre y de consistencia muy blanda (Figura 3), fueron diagnósticas para la especie del porífero en razón de que es la única registrada en el lago Titicaca. Todo ello se realizó en el Laboratorio de Zoología de la Facultad de Ciencias Biológicas de la Universidad Nacional del Altiplano de Puno (Perú).
Distribución espacial de B. wirrmanni
Fue evaluada mediante promedios, desviación estándar y el índice de dispersión de Morisita (IDM), que utiliza valores críticos de uniformidad y agrupamiento, cuyos valores fluctúan entre menos uno y más uno, originando una distribución espacial aleatoria si el IDM es igual a cero, una distribución espacial agregada si es mayor a cero, y una distribución uniforme si es menor a cero (Cabrera & Wallace, 2007). El índice se definió según la Fórmula 1.
Donde:
n = número de cuadrantes;
Xi = número de individuos del cuadrante i;
N = número total de individuos en todos los cuadrantes.
Abundancia de B. wirrmanni
Fue representada en porcentajes de esponjas por zonas y periodos. Para determinar diferencias de abundancia se utilizaron pruebas de Kruskal Wallis, con un nivel de significancia p < 0.05 (Tarqui et al., 2016), donde se trabajó con variables discretas y pruebas de comparación de rangos. Todo el procesamiento de datos se realizó con el software Infostat versión 2020 (Di Rienzo et al., 2020).
Resultados
Distribución espacial de B. wirrmanni
En el muestreo aleatorio de 15 cuadrantes en cada zona de estudio, cinco zonas presentaron cuadrantes sin esponjas, siendo mayor en la zona de Puno con cinco cuadrantes, y cuatro cuadrantes en la zona de Coata, mientras que en las zonas de Paucarcolla, Huata y Capachica, presentaron dos cuadrantes sin esponjas. En contraste, en la zona de la RNT todos los cuadrantes presentaron esponjas (Tabla 1). Los promedios de recuentos de esponjas oscilaron entre 47.20 ± 29.44 en la zona de Puno y 485.20 ± 145.99 en la RNT, existiendo diferencia estadística entre las zonas de estudio (H = 50.56; P < 0.05). Los recuentos en las zonas de Puno y Capachica fueron menores, y mayores en la zona RNT (Figura 4). El IDM fue mayor en la zona de Puno y Capachica, con 15.55 y 15.61, respectivamente; ambos valores indicaron que las esponjas presentaron una distribución espacial contagiosa, lo cual implica que la esponja de agua dulce se encuentra agrupada y/o asociada en lugares específicos, o tiene tendencia gregaria; mientras que en las restantes zonas el IDM fue de 0.0005 y 0.37, indicando que la distribución espacial fue uniforme, lo cual permitiría interpretar una competencia antagónica para ocupar un lugar dentro de su hábitat.
Tabla 1 Datos del número de esponjas Balliviaspongia wirrmanni en seis zonas de estudio en la Reserva Nacional del Titicaca - sector Puno.
| Zonas de la RNT | Nº cuadrantes | Prom ± DE | ID Morisita | Distribución | ||
|---|---|---|---|---|---|---|
| Evaluados | Sin esponjas | Con esponjas | ||||
| Zona 1 (Z1) | 15 | 5 | 10 | 47.20 ± 29.44 | 15.547 | Contagiosa |
| Zona 2 (Z2) | 15 | 2 | 13 | 156.60 ± 122.92 | 0.0034 | Uniforme |
| Zona 3 (Z4) | 15 | 2 | 13 | 183.20 ± 23.09 | 0.0729 | Uniforme |
| Zona 4 (Z4) | 15 | 4 | 11 | 99.40 ± 78.02 | 0.3695 | Uniforme |
| Zona 5 (Z5) | 15 | 2 | 13 | 99.20 ± 52.66 | 15.612 | Contagiosa |
| Zona 6 (Z6) | 15 | 0 | 15 | 485.20 ± 145.99 | 0.0005 | Uniforme |
Abundancia de B. wirrmanni
Los valores de abundancia de las esponjas se presentaron en mayor porcentaje en la zona de la RNT con el 43.35%, seguido de la zona de Paucarcolla con el 18.91%, Huata con el 15.80%, Coata con 10.63%. Mientras tanto, las zonas de Puno y Capachica presentaron 4.60% y 6.71% de abundancia, respectivamente. En las zonas de Coata, Huata y Paucarcolla, existe una abundancia de esponjas poco homogénea en los individuos de totora (S. tatora); en ella existe una intervención antrópica y presencia de ríos tributarios del lago Titicaca, que ocasionarían alteración en el medio acuático donde habitan las esponjas. La zona de la RNT presentó la mayor abundancia de esponjas, en razón de que se caracteriza por presentar macrófitas sumergidas, como los totorales densos, y son de agua poco profunda. Además, es una zona no perturbada por las actividades antrópicas y en ella se realizan investigaciones científicas que no alteran el ecosistema de la zona y tiene la protección del estado (RNT, 2014). La abundancia de las esponjas presentó diferencia estadística significativa (Hcal = 51.40; P < 0.05) entre zonas de muestreo, siendo mayor en la zona de muestreo de la RNT, y la menor se presentó en la zona de Puno.
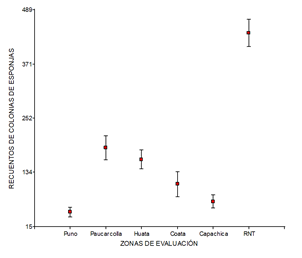
Figura 4 Comparación de recuento de esponjas Balliviaspongia wirrmanni en seis zonas de estudio en la Reserva Nacional del Titicaca - sector Puno.
La abundancia de la esponja B. wirrmanni fue del 36.03% en los meses de julio y agosto (periodo I), siendo la de mayor abundancia. En los meses de setiembre y octubre (periodo II) fue de 32.67%, y por último en los meses de noviembre y diciembre (periodo III) la abundancia fue de 31.30%. La abundancia de la esponja no presentó diferencia estadística significativa (H = 0.32; P = 0.85), por lo que se pueden considerar los valores como homogéneos.
Discusión
En la RNT se encontró el mayor número de esponjas en los meses de julio a agosto (periodo I), esto podría deberse a que es una zona protegida (RNT, 2014), alejada de las ciudades y pueblos circunlacustres, con ausencia de actividad antrópica. Sus aguas son calmadas, ligeramente limpias en periodos secos y poseen una alta densidad de totora (S. tatora) como sustrato, factores que favorecerían la abundancia de la esponja (Richard & Contreras, 2011).
En las zonas de Puno y Capachica, la distribución espacial de esponjas fueron las más bajas, probablemente debido a la problemática de la contaminación del lago Titicaca a causa de aguas residuales producidas por las ciudades de Puno y Juliaca, respectivamente (Gamarra, 2017) y la extracción desmedida de totora para utilizarlo como forraje en la alimentación de sus animales, tales como vacunos, ovinos, entre otros (Richard 2010a; Gammons et al., 2006). Por otro lado, los totorales son quemados por parte de los habitantes ribereños para lograr su pronto rebrote, finalmente se tiene la presencia de la contaminación por metales pesados que proceden de los residuos mineros que llegan a desembocar en el lago Titicaca (Richard & Contreras, 2011), agravando su conservación y disminuyendo el número de individuos (Richard, 2010b). De continuar con los impactos antes mencionados, se producirá una significativa disminución de especies emblemáticas de la flora y fauna local, entre ellas a la B. wirrmanni en la zona de amortiguamiento de la Reserva Nacional del Titicaca (Quispe & Aravena, 2021).
Hace años atrás, los totorales presentes en la bahía interior del lago Titicaca - Puno, servían de sustratos para que las esponjas se establezcan en sus tallos, pero en el transcurrir del tiempo estos organismos presentaron una disminución drástica, llegando solo a ser observadas en totorales alejados de las ciudades y la contaminación que producían sus aguas residuales. Esta desaparición repentina de las esponjas pondría de manifiesto a la especie como indicadora de la contaminación del lago Titicaca. Dado que las aguas residuales fluyen con sus contaminantes a través del cuerpo de la esponja, se comprende, entonces, cómo las mismas las afectan (Richard, 2010c). La abundancia de las esponjas estaría relacionada, entonces, con la productividad y la calidad del agua del ecosistema acuático (Richard, 2010c; Lucey & Cocchiglia, 2014).
Son escasos los estudios realizados en B. wirrmanni en el lago Titicaca, lo cual concuerda con Dröscher & Waringer (2007), quienes afirman que estos organismos tuvieron cierto olvido en cuanto a investigaciones, siendo muchas veces menospreciados, a pesar de poseer importancia en el funcionamiento de los ecosistemas acuáticos, al ser consideradas especies filtradoras y como especie indicadoras de contaminación.
La esponja B. wirrmanni es la única especie del filo Porifera registrada en el lago Titicaca, lo que concuerda con lo reportado por Manconi & Pronzato (2016), quienes manifiestan que las esponjas de agua dulce (Porifera: Demospongia) son un grupo de organismos con reducido número de especies en Europa; sin embargo, al representar una importante biomasa fluvial, son elementos clave en el proceso de transferencia de materia hacia el fondo en su papel de filtradores (Morales et al., 2020).
Conclusiones
La distribución espacial y abundancia de la esponja del lago Titicaca (Balliviaspongia wirrmanni) fue variable entre las seis zonas de evaluación. La RNT fue la que presentó el mayor promedio de número de esponjas (485.20 ± 145.99) por cuadrante evaluado y la distribución espacial establecida fue uniforme, manteniendo sus características de Área Protegida por el Estado Peruano; mientras que las demás zonas estudiadas, por presentar diferentes factores antrópicos de afectación, no hubieran tenido un normal crecimiento y multiplicación. El mayor porcentaje de esponjas (36.03%) se presentaron en los meses de julio - agosto (periodo I), sin presentar diferencia estadística significativa frente a los demás meses de evaluación.












 uBio
uBio