Introducción
A nivel mundial, la gran mayoría de bosques presentan disturbios humanos de diferentes grados, encontrándose en distintas etapas de sucesión. La naturaleza, alcances y temporalidad de estos disturbios influyen en la diversidad biológica de estos bosques; su respuesta ante estos eventos tiene que ver, además, con su ecología y la historia evolutiva de sus especies, así como sus estrategias adaptativas. La necesidad de productos comerciales y la conservación de la biodiversidad es sin duda una problemática vigente que requiere entender la naturaleza dinámica de los bosques. Entender la dinámica de los bosques a través de un periodo prolongado de tiempo, utilizando parámetros de diversidad y estructura, es fundamental para comprender los mecanismos que llevan a la restauración del bosque (Abbas et al., 2019), así como para la implementación de planes adecuados en el manejo de ecosistemas, particularmente en el caso de bosques tropicales.
Los boques húmedos de la Selva Central de Perú (Junín, Huánuco y Pasco), pese a haber sido objeto de intervención antrópica por décadas, aún conservan relictos de bosques de alta diversidad de árboles (Antón & Reynel, 2004; Caro et al., 2004; La Torre-Cuadros et al., 2007; Marcelo-Peña & Reynel, 2014), con un dinamismo heterogéneo principalmente influenciado por las pendientes pronunciadas de los bosques montanos y premontanos que influyen en los valores de mortalidad y reclutamiento de sus especies (Giacomotti & Reynel, 2018; Palacios-Ramos et al., 2018) y en donde pocas especies congregan relativamente el mayor número de árboles (Reynel et al., 2021 Marcelo-Peña & Reynel, 2014; De Rutte & Reynel, 2016). En Chanchamayo (Junín) se ha realizado tala selectiva de especies como Cedrela fissilis Vell. “cedro”, Virolaspp. “cumala”, Aspidosperma macrocarpon Mart. “pumaquiro”, Guarea guidonia (L.) Sleumer “requia”, Terminalia amazonia (J.F. Gmel) Exell “yacushapana” y Juglans neotropica Diels “nogal”; sin embargo, el conocimiento sobre los aspectos relacionados a la ecología y el manejo de los recursos del bosque es aún precario (Marcelo-Peña & Reynel, 2014). Adicionalmente, las localizaciones con abundancia natural de especies comerciales valiosas son escasas en la actualidad y están poco documentadas.
El género Juglans incluye 20-25 especies y se distribuye en varios países del hemisferio norte y algunos países del hemisferio sur. En el neotrópico la especie J. neotrópica Diels se encuentra en los Andes de Perú, Ecuador y Bolivia, entre los 1 000 y 3 500 metros sobre el nivel del mar (Toro & Roldán 2018; Vásquez et al., 2018). Desde la antigüedad, estas plantas han sido conocidas como una fuente de sustancias tóxicas para otro tipo de vegetación (Willis, 2000; Ercisli et al., 2005); sin embargo, sus especies proveen muchos productos como madera, nueces y pigmentos. De las dos especies registradas para Perú, J. neotropica Diels, se encuentra bajo la categoría Casi Amenazado (EN, A1acd+2cd) (UICN, 2018) por la reducción de su área de ocupación y la sobreexplotación maderera.
Este estudio pretende medir la diversidad y composición florística existente en una parcela permanente con abundancia de Juglans neotropica Diels ubicada en los bosques premontanos del Valle de Chanchamayo para revelar si la abundancia de individuos y especies es similar a la que se observa en áreas establecidas con la misma condición de sitio. Esta información sobre la ecología de la especie es relevante, proyectándose a aspectos como la posibilidad de combinarla con otras en sistemas productivos.
Materiales y métodos
Área de estudio y evaluación de parcelas
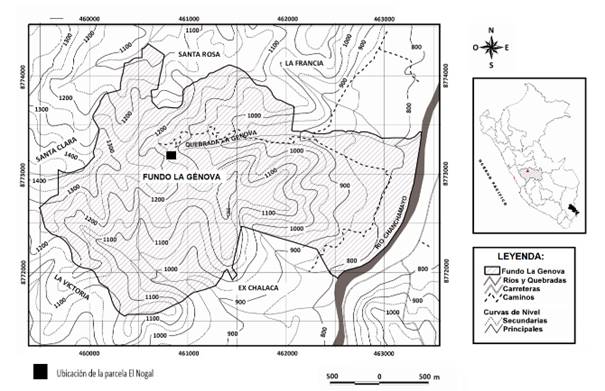
El ámbito de estudio está conformado por el bosque húmedo premontano, entre 1 000 - 1 500 msnm, en el valle de Chanchamayo, distrito de San Ramón, provincia de Chanchamayo, departamento de Junín, Perú. El área donde se estableció la parcela permanente se sitúa en el Instituto Regional de Desarrollo (IRD), Fundo La Génova de la Universidad Nacional Agraria La Molina, ubicado entre las coordenadas UTM 18 L, 459500-463500 m E y 8771500-8774500 m S. De las 300 ha que posee, 40% son bosques húmedos premontanos tropicales en diferentes estados de conservación, siendo menos intervenidos en sus zonas más internas, así como bosques de diferentes edades en las áreas más externas, mezclados con plantaciones forestales y cultivos agrícolas.
La parcela de estudio, denominada “Génova Nogal” y establecida dentro del conjunto de parcelas permanentes levantadas en el ámbito, se encuentra entre las coordenadas UTM 18 L 460666-460803 m E y 8773218-8773339 m S, presenta una temperatura media anual 21.19 °C, precipitación anual 1 679 mm, orientación N-E, gradiente de pendiente 30% y elevación de 1 127 msnm (Figura 1). El suelo es de clase textural franco arenosa, pH 4.88, M.O. 1.49%, CIC 8 meq/100 g. La cobertura vegetal corresponde a un bosque secundario con una historia de uso de suelo de intervención para extracción de especies maderables mayor a 50 años (registro no documentado).
Diseño de muestreo y toma de datos
La parcela forma parte de una red de parcelas establecidas en la zona desde 2003 (Antón & Reynel, 2004; Caro et al., 2004; Reynel & Honorio, 2004; Marcelo-Peña & Reynel, 2014) y mantenidas para estudios vinculados a la dinámica de bosques. La parcela es de una hectárea (100 x100 m) y fue instalada empleando la metodología de la Red Amazónica de Inventarios Forestales-RAINFOR (Phillips et al., 2001). La ubicación de la parcela se escogió debido a su representatividad en una localización con abundancia de la especie J. neotropica. Para la evaluación se levantaron 25 subparcelas de 20 x 20 m, relocalizando dos de ellas debido a su posición en zona de derrumbes.
En cada subparcela se codificaron todos los árboles vivos a partir de 10 cm de diámetro a la altura del pecho (DAP a 1.3 m del suelo), se midieron los DAP y la altura total de cada individuo. Se colectaron muestras botánicas de las especies que fueron preparadas y acondicionadas en campo y luego depositadas en el Herbario de la Facultad de Ciencias Forestales de la Universidad Nacional Agraria - La Molina, Lima. Las muestras fueron identificadas por los dos primeros autores. Se ha seguido el sistema de clasificación por familias del Angiosperm Phylogeny Group (AGP IV, 2016).
Diversidad, composición y estructura
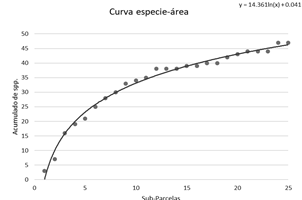
Se calculó la riqueza de especies, o número de especies por hectárea, y la diversidad alfa con el índice Alpha de Fisher (Fisher et al., 1943) y el índice de Shannon - Wiener (De Rutte & Reynel, 2016). Asimismo, se construyó una curva especie-área, utilizando cada subparcela de 20 x 20 m dentro de la parcela permanente para mostrar los valores de riqueza de la parcela de acuerdo al tamaño de la unidad muestral.
Para determinar la composición florística, las especies fueron agrupadas en familias y géneros.
Se calculó el índice de valor de importancia de las especies o IVI (Curtis & Macintosh, 1950, 1951), que expresa los pesos ecológicos de las especies en el bosque, valiéndose de la sumatoria de la abundancia, frecuencia y dominancia relativa de cada especie.
Resultados
Composición florística y diversidad
Se registraron un total de 47 especies, 37 géneros y 20 familias por hectárea. Las Familias más diversas fueron Lauraceae (5 géneros), Malvaceae (5 géneros), Fabaceae (4 géneros), y, Moraceae (3 géneros); las otras 16 familias tuvieron menos de 2 géneros. Los géneros más diversos fueron Ficus (4 especies) y Piper (3 especies), seguidos de Cecropia, Clarisia, Nectandra y Ocotea (todas con 2 especies).
El índice Alfa de Fisher fue de 15.62. Este parámetro es útil para comparar la diversidad de bosques, independientemente del área, en muestras de diferentes tamaños (Fisher (Fisher et al., 1943; Hubbell, 1999; Condit et al., 2005) (Tabla 1). El índice Shannon -Wiener fue de 1.65 reafirmando la baja diversidad.
La curva especie-área tiende a estabilizarse a partir de 0.4 ha del área acumulada, con más del 70% del total de especies registradas en la parcela (Figura 2).
Tabla 1 Índice de Valor de Importancia (IVI).
| N° | Especie | IVI | N Ind. | AR (%) | AB (m2) | DR (%) | Frec. | FR (%) |
|---|---|---|---|---|---|---|---|---|
| 1 | Juglans neotropica | 68.43 | 77 | 25.7 | 4.74 | 29.94 | 20 | 12.82 |
| 2 | Ficus insipida | 20.62 | 6 | 2.0 | 2.54 | 16.06 | 4 | 2.56 |
| 3 | Inga sp.1 | 20.03 | 26 | 8.7 | 0.78 | 4.95 | 10 | 6.41 |
| 4 | Heliocarpus americanus | 19.93 | 32 | 10.7 | 0.45 | 2.85 | 10 | 6.41 |
| 5 | Cecropia membranacea | 15.65 | 12 | 4.0 | 0.83 | 5.24 | 10 | 6.41 |
| 6 | Ficus guianensis | 12.49 | 8 | 2.7 | 0.95 | 5.98 | 6 | 3.85 |
| 7 | Myriocarpa stipitata | 11.84 | 14 | 4.7 | 0.32 | 2.05 | 8 | 5.13 |
| 8 | Coussapoa sp.1 | 11.26 | 12 | 4.0 | 0.64 | 4.05 | 5 | 3.21 |
| 9 | Guarea guidonia | 10.47 | 10 | 3.3 | 0.52 | 3.29 | 6 | 3.85 |
| 10 | Cecropia polystachya | 10.08 | 12 | 4.0 | 0.45 | 2.87 | 5 | 3.21 |
| 11 | Senegalia poliphylla | 9.50 | 8 | 2.7 | 0.37 | 2.34 | 7 | 4.49 |
| 12 | Ficus paraensis | 8.79 | 4 | 1.3 | 0.88 | 5.53 | 3 | 1.92 |
| 13 | Guazuma ulmifolia | 8.53 | 6 | 2.0 | 0.63 | 3.96 | 4 | 2.56 |
| 14 | Trophis caucana | 7.36 | 8 | 2.7 | 0.13 | 0.85 | 6 | 3.85 |
| 15 | Erythrina ulei | 5.02 | 4 | 1.3 | 0.18 | 1.12 | 4 | 2.56 |
| 16 | Margaritaria nobilis | 4.27 | 4 | 1.3 | 0.06 | 0.37 | 4 | 2.56 |
| 17 | Sterculia frondosa | 3.53 | 4 | 1.3 | 0.15 | 0.92 | 2 | 1.28 |
| 18 | Citrus aurantium | 3.35 | 3 | 1.0 | 0.07 | 0.42 | 3 | 1.92 |
| 19 | Rhodostemonodaphne kunthiana | 3.25 | 3 | 1.0 | 0.05 | 0.33 | 3 | 1.92 |
| 20 | Nectandra pulverulenta | 3.20 | 3 | 1.0 | 0.04 | 0.28 | 3 | 1.92 |
| 21 | Cordia alliodora | 3.09 | 4 | 1.3 | 0.08 | 0.47 | 2 | 1.28 |
| 22 | Piper hispidum | 2.95 | 4 | 1.3 | 0.05 | 0.34 | 2 | 1.28 |
| 23 | Ocotea sp.1 | 2.40 | 2 | 0.7 | 0.07 | 0.45 | 2 | 1.28 |
| 24 | Ocotea olivacea | 2.38 | 2 | 0.7 | 0.07 | 0.43 | 2 | 1.28 |
| 25 | Cestrum auraliculatum | 2.30 | 2 | 0.7 | 0.06 | 0.35 | 2 | 1.28 |
| 26 | Clarisia biflora | 2.29 | 2 | 0.7 | 0.05 | 0.34 | 2 | 1.28 |
| 27 | Neea floribunda | 2.19 | 4 | 1.3 | 0.03 | 0.21 | 1 | 0.64 |
| 28 | Endlicheria bracteata | 1.66 | 1 | 0.3 | 0.11 | 0.69 | 1 | 0.64 |
| 29 | Phyllanthus niruri | 1.62 | 2 | 0.7 | 0.05 | 0.32 | 1 | 0.64 |
| 30 | Ochroma pyramidale | 1.61 | 1 | 0.3 | 0.10 | 0.63 | 1 | 0.64 |
| 31 | Nectandra longifolia | 1.60 | 2 | 0.7 | 0.05 | 0.29 | 1 | 0.64 |
| 32 | Mangifera indica | 1.57 | 2 | 0.7 | 0.04 | 0.26 | 1 | 0.64 |
| 33 | Indeterminada sp.2 | 1.54 | 1 | 0.3 | 0.09 | 0.56 | 1 | 0.64 |
| 34 | Piper reticulatum | 1.43 | 2 | 0.7 | 0.02 | 0.12 | 1 | 0.64 |
| 35 | Otoba parvifolia | 1.13 | 1 | 0.3 | 0.03 | 0.16 | 1 | 0.64 |
| 36 | Indeterminada sp.1 | 1.13 | 1 | 0.3 | 0.02 | 0.16 | 1 | 0.64 |
| 37 | Trema micrantha | 1.10 | 1 | 0.3 | 0.02 | 0.13 | 1 | 0.64 |
| 38 | Persea cf caerulea | 1.06 | 1 | 0.3 | 0.01 | 0.09 | 1 | 0.64 |
| 39 | Alchornea triplinervia | 1.06 | 1 | 0.3 | 0.01 | 0.08 | 1 | 0.64 |
| 40 | Campomanesia speciosa | 1.06 | 1 | 0.3 | 0.01 | 0.08 | 1 | 0.64 |
| 41 | Triplaris poeppigiana | 1.06 | 1 | 0.3 | 0.01 | 0.08 | 1 | 0.64 |
| 42 | Senna sp.1 | 1.05 | 1 | 0.3 | 0.01 | 0.07 | 1 | 0.64 |
| 43 | Ficus maxima | 1.04 | 1 | 0.3 | 0.01 | 0.07 | 1 | 0.64 |
| 44 | Pseudobombax munguba | 1.03 | 1 | 0.3 | 0.01 | 0.06 | 1 | 0.64 |
| 45 | Clarisia racemosa | 1.03 | 1 | 0.3 | 0.01 | 0.05 | 1 | 0.64 |
| 46 | Virola calophylla | 1.03 | 1 | 0.3 | 0.01 | 0.05 | 1 | 0.64 |
| 47 | Piper heterophyllum | 1.03 | 1 | 0.3 | 0.01 | 0.05 | 1 | 0.64 |
| TOTALES | 300 | 300 | 100 | 15.83 | 100 | 156 | 100 | |
IVI (Absoluto) = AR + DR + FR, N Ind. = número de individuos, AR = abundancia relativa, AB = área basal, DR = dominancia relativa, Frec. = frecuencia absoluta, FR = frecuencia relativa.
Densidad
Se encontraron un total de 300 individuos por hectárea. Las familias más abundantes fueron: Juglandaceae (77 individuos), Urticaceae (50 individuos) y Malvaceae (44 individuos), seguidas por Fabaceae (39 individuos) y Moraceae (30 individuos). Las primeras tres familias concentran 57% del total de individuos. La especie más abundante fue J. neotropica Diels (77 individuos) y la segunda Heliocarpus americanus L. (32 individuos). Como se puede apreciar, existe una gran diferencia entre el número de individuos de las dos especies más abundantes; a partir de la segunda, el número disminuye a menos de 20 individuos.
Clases diamétricas y área basal
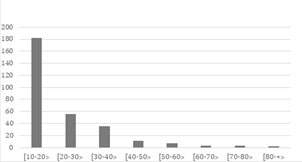
La curva de distribución de individuos por clase diamétrica tiene forma de “j” invertida, propia de bosques primarios (Louman et al., 2001). El 60.87% de los individuos (182 de 300 individuos) presentan diámetros de 10 -20 cm, mientras que sólo 5 individuos del género Ficus tuvieron diámetros ≥ 70 cm.
El área basal de la parcela fue de 15 m2. Las especies con mayor área basal fueron J. neotropica Diels con 4.74 m2 y Ficus insipida Willd. con 2.54 m2, las cuales sumaron 46% del área basal total.
Asimismo, las clases diamétricas para la especie J. neotropica Diels mostraron que el 45% de los individuos se concentraron en la clase de entre 10 a 19.99 cm, 21% en las clases de 20 a 29.99 cm y el otro 21% en la de 30 a 39.99 cm (Figura 3).
Índice de valor de importancia
La especie más importante fue J. neotropica Diels (68.43%), notoriamente distante de las siguientes, Ficus insipida Willd. (20.62%), Inga sp. (20.03%), Heliocarpus americanus L. (19.93%), y Cecropia membranacea Trécul (15.65%). La especie J. neotropica Diels representó 22.81% del IVI total de las especies registradas en el estudio.
Las familias ecológicamente más importantes fueron Juglandaceae (57.74%) y Moraceae (53.77%).
Discusión
La parcela evaluada es una muestra de un bosque en el estrato premontano tropical con abundancia de Juglans neotropica Diels, que presenta una composición florística particularmente distinta a otros sitios en el ámbito. La segunda especie más abundante, Heliocarpus americanus L., registra menos de la mitad de individuos que J. neotropica Diels, y sólo Ingasp, Cecropia membranacea Trécul, Cecropia polystachya Trécul, Cousapoasp, Guarea guidonia (L.) Sleumer y Myriocarpa stipitata Benth superan los 10 individuos por especie. Otros estudios para el estrato premontano señalan que las especies conspicuas son Cedrelinga cateniformis (Ducke) Ducke, Guatteria hyposericea Diels y Vochysia venulosa Warm. (Marcelo-Peña & Reynel, 2014), sin embargo, estas no se registraron en el área de estudio. A nivel de género y familia, la composición de esta parcela también fue notoriamente diferente a otras en áreas aledañas (Antón & Reynel, 2004; Caro et al., 2004, Marcelo-Peña & Reynel, 2014) (Tablas 2 y 3). La cantidad de especies, géneros y familias reportadas fueron notoriamente menores a parcelas permanentes evaluadas en el mismo estrato del ámbito de estudio (Tabla 4). Investigaciones en el bosque premontano señalan a las familias Lauraceae, Moraceae, Fabaceae, Rubiaceae, Cecropiaceae, Euphorbiaceae y Melastomataceae como las más importantes en diversidad (Antón & Reynel, 2004; Caro et al., 2004, Marcelo-Peña & Reynel, 2014). Sin embargo, sólo se registraron 3 de éstas como las más diversas en el sitio estudiado, Moraceae, Lauraceae y Fabaceae, además de Malvaceae. Factores ambientales como la topografía, profundidad y fertilidad del suelo pueden influenciar en la composición florística de los bosques (Chao et al., 2008).
Tabla 2 Familias más abundantes en parcelas permanentes en bosques premontanos de la Selva Central (La Merced y Satipo) (Marcelo-Peña & Reynel, 2014), incluyendo la parcela evaluada en el presente estudio “Génova-Nogal”. Todas son parcelas de 1 ha, con árboles de DAP ≥ 10 cm.
| Familias | Presente estudio | P-GC | P-GL | P-ST | P-MTL |
|---|---|---|---|---|---|
| Juglandaceae | 77 | 0 | 0 | 0 | 0 |
| Urticaceae | 50 | 6 | 8 | 4 | 6 |
| Malvaceae | 40 | 6 | 5 | 1 | 5 |
| Fabaceae | 39 | 7 | 9 | 11 | 11 |
| Moraceae | 30 | 12 | 10 | 20 | 6 |
| Lauraceae | 14 | 14 | 10 | 11 | 4 |
| Meliaceae | 10 | 4 | 5 | 2 | 5 |
| Piperaceae | 7 | 0 | 2 | 0 | 0 |
| Phyllantaceae | 6 | 0 | 0 | 0 | 0 |
| Boraginaceae | 4 | 0 | 0 | 0 | 0 |
| Rubiaceae | 0 | 7 | 4 | 3 | 10 |
| Melastomataceae | 0 | 4 | 0 | 7 | 5 |
| Euphorbiaceae | 1 | 4 | 3 | 7 | 9 |
| Clusiaceae | 0 | 4 | 2 | 2 | 3 |
| Cecropiaceae | 0 | 92 |
P-GC = Génova cumbre, P-GL = Génova ladera, P-ST = Santa Teresa Bosque Secundario, P-MTL = Microcuenca el Tirol Ladera.
Tabla 3 Géneros más abundantes hallados en parcelas permanentes en bosques premontanos de Selva Central (La Merced y Satipo) (Marcelo-Peña & Reynel, 2014), incluyendo la parcela evaluada en el presente estudio. Todas son parcelas de 1 ha, con árboles de DAP ≥ 10 cm.
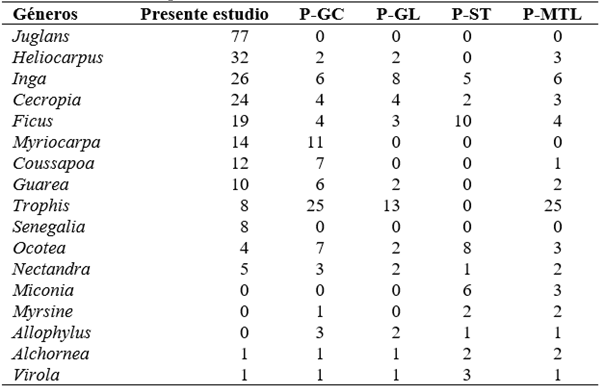
P-GC = Génova cumbre, P-GL = Génova ladera, Santa Teresa Bosque Secundario, P-TL = Microcuenca el Tirol Ladera.
Tabla 4 Diversidad hallada en parcelas permanentes en bosques premontanos de Selva central (La Merced y Satipo) (Marcelo-Peña & Reynel, 2014), incluyendo la parcela de estudio evaluada. Todas son parcelas de 1 ha, con árboles de DAP ≥ 10 cm.
| Presente estudio | P-GC | P-GL | P-ST | P-MTL | |
|---|---|---|---|---|---|
| N°individuos | 300 | 505 | 353 | 775 | 473 |
| N° especies | 47 | 121 | 90 | 102 | 124 |
| N° géneros | 37 | 83 | 55 | 67 | 90 |
| N° familias | 20 | 39 | 28 | 37 | 40 |
| Índice de Fisher | 15.62 | 51.10 | 39 | 31 | 54 |
| Elevación (msnm) | 1 127 | 1 150 | 1 075 | 1 090 | 1 150 |
P-GC = Génova cumbre, P-GL = Génova ladera, Santa Teresa Bosque Secundario, P-MTL = icrocuenca el Tirol Ladera.
La posición de Heliocarpus americanus, Cecropia membranacea y Cecropia polystachya en el IVI podría sugerir que estas especies heliófilas encuentran espacios producto de una condición de intervención antrópica que data de más de 60 años; sin embargo, el dinamismo del bosque podría tener un papel preponderante en la generación de condiciones de sitio que favorecen temporalmente el incremento de número de individuos de éstas especies. Se requiere ampliar los estudios sobre la dinámica del bosque.
Para los bosques tropicales, estudios previos han propuesto que, a escalas locales, la diversidad es el resultado de factores (Ter Steege, 2003) como las condiciones de sitio. Así, por ejemplo, la porosidad del suelo podría incrementar el estrés hídrico y disminuir la diversidad (Esquivel-Muelbert et al., 2017). Es notoria la baja cantidad de individuos, 300 vs. más de 500 individuos, encontrados en parcelas establecidas en bosques similares en el ámbito (Tabla 1); es decir, la densidad de árboles es mucho menor. El área basal, 15 m2, es también menor en comparación a otras reportadas para el mismo estrato, que muestran valores entre 18 - 21 m2 (De Rutte & Reynel, 2016); esto sugiere que, aunque comparten condiciones ambientales de temperatura y precipitación similares, las condiciones locales son distintas, entre ellas, las características del suelo y de los microorganismos que intervienen en la descomposición de la materia orgánica y aquellos asociados a la disponibilidad de nutrientes para las plantas; aspecto que requieren ser profundizados.
La diversidad de esta área es notoriamente menor a la de otros bosques premontanos evaluados en la zona de estudio (Tabla 1; Marcelo-Peña & Reynel, 2014; De Rutte & Reynel, 2016). Para el ámbito cercano y en el mismo estrato altitudinal, entre 900 y 1 500 msnm, se han reportado altos índices de diversidad (La Torre-Cuadros et al., 2007; Giacomotti & Reynel, 2018), así como en bosques premontanos en Colombia, donde los valores alfa de Fisher son 4 veces más altos (López & Duque, 2010).
Específicamente, el ámbito de estudio está compuesto por relictos de bosques (Antón & Reynel, 2004), algunos en distintos grados de sucesión ecológica producto de intervenciones antrópicas (Palacios-Ramos et al., 2018; Quintero et al., 2020), una condición que podría considerarse favorable para la dominancia de muy pocas especies, teniendo en cuenta que cuanto más pequeño y fragmentado es el bosque mayor será la posibilidad de dominio local (Ter Steege et al., 2019); sin embargo, aun cuando en los otros sitios del ámbito la abundancia de árboles se concentra en relativamente pocas especies, ninguno presenta valores tan altos como los reportados para J. neotropica.
La influencia de el alto número de individuos de Juglans neotropica es evidente, y al alcanzar más del 60%, encaja bajo el concepto propuesto de monodominancia (Peh et al., 2011); en donde la supremacía de una especie reduce la diversidad; ésta es una condición relativamente poco común en los diferentes tipos de bosques húmedos tropicales (Ter Steege et al., 2019; Araújo et al., 2022) y que no se ha reportado para los bosques premontanos de la Selva Central de Perú.
Si bien se ha sugerido que los rodales dominados por una sola especie podrían estar principalmente vinculados a factores edáficos, no es posible generalizar su influencia para los bosques monodominantes (Peh et al., 2011; Ter Steege et al., 2019). Aspectos relacionados a los mecanismos de dispersión y hábito gregario, incluso semillas grandes que pueden superar la hojarasca profunda también han sido relacionados con la monodominancia (Peh et al., 2011; Kazmierczak et al., 2016). Las características morfológicas de los frutos y semillas de J. neotropica pueden ser considerados para análisis posteriores en esa línea.
Las diferencias en la diversidad podrían deberse a las propiedades alelopáticas del género Juglans, que, por sus altos contenidos tánicos, impide el crecimiento de algunos individuos a su alrededor, favoreciendo la conformación de comunidades vegetales compatibles con su presencia, con abundancia de familias como Fabaceae (Toro & Roldán, 2018); y que para el sitio estudiado además incluye a Moraceae y Urticaceae. En especies leñosas la alelopatía es prolongada, las especies perennifolias agregan materia orgánica paulatinamente al suelo, el tiempo de descomposición de la corteza es largo y hay mayor persistencia de los aleloquímicos (Rietveld et al., 1983). El efecto alelopático del género Juglans ha sido históricamente reportado (Cook, 1921; Massey, 1925; Schneiderhan, 1927; Davis, 1928; Molisch, 1937; Brooks, 1951; Fregoni & Zioni, 1964; Macdaniels & Pinnow, 1976; Gabriel, 1975; Funk et al., 1979; Melkania, 1984; De Scisciolo et al., 1990; Hejl et al., 1993; Jose & Gillespie, 1998; Willis, 2000), evidenciando su influencia negativa en la diversidad. Los mecanismos que la propician la monodominancia en los bosques húmedos tropicales son el resultado de un conjunto de factores ecológicos integrados; y a pesar de que aún son tema de discusión (Peh et al., 2011; ter Steege et al., 2019; Araújo et al., 2022), a la luz de nuestros resultados se podría sugerir que la dominancia de J. neotropica Diels está afectando la riqueza específica del sitio.
Los resultados del área de estudio pueden compararse con los de las parcelas permanentes mencionadas en este artículo, ya que se trata del mismo estrato de elevación y la misma zona de vida de acuerdo a la clasificación de Holdridge (Holdridge, 1967). De acuerdo a los objetivos y alcances de la investigación los resultados obtenidos de la parcela han sido comparados con otras parcelas permanentes levantas en el ámbito de estudio. La especie se ha registrado en cinco de las 20 parcelas de muestreo establecidas entre los 900 y los 1 200 msnm y en una parcela ubicada sobre los 2 000 msnm; en todos los casos no alcanza el 1% de la abundancia relativa con excepción de un área en donde los 11 individuos presentes representan apenas en 2%. Estudios anteriores confirman también que pertenecen esencialmente al mismo ensamblaje de flora (Marcelo-Peña & Reynel, 2014). En ese contexto, son relevantes nuestros resultados, que muestran condiciones florísticas particulares que requieren ser consideradas en la perspectiva del manejo y conservación de los bosques premontanos de la Selva Central de Perú en la medida que contienen a una especie económicamente importante.
Conclusiones
La parcela evaluada muestra una clara dominancia de la especie Juglans neotropica Diels y valores de diversidad de especies y densidad de individuos arbóreos notoriamente bajos, comparada con otros bosques premontanos evaluados a la misma elevación y en el mismo ámbito. Si bien la condición alelopática del género Juglans sugiere razonablemente que dicha característica puede haber sido determinante de los bajos valores de diversidad y densidad arbórea hallados, se requieren más estudios específicos sobre la especie, su efecto en el suelo y la vegetación circundante, y su impacto sobre la dinámica del bosque en el mediano y largo plazo.
El sitio de estudio constituye una muestra valiosa de un área natural con predominio de la especie mencionada, la cual por su valor maderable es actualmente muy escasa en el ámbito de estudio. Por lo tanto, la parcela representa no solamente un área valiosa para la investigación, sino también un espacio para la conservación del germoplasma de la especie..












 uBio
uBio