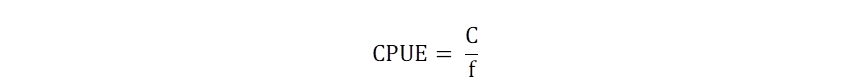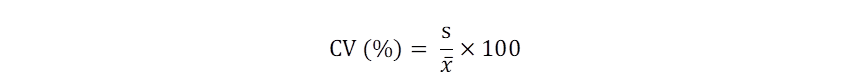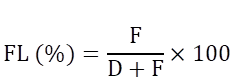Introducción
La samasa o marqueta Anchoa nasus (Kner & Steindachner, 1867) es un pez pelágico de la familia Engraulidae, que se distribuye desde el norte del golfo de California hasta las islas Chincha (Perú) y probablemente más al sur (Serra & Tsukayama, 1988). Chirichigno & Cornejo (2001) indican que la distribución latitudinal de la samasa abarca desde la Bahía San Juanico (México) a Chimbote (Perú), pero ocasionalmente se desplaza hasta Callao y Pisco. En este sentido, la bahía de Pisco, departamento de Ica en el Perú, representa un fragmento del área total donde habita esta especie.
Con respecto a la pesquería, Bouchon (2007) reportó que, en el período 1993 - 1997, ocurrieron dos picos menores de capturas entre agosto - octubre de 1993 y mayo - octubre de 1995, con un promedio de 30 mil toneladas capturadas mayormente en Paita. Durante 1996 se registró una captura de 31 mil toneladas de samasa en la costa peruana. A partir de mayo de 1997, debido al evento El Niño 1997-98 y a los bajos niveles de anchoveta, las capturas de la samasa llegaron a un máximo histórico en julio de 1998 con 178 mil toneladas.
El efecto de los factores ambientales se percibe en diferentes actividades, sobre todo en la explotación pesquera, como se notó durante la etapa madura del evento El Niño de 1997-1998, cuando la samasa presentó una mayor distribución, abarcando todo el litoral peruano, pero al finalizar el evento la samasa retornó a sus áreas habituales. La zona norte de la bahía de Pisco (Figura 1) es considerada propicia para el desarrollo de esta especie (Pasache-Medina et al., 2021), es así que Morón et al. (1997) encontraron en la parte sur de la bahía de Pisco temperaturas superficiales entre 14.2 °C y 15.0 °C, salinidades entre 34.96 a 34.99 y valores de oxígeno entre 3 y 4 ml·l-1, por otro lado, en el norte de la bahía encontraron un rango de temperaturas más altas entre 16.0 °C y 18.5 °C, salinidades entre 34.99 y 35.04 y valores de oxígeno mayores a 5 ml·l-1.
Por tales motivos, se justifica analizar en esta zona cómo influyen ciertos parámetros oceanográficos en la conformación del nicho ecológico de la samasa, definido sensuHutchinson (1944) como la suma de los factores ambientales que actúan sobre un organismo, en vista de que los cambios ambientales afectarán la dinámica de desarrollo del recurso investigado y, por ende, repercutirán en la captura y esfuerzo de la flota pesquera.
La relevancia de esta investigación radica en que las condiciones oceanográficas de la zona norte de la bahía Pisco están en relación directa con la pesquería de la samasa, que es una actividad importante porque genera empleos en su fase de captura, manejo, distribución y comercialización. Saldarriaga (2015) indica que la samasa se encontró como captura incidental de la pesca de anchoveta, representando el 3% de la captura total.
El objetivo de esta investigación fue determinar el efecto de los factores ambientales sobre la abundancia relativa de la samasa e identificar cuáles son los más limitantes en la bahía de Pisco. Ello posibilitará conocer el nicho ecológico de este recurso, sensuHutchinson (1944), realizar futuras aplicaciones en la determinación de su hábitat potencial y comprender las relaciones entre su distribución espacial y los parámetros oceanográficos con el fin de contribuir al ordenamiento pesquero de la samasa.
Ante los escasos estudios sobre el nicho ecológico de la samasa, habiéndose reportado desovando entre los meses de enero a marzo (Whitehead et al., 1988), y siendo zooplanctófaga con una dieta compuesta por eufáusidos y copépodos (Bouchon, 2007), se planteó como hipótesis que el nicho ecológico de A. nasus, en función de la temperatura y salinidad a nivel superficial, se encontraría en el rango de especies mesófilas y marinas, respectivamente; y en relación con el oxígeno disuelto y la clorofila a se encontraría en el rango de especies normóxicas y mesotróficas, respectivamente (de acuerdo a los rangos de Vieille & Zeikis, 2001; Mitsch & Gosselink, 1993; Diaz & Rosenberg, 1995; y Moreno et al., 2010).
Materiales y métodos
El área de estudio comprendió la zona marina y costera entre la Isla Ovillos (13°44” S) y Tambo de Mora (13°28” S) correspondiente a la zona de pesca de samasa generalmente dentro de las 2 mn (Figura 1), en el Departamento de Pisco (Perú).
Los datos oceanográficos del periodo 2011-2017 (aproximadamente 40 fechas en 5 estaciones oceanográficas), en el nivel de superficie, de temperatura superficial (TSM), oxígeno disuelto superficial (OSM), y salinidad superficial (SSM), se obtuvieron de las estaciones 1, 4, 6, 7 y 11 (Figura 1) del programa de monitoreo del estado de la calidad ambiental en la bahía de Paracas (Morón et al., 2017) que realiza el Laboratorio Costero de Pisco del Instituto del Mar del Perú (IMARPE). Los datos de captura y esfuerzo, no georeferenciados, ejercidos por la flota pesquera artesanal se obtuvieron del Laboratorio Costero de Pisco - IMARPE. La información diaria de clorofila a en superficie del mar (CLA) se obtuvo mediante sensoramiento remoto con el sensor de color del satélite MODIS a una resolución de 4 km (NASA, 2023). La frecuencia de muestreo fue irregular, siendo en promedio trimestral.
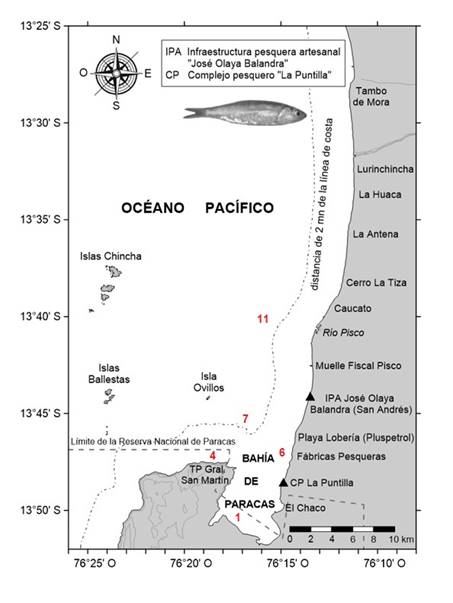
Figura 1 Área de estudio de la samasa Anchoa nasus en Pisco. Se indican puntos de desembarque (triángulos negros), estaciones oceanográficas (número rojos) y zona de pesca de samasa (< 2 mn).
Para calcular la captura por unidad de esfuerzo (CPUE) instantánea se utilizó la Fórmula 1 (Sparre & Venema, 1999).
Donde CPUE es el Índice de abundancia relativa, C es el Peso total capturado, f pesquero expresado en número de viajes de pesca ejercido por la flota pesquera.
Con el fin de determinar fases temporales de los factores ambientales se graficaron las series de tiempo de los promedios de las estaciones 1,4, 6, 7 y 11, y se suavizaron mediante polinomios de grado 6. Se realizaron Análisis de Componentes Principales (ACP), Análisis de clasificación (dendrograma) y diagrama de ordicluster con los dos primeros componentes principales PC1 y PC2 (Borcard et al., 2011) entre fechas en base a los factores ambientales, usando el paquete “vegan” del software R (R Core Team, 2019). Adicionalmente, se calculó el coeficiente de variabilidad (Fórmula 2) de la CPUE con los promedios anuales (CV interanual) y el promedio de los CV intraanuales (CV intraanual).
Donde s es la desviación estándar y x es el promedio. Finalmente, se usó el Índice Térmico Costero Peruano (ITCP) (Quispe-Ccallauri et al., 2018) para identificar los períodos fríos, neutros y cálidos del mar peruano, y su efecto sobre la CPUE de la samasa.
Los datos de abundancia relativa se relacionaron con los factores ambientales usando Modelos Aditivos Generalizados (GAM) (Hastie & Tibshirani, 1990), los cuales fueron ajustados mediante el método de Enfoque de Aproximación de Laplace Anidada Integrada (INLA) (Rue et al., 2009) para calcular el nicho ecológico de la samasa para cada factor ambiental. El método INLA usa un enfoque bayesiano para estimar los parámetros del GAM. Los cálculos se realizaron usando el paquete “R-INLA” (Martino & Rue, 2009) del software R (R Core Team, 2019).
Para determinar las variables ambientales más limitantes para la samasa se diseñó la Fórmula 3 para calcular la frecuencia limitante (FL).
Donde F es el número de valores de cada factor ambiental que se encuentran fuera del nicho ecológico definido mediante INLA, D es el número de valores que se encuentran dentro del nicho ecológico. De esta manera, la FL permite establecer un ranqueo de los factores ambientales cuantificando la frecuencia en que se encuentran fuera del nicho ecológico.
Resultados
Variación temporal de condiciones ambientales
La TSM osciló entre 15.87 °C y 23.10 °C (Figura 2a), el ITCP indica que en los años 2011 y 2013 hubo condiciones frías y neutras, mientras que en mayo del 2014 y octubre del 2016 estuvieron acompañados de períodos cálidos por efecto de eventos El Niño; sin embargo, otro período cálido ocurrió durante los primeros cuatro meses del año 2017 debido a una ola de calor marina (Pietri et al., 2021). Las concentraciones halinas en la superficie presentaron rangos entre 34.727 y 35.211 (Figura 2b). Las concentraciones de oxígeno disuelto en la superficie se encontraron entre 2.90 y 9.71 mg·l-1 (Figura 2c). Las concentraciones de clorofila en superficie se encontraron entre 2.53 y 19.71 mg·m-3 (Figura 2d).
Variación temporal de parámetros biológico-pesqueros
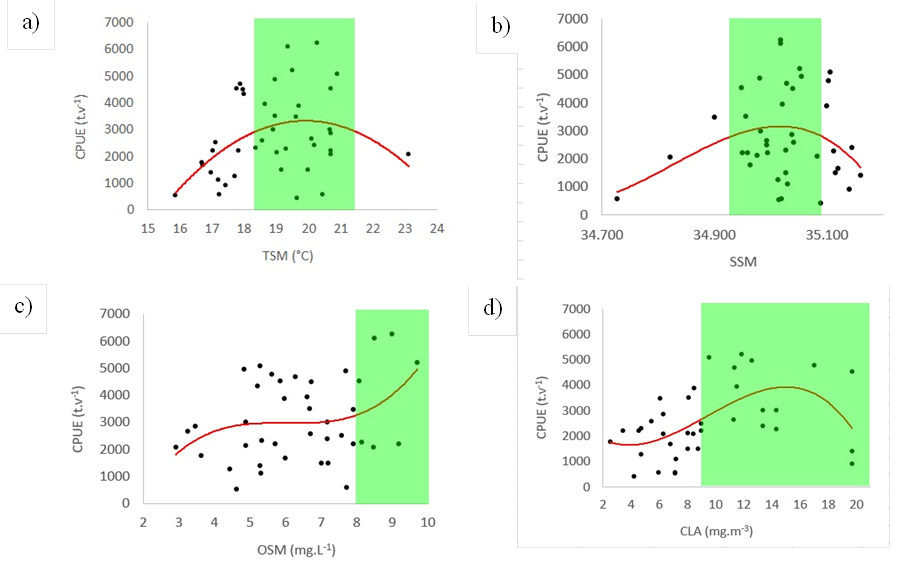
Los máximos valores de la CPUE ocurrieron en abril de 2012, octubre-noviembre de 2016 y setiembre de 2017 (Figura 3a). Los valores más bajos de la CPUE ocurrieron en mayo-julio de 2011, mayo de 2013 y en setiembre de 2014 (Figura 3a). Los mayores valores de CPUE estuvieron asociados a TSM alrededor de 20 °C, este valor se encuentra dentro de los límites mínimo y máximo del nicho ecológico de la samasa. Los mayores valores de CPUE se encontraron con salinidades entre 34.998 y 35.017 en la superficie; estos valores se encuentran dentro de los límites del nicho ecológico de la samasa. Los mayores valores de la CPUE se encontraron con niveles de oxígeno mayores a 5.15 mg·l-1 en superficie y a niveles de clorofila a, mayores de 5.35 mg·m-3. Cabe destacar que entre febrero y abril 2017, debido a una ola de calor marina (Pietri et al., 2021), ocurrieron picos de oxígeno intercalados con caídas de oxígeno (Ledesma et al., 2021), lo que pudo contribuir a que no se reduzca el CPUE de la samasa durante ese evento.
La talla mínima de captura de samasa es 9.5 cm (Ministerio de la Producción, 2001), los resultados muestran que durante los años 2011-2013 la captura estuvo compuesta de ejemplares por encima de la talla mínima señalada (Figura 3b).
Fases temporales ambientales
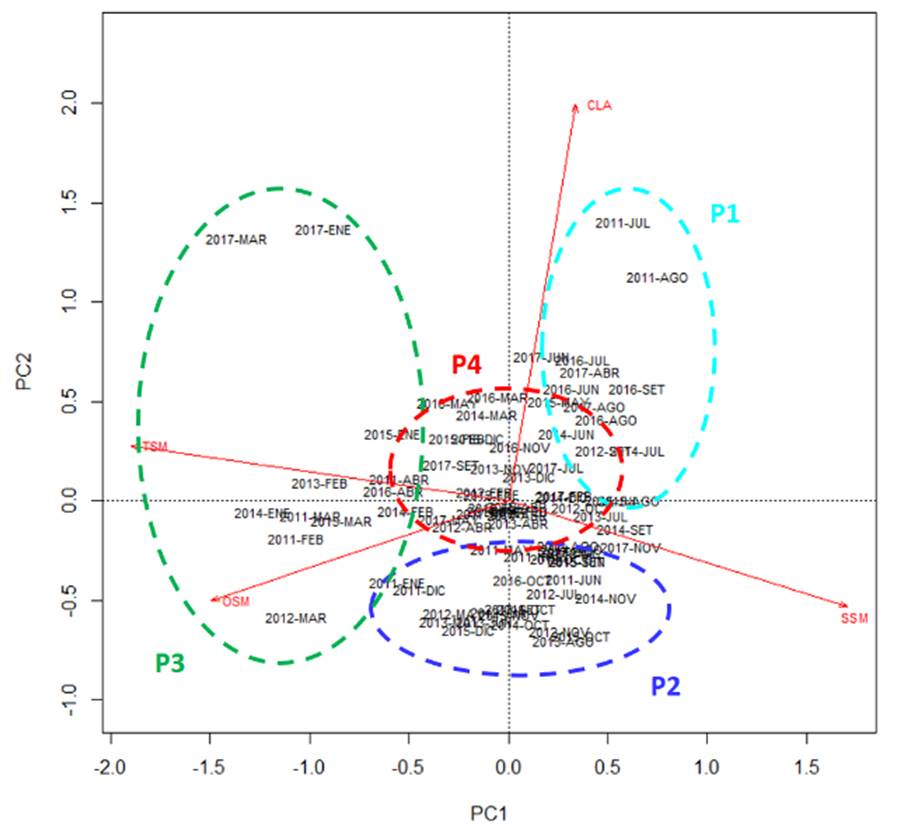
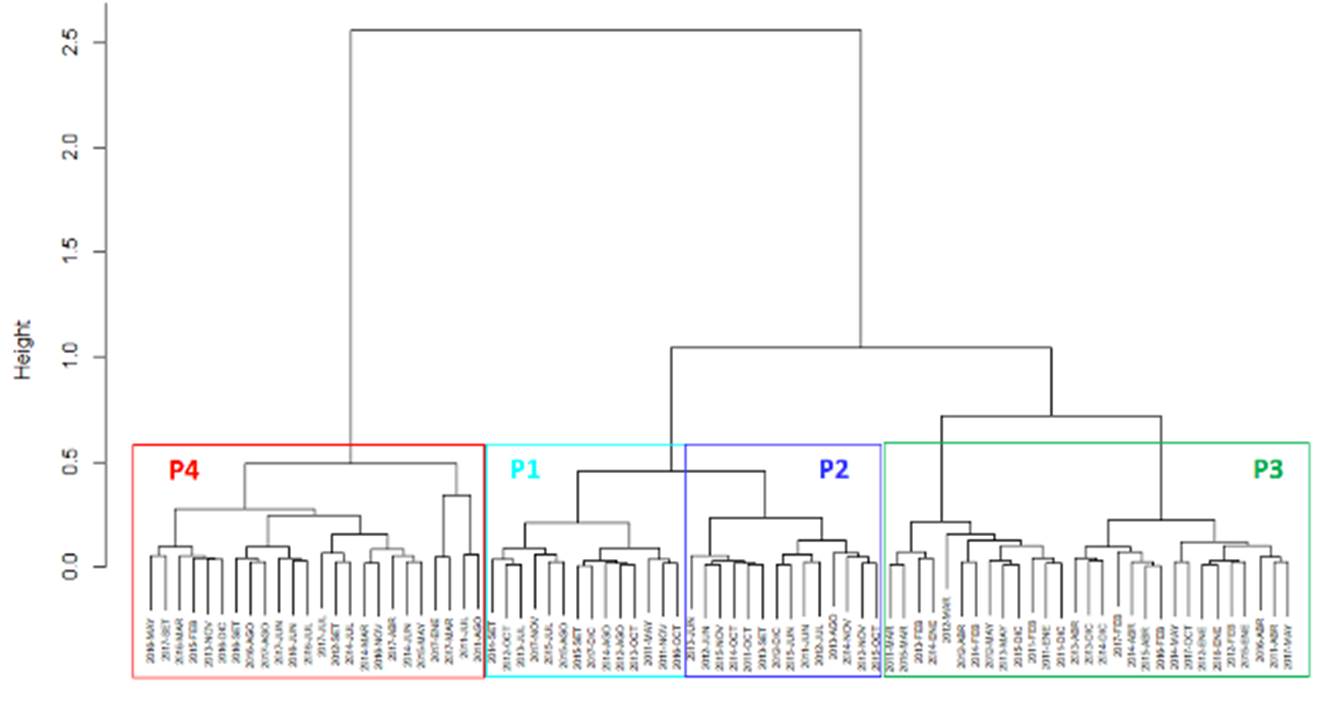
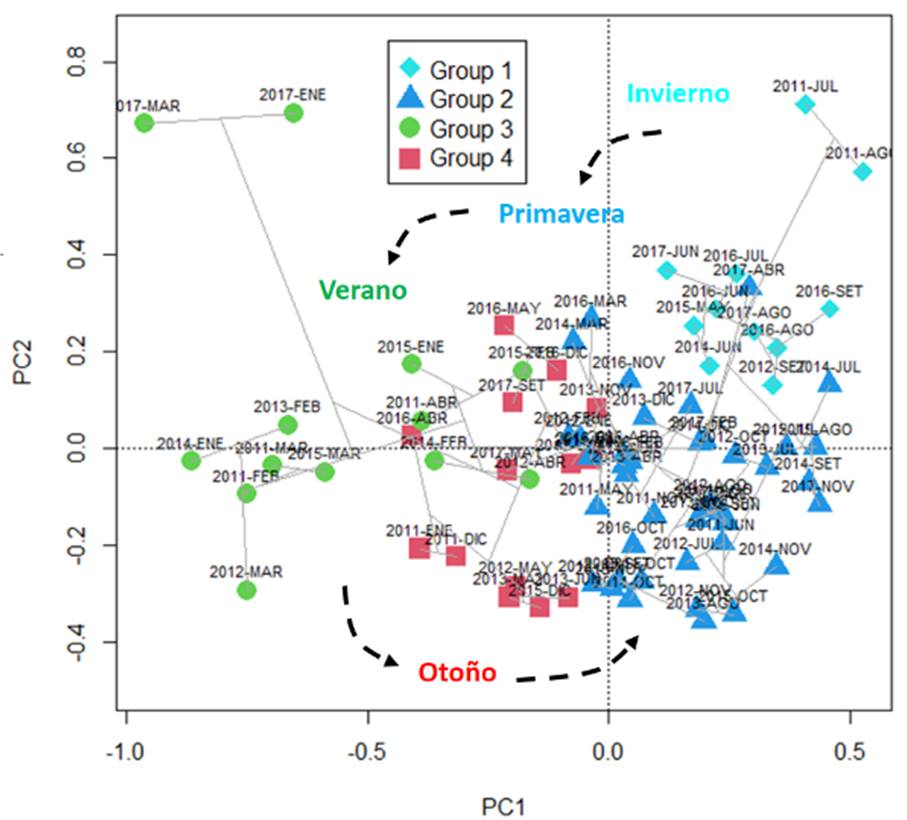
Del ACP entre fechas, en base a los factores ambientales, se identificaron 4 grupos de fechas o fases temporales con los dos primeros componentes principales (PC1, PC2), representando el 75.2% de la inercia (Figura 4): Fase P1: Meses de invierno y primavera, asociados a CLA; Fase P2: Meses de primavera asociados a SSM; Fase P3: Meses de verano asociados a TSM y OSM; y Fase P4: Meses de otoño, con valores intermedios de las variables.
Del análisis de clasificación (Figura 5), si se hace un corte aproximado al 60% de la distancia en el dendrograma, se identifican 4 grupos de fechas o fases notablemente diferenciados: Fase P1: meses de invierno; Fase P2: meses de primavera; Fase P3: meses que abarcan el verano y otoño; y Fase P4: meses que están relacionados mayormente al otoño e invierno.
Con la técnica de ordicluster (Figura 6) se observó que los 4 grupos del dendrograma corresponden aproximadamente a los 4 grupos de la ordenación y clasificación multivariada, observándose que los grupos corresponden a las estaciones del año, lo cual indica que la variación estacional fue mayor que la variación interanual durante el periodo de estudio. Esta variación ambiental se reflejó en los cambios de la CPUE, ya que el CV intraanual de la CPUE (49.9%) fue mayor que el CV interanual de la CPUE (43.0%).
Nicho ecológico de la samasa
Usando el método INLA se definió el nicho ecológico de la samasa (Tabla 1) en función de la temperatura superficial del mar (TSM) entre 18.15 °C y 21.56 °C (Figura 7a); en relación con la salinidad superficial del mar (SSM) el nicho se encontró entre 34.915 y 35.070 (Figura 7b); en función de la concentración de oxígeno disuelto en la superficie del mar (OSM) se halló sobre 8.02 mg·l-1 (Figura 7c) y, finalmente, respecto a la CLA se encontró sobre 8.59 mg·m-3 (Figura 7d).
Las relaciones entre la CPUE y los factores ambientales fueron no lineales, acorde con la ley de tolerancia de Shelford (1931), que establece que los organismos presentan un óptimo a lo largo de factores ambientales. En el caso de la temperatura se encontró un patrón parabólico (Figura 7a), en el caso de la salinidad un patrón asimétrico negativo (Figura 7b) y en el caso del oxígeno (Figura 7c) y la clorofila (Figura 7d) la CPUE disminuyó por debajo de un umbral. Cabe señalar que a mayores concentraciones de clorofila, indicador “proxy” de las presas zooplanctónicas de la samasa, se encontró una disminución de la CPUE, lo que podría deberse a temperaturas por debajo del nicho térmico de la samasa.
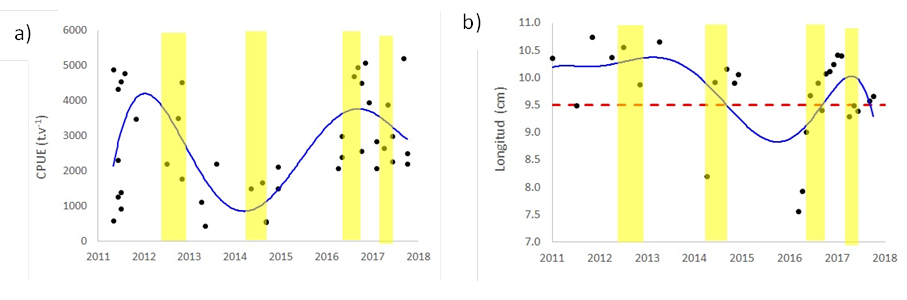
Figura 3 Variación interanual de (a) CPUE y (b) longitud (puntos); y tendencia suavizada (línea azul), períodos cálidos según el ITCP (áreas amarillas) y talla comercial (línea punteada roja).
Factores limitantes del nicho ecológico
Con el fin de identificar los factores más limitantes del nicho ecológico de A. nasus en las áreas de pesca de Pisco, se calculó el porcentaje de frecuencia en que las condiciones ambientales se encontraban fuera del rango óptimo de cada variable (Tabla 1). Se encontró que el oxígeno superficial fue el factor más limitante (FL = 85%), seguido de la clorofila (FL = 68%), la salinidad superficial (FL = 62%) y la temperatura superficial fue el factor menos limitante (FL = 46%).
Las altas temperaturas y bajas salinidades se encontraron dentro del nicho ecológico, ofreciendo un ambiente adecuado para la samasa; en cambio, fueron frecuentes bajos valores de clorofila a y oxígeno, lo que limitó la CPUE de la samasa.
Tabla 1 Nicho ecológico de la samasa y frecuencia limitante (FL) para diferentes variables ambientales.
| Variable | Límite inferior | Límite superior | FL (%) |
|---|---|---|---|
| TSM | 18.15 °C | 21.56 °C | 46 |
| SSM | 34.915 | 35.070 | 62 |
| OSM | 8.02 mg·l-1 | 85 | |
| CLA | 8.59 mg·m-3 | 68 |
Discusión
Los organismos se pueden clasificar de acuerdo con la ubicación de su nicho ecológico, sensu Hutchinson (1944), a lo largo de gradientes ambientales. Por tal motivo, es importante comparar el nicho ecológico de la samasa con respecto a otros peces, en particular la anchoveta, con la que se ha encontrado una relación inversa con la samasa (Bouchon, 2007). Según la temperatura, los organismos se clasifican en: psicrófilos (-5 °C a 15 °C), mesófilos (15 °C a 45 °C), termófilos (45 °C a 80 °C) e hipertermófilos (> 80 °C) (Vieille & Zeikis, 2001), ubicándose la samasa en el rango mesófilo (Figura 8a). Cabe señalar que se encontraron altos valores de la CPUE de samasa durante algunos períodos cálidos (2012, 2016) de acuerdo a la clasificación del ITCP (Quispe-Ccallauri et al., 2018).
Según la salinidad, los organismos pueden ser: dulceacuícolas (< 0.5), oligohalinos (0.5 a 5), mesohalinos (5 a 18), polihalinos (18 a 30), eurihalinos o marinos (30 a 40) e hipersalinos (> 40) (Mitsch & Gosselink, 1993), encontrándose la samasa en el rango marino (Figura 8b).
De acuerdo con su adaptación a los niveles de oxígeno los organismos se pueden clasificar en: hipóxicos (< 2.8 mg·l-1) y normóxicos (> 2.8 mg·l-1) (Diaz & Rosenberg 1995), siendo la samasa una especie normóxica (Figura 8c).
Según la concentración de clorofila a, los organismos pueden ser: ultraoligotróficos (< 2.5 mg·m-3), oligotróficos (2.5 mg·m-3 a 8 mg·m-3), mesotróficos (8 mg·m-3 a 25 mg·m-3), eutróficos (25 mg·m-3 a 75 mg·m-3) y e hipereutróficos (> 75 mg·m-3) (Moreno et al., 2010), encontrándose el nicho ecológico de la samasa en el rango mesotrófico (Figura 8d).
En el caso de los peces, las especies tienen diferentes rangos a lo largo de las escalas de variables ambientales, por lo que es importante conocer qué especies se encuentran en niveles mayores, menores o traslapan con A. nasus a lo largo de las diferentes variables ambientales.
Con relación a la temperatura y la salinidad, Reid (1966, citado por Martos et al., 2005), afirma que la especie Engraulis anchoita se encuentra en zonas cercanas a la costa del Atlántico sudoccidental y pueden habitar en lugares cercanos a los estuarios, con temperaturas en el rango de 12 °C a 16.5 °C en nivel superficial; también refiere que los cardúmenes se encontraron entre salinidades superficiales dentro del rango de 15.3 a 23.0. Luján (2016) afirma que el nicho ecológico de la especie E. ringens, que se distribuye en zonas cercanas a la costa del Pacífico sudoriental, se ubicó en rangos de temperatura superficial que oscilaron entre 12.57 °C a 22.9 °C, y en salinidades superficiales que presentaron un rango de 34.01 a 35.31. Zuta et al. (1983) indican que en el Perú los cardúmenes de Sardinops sagax habitan en aguas con rangos de temperaturas de 17 °C a 25 °C y salinidades de 34.8 a 35.2, y en el trabajo de la Corporación de Fomento de la Producción (CORFO, 1980, citado por Serra & Tsukayama, 1988) indica que frente a la costa de Chile los ejemplares adultos de S. sagax se movilizan en aguas con temperaturas superficiales de 16 °C a 23 °C y entre salinidades de 34.8 a 35.1. Por otra parte, Peterson (1956) indica que la Anchoa panamensis fue encontrada sólo en la parte norte del Golfo, una región que generalmente presenta salinidad más baja que el resto del golfo. Ayala-Pérez et al. (1997) aseguran que Anchoa mitchilli es un pez marino que se desplaza y se adapta en estuarios; se ha encontrado a salinidades que oscilan de 20.4 a 26.3, es decir, tolera aguas salobres. Chirichigno & Cornejo (2001) reportan a la samasa como especie pelágica costera y estuarina. En el presente estudio, la samasa se encontró en bajas salinidades de hasta 34.7, sin embargo con baja CPUE.
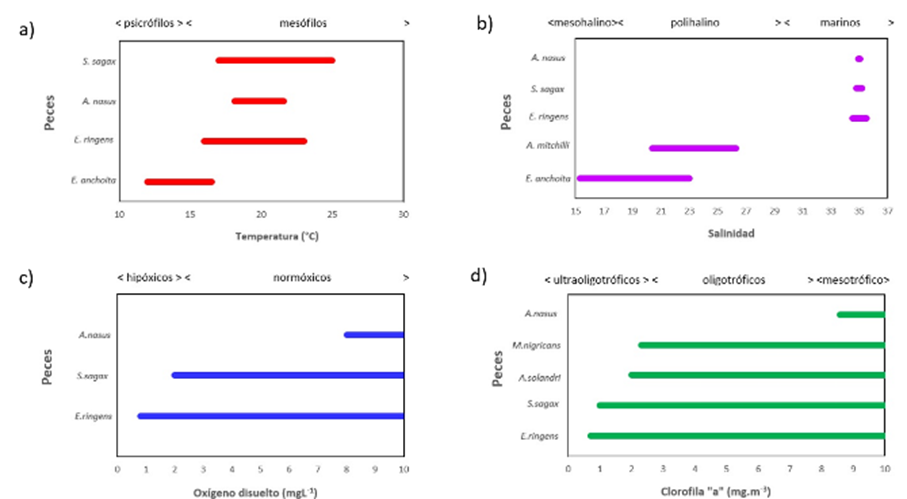
Figura 8 Comparación entre el nicho ecológico de la samasa y otros peces según (a) temperatura, (b) salinidad, (c) oxígeno disuelto y (d) clorofila a.
Los peces muestran diferentes tipos de tolerancia a las variaciones que se presentan en las concentraciones de oxígeno disuelto que hay en el mar. Jordán & Chirinos (1965) indican que E. ringens es un pez que podría llegar a ingresar en áreas con valores de oxígeno disuelto menores a 0.5 mg·l-1. Por otro lado, Bertrand et al. (2011) encontraron que la anchoveta era más abundante cuando el oxígeno era menor a 4.5 ml.l-1. Serra & Tsukayama (1988) precisan que, en zonas adyacentes a la costa de Chile, la especie S. sagax se encuentra a partir de 2.86 mg·l-1 de oxígeno disuelto; mientras que Bertrand et al. (2011) indican que la sardina muestra efectos negativos bajo 3.8 ml.l-1. En comparación a la anchoveta, la samasa ocuparía un nicho ecológico con requerimientos más cálidos y oxigenados.
La distribución superficial de la clorofila a en el mar frente a la costa peruana, se caracteriza por presentar concentraciones altas, y se considera que es uno de los mares más productivos del mundo (Pennington et al., 2006). Se observa que los mayores valores de A. nasus en la zona de estudio se asocia a concentraciones elevadas de clorofila a, lo que podría darse debido a la cercanía que hay con los afloramientos costeros que se dan en Pisco. Luján (2016) indica que en el Pacífico sudoriental E. ringens se desplaza a partir de concentraciones mínimas de clorofila a de 0.44 mg·m-3 y entre concentraciones máximas que alcanzan los 37.15 mg·m-3. La presencia conjunta de anchoveta y samasa es baja (0.62%), y sus capturas presentan una relación inversa (SNP, 2017). Barber & Chávez (1983) señalan que antes de El Niño 1982-83 frente a la costa del Perú, la especie S. sagax se encontró en zonas donde las concentraciones de clorofila a presentaban valores superiores a 1 µg·l-1. Martínez (2012) investigando las capturas incidentales de pelágicos mayores, determinó probabilidades de ocurrencia de especies en ambientes oceánicos y encontró que el pez Acanthocybium solandri (pez sierra) estuvo presente en zonas con valores mayores a 2 mg·m-3 durante eventos La Niña. Por otro lado, en ambientes costeros la especie Makaira nigricans (pez aguja azul) se presentó a concentraciones mayores de 2 mg·m-3.
Respecto a los factores limitantes, Luján (2016) hizo un análisis de los stocks de anchoveta E. ringens en el Pacífico sudoriental (PSO) y encontró que para el stock del norte los factores más limitantes fueron la concentración de clorofila a seguida por la temperatura, para el stock centro, fueron la concentración de clorofila a seguida por la profundidad de la oxiclina, y finalmente para el stock sur fueron la profundidad de la oxiclina seguida por la concentración de clorofila a. Los resultados para el stock sur coinciden con el presente estudio, donde el oxígeno y la clorofila fueron los factores más limitantes en la bahía de Pisco.
El análisis de las frecuencias limitantes mostró que los factores temperatura y salinidad fueron menos limitantes, ya que el 46% y 62% de los valores ambientales de ambos parámetros, respectivamente, estuvieron fuera de los límites óptimos del nicho ecológico de la samasa. Esto apoya la afirmación de Bouchon (2007) de que durante el Niño 1997-98 la samasa amplió su distribución a toda la costa peruana, probablemente por el aumento de oxígeno, que es un factor limitante en la bahía de Pisco.
Para futuros trabajos, se recomienda considerar otros factores ambientales, como el zooplancton y el pH, además se deben recopilar datos espaciales de toda la distribución de la samasa, analizar series de tiempo de largo plazo (> 10 años) para abarcar otros escenarios ambientales y realizar pronósticos de la abundancia de la samasa basados en proyecciones de los factores ambientales, y llevar a cabo experimentos ecofisiológicos bajo condiciones controladas.
Conclusiones
El nicho ecológico de la samasa se ubicó en condiciones mesófilas (18.15 °C - 21.56 °C), marinas (34.915 - 35.070), normóxicas (>8.02 mg.L-1) y mesotróficas (>8.59 mg.m-3), apoyando la hipótesis planteada.
Durante el periodo de estudio se observó que las condiciones oceanográficas presentaron variaciones estacionales mayores a las variaciones interanuales; lo que coincide con una mayor variabilidad estacional de la CPUE (CV = 49.9%).
Entre las variables oceanográficas, el factor más limitante del nicho ecológico de Anchoa nasus fue el oxígeno (FL = 85%).
En general, se puede concluir que en la zona centro-norte de la bahía de Pisco, las temperaturas, salinidades y clorofila a se encuentran frecuentemente dentro del nicho ecológico de la samasa; sin embargo, el oxígeno es limitante y más favorable durante eventos de calentamiento, como El Niño.












 uBio
uBio