Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Medicina Experimental y Salud Publica
versión impresa ISSN 1726-4634
Rev. perú. med. exp. salud publica v.1 n.3-4 Lima dic. 1942
TÉCNICA DE LABORATORIO
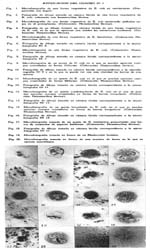
Métodos de diagnostico microscópico de la amebiasis Víctor M. Ayulo Robles1 1 Departamento de Bacteriología e Inmunología. Instituto Nacional de Higiene y Salud Pública. Los diagnósticos de laboratorio sobre la infección amebiana en nuestro país no son del todo satisfactorios debido, principalmente, a la falta de personal entrenado cuidadosamente en esta clase de trabajo. Si esta falta de personal entrenado se hace ostensible en países como Estados Unidos, según lo ponen de manifiesto Wilfred H. Kellog y Elizabeth A. Scott, en su artículo titulado: The laboratory diagnosis of amebiasis y como lo expresa también Dobell, se hace mucho más ostensible entre nosotros, ya que, se ve con gran frecuencia hacer diagnósticos de Entamoeba histolytica frente a una deposición muco sanguinolenta proveniente de un síndrome disenteriforme, en el que, en realidad el agente causal no es la Entamoeba histolytica, sino un bacilo disentérico o una salmonella. Ahora bien, ¿los cuadros de disentería producidos por la Entamoeba histolytica son frecuentes entre nosotros? La pregunta que nos formulamos, hace tres años ha servido de pauta a este trabajo, que tiene como única finalidad, la de poder dar a quienes se interesen, ciertos datos que creemos son de gran utilidad para llegar a un diagnóstico seguro. Muchas veces en una muestra de heces se encuentran parásitos que por una u otra razón, no es posible identificar en fresco; en estos casos, más vale no emitir concepto que aventurarse a darle un nombre al azar. Si una muestra de heces es dudosa, debe practicarse un nuevo examen sobre una segunda, y si es posible sobre una tercera muestra, para ratificar o rectificar el resultado del primer examen. El hecho de que una muestra sea negativa, no nos autoriza para asegurar que el sujeto no es portador de parásitos, ya que muchos de éstos aparecen en las heces en ciclos irregulares, en consecuencia, una muestra negativa en un primer examen, puede ser positiva en el segundo o tercero, por lo cual, es recomendable cuando se sospecha la existencia de parásitos intestinales en un sujeto, practicar exámenes periódicos. El examen en fresco debe ser completado con el examen por coloración, por cuanto éste nos permitirá llegar a la identificación de varios protozoos intestinales, por el reconocimiento de sus diferentes estructuras citológicas. Si en el examen en fresco hubo una duda sobre si se trata de tal o cual parásito, el examen por coloración nos permitirá, establecer el diagnóstico seguro del parásito en cuestión. Al lado del examen en fresco y por coloración, el cultivo presta gran ayuda en la identificación de ciertos parásitos, porque como pueden ser estos muy escasos, al no ser vistos en el examen en fresco, lo mismo que en el examen por coloración, encontrándose en condiciones óptimas en el medio de cultivo, desarrollan y permiten su identificación. EXAMEN DIRECTO A. COLECCIÓN DE MUESTRAS Y OPORTUNIDAD DE EXAMEN Se ha dicho y discutido mucho sobre la vitalidad de la Entamoeba histolytica, considerándosela tan frágil, que algunos autores recomiendan practicar el examen de heces, si es posible a la cabecera del lecho del paciente. En realidad, los estudios realizados por diversos investigadores y por nosotros, sobre la viabilidad de la Entamoeba histolytica y de la Entamoeba coli, nos permiten afirmar que es innecesario realizar el examen de la muestra de heces en estas condiciones, ya que, se puede llegar al diagnóstico de estos protozoos, algunas horas después de emitidas las materias fecales. De acuerdo con lo expuesto anteriormente, recomendarnos practicar el examen de la muestra de heces dentro de las cinco primeras horas que han seguido a su emisión, lo que no descarta de ningún modo, la posibilidad de realizar este examen en un lapso de tiempo más corto. Si insistimos en el hecho de que tal examen pueda llevarse a cabo satisfactoriamente algunas horas después, es porque en nuestro medio se ha arraigado el criterio de la poca vitalidad en el exterior de la Entamoeba histolytica, prejuicio que nos parece necesario desterrar, para evitar ya sea la penosa tarea del laboratorista, de tener que transportar su material de observación a casa del paciente, o la no menos desagradable del paciente de trasladarse al laboratorio para que en él pueda practicarse el examen. Recomendamos que la muestra recién emitida sea colocada en una caja de cartón parafinado que reúne de un lado, la ventaja de su fácil transporte, y de otro, la de su impermeabilidad. A falta de ella, la muestra puede ser remitida al laboratorio en cualquier vasija o recipiente apropiado. B y C. MATERIAL NECESARIO PARA EL EXAMEN DE HECES Y MÉTODO A SEGUIR El material con que debe contar el laboratorista se reduce a: a) Láminas portaobjetos; b) Laminillas cubreobjetos, las que deben ser como condición indispensable, transparentes y limpias; c) Suero fisiológico al 8.5 p. 1000; d) Solución de lugol; e) Mondadientes con un extremo aplanado. Frente a una muestra de heces por examinar, se procede de la siguiente manera: 1º. Sobre una lámina portaobjetos, se coloca una gota de suero fisiológico y otra de lugol; 2º. Con un palito mondadientes se toma una pequeña porción de la muestra y se hace una emulsión, primero en la gota de suero fisiológico y después en la de lugol. Es necesario que las emulsiones sean lo suficientemente delgadas, como para permitir un buen examen, porque de lo contrario se tropieza con graves dificultades. Hechas las emulsiones, se coloca encima de cada una, una laminilla cubre-objetos y se procede a examinar: primero, la preparación en suero fisiológico, y después la preparación en lugol. La preparación con suero fisiológico debe ser examinada minuciosamente, por lo menos unos 10 minutos y ella nos permitirá percatarnos de la existencia o ausencia de formas vegetativas o quísticas de los diferentes tipos de amebas, de la presencia de leucocitos, macrófagos, blastocystis, todos los cuales tienen importancia en el diagnóstico. (1) Practicado el examen en la preparación con suero fisiológico, se procede al examen de la preparación en lugol, examen que, como el anterior, debe ser realizado con suma prolijidad, desde que éste nos permitirá apreciar ciertas estructuras, sobre todo en lo que se refiere al núcleo y que son de la mayor importancia en el diagnóstico. D. DIAGNOSTICO DIFERENCIAL DE LOS DISTINTOS TIPOS DE AMEBAS Y QUISTES Si en la preparación con suero fisiológico notamos la presencia de formas vegetativas de amebas, nos haremos inmediatamente la pregunta: ¿Frente a qué tipo de ameba nos encontramos? ¿Es Entamoeba histolytica o es Entamoeba coli? Para resolver esta pregunta, debemos pasar revista a una serie de caracteres que nos permitirán llegar al diagnóstico del tipo de ameba, como son: el tamaño, movilidad, protoplasma, pseudópodos, núcleo. 1. Tamaño. La forma vegetativa de la Entamoeba histolytica tiene por lo general, de 18 a 25 micras de diámetro, pudiendo variar sus dimensiones entre 15 y 40 micras. Dobell y muchos otros autores han señalado que, son distintos tipos o razas de este parásito, los que producen grandes o pequeños quistes, y que, estas razas difieren también en su forma vegetativa. La Entamoeba coli en su forma vegetativa, por lo general tiene de 20 a 25 micras, pudiendo variar su dimensión entre 15 y 40 micras. De tal manera que, el factor tamaño no nos permite en ningún caso establecer un diagnóstico diferencial entre la Entamoeba histolytica y la Entamoeba coli. 2. Movilidad. Brumpt, Craig, Wenyon, Faustus y muchos otros, consideran que mientras la forma vegetativa de la Entamoeba histolytica es muy móvil, la forma vegetativa de la Entamoeba coli, o no progresa, o lo hace lentamente en una dirección definida. De otro lado, E. A. Pavlova trabajando con cultivos y heces frescas, ha hecho una observación comparativa sobre la locomoción de la Entamoeba histolytica y de la coli, bajo varias condiciones, con el objeto de ver si la locomoción puede servir como diagnóstico diferencial entre estas dos especies. Encontró que, la mayor movilidad la presentan ambas, cuando el Ph es de 6.5; del mismo modo que, presentan una mayor movilidad a temperatura del cuerpo que a temperatura del laboratorio. Ninguno de los dos tipos de Entamoeba, Histolytica o Coli, cuando fueron recientemente aislados o vistos en cultivos a 37ºC, mostraron una marcada diferenciación entre ecto y endoplasma, teniendo lugar la locomoción en ambos sin la formación de pseudópodos hialinos, pseudópodos que dichas especies producen algún tiempo después de aisladas. La Entamoeba histolytica retiene su movilidad y pseudópodos por un período de tiempo más largo que la Entamoeba coli, a causa de lo cual, la formación de estas excrecencias ectoplásmicas son comúnmente atribuidas a la Entamoeba histolytica. Pavlova considera que, la importancia de los pseudópodos ectoplásmicos en el diagnóstico diferencial, es solamente relativa y que puede ser usado solo en conjunción con otros caracteres. En realidad, considerar la movilidad como factor básico para establecer un diagnóstico diferencial, no nos parece acertado, ya que, tanto una como otra, poseen caracteres muy similares. Nosotros hemos tenido oportunidad de ver, formas vegetativas de Entamoeba coli móviles, algunas horas después de emitidas las materias fecales. De otro lado, en las formas vegetativas de Entamoeba coli en cultivos de 24 y 48 horas de desarrollo, hemos podido apreciar una movilidad igual a la que presentan las formas vegetativas de Entamoeba histolytica, en cultivos de igual tiempo de desarrollo. Cuando las muestras de heces son viejas, las formas vegetativas de la Entamoeba histolytica presentan una movilidad muy reducida, fenómeno que es igualmente apreciable en las formas vegetativas de la Entamoeba coli. 3. Protoplasma. La mayor parte de los autores consideran que en las formas vegetativas de la Entamoeba histolytica se pueden apreciar perfectamente dos elementos: ectoplasma y endoplasma. El ectoplasma es claro, de aspecto vidrioso, especialmente cuando el organismo está en movimiento, mientras que, el endoplasma es más granuloso y muy refringente en su estructura, pudiendo contener glóbulos rojos, no así bacterias ni vacuolas, presentándose estas últimas solo en las formas degeneradas. En cambio, en la Entamoeba coli, el citoplasma aparece descolorido y más refringente que en el de la Entamoeba histolytica; el endoplasma es de apariencia granulosa, presentando vacuolas, las que pueden contener bacterias, cristales, células vegetales y otros materiales, más no glóbulos rojos. Tanto la Entamoeba histolytica como la Entamoeba coli, según lo hemos podido observar, presentan ecto y endoplasma perfectamente visible (Fig. Nº 1) Por lo tanto, considerar que la Entamoeba coli no presenta ectoplasma bien diferenciado, o que éste, es muy poco visible, nos parece demasiado radical, ya que en una como en la otra, la formación de pseudópodos se debe al ectoplasma, y, al hablar de la movilidad, insistimos en el hecho de que son igualmente móviles, pudiendo notarse en las formas en movimiento de la Entamoeba coli, la presencia de un ectoplasma hialino, semejante al que presentan las formas móviles de la Entamoeba histolytica,. (Fig. Nº 1 y 2). El endoplasma sí presenta caracteres que deben ser tomados muy en cuenta. Mientras que en la Entamoeba histolytica el endoplasma es granuloso, fino, en la Entamoeba coli es muy vacuolado, dando el aspecto de una verdadera esponja, carácter éste de gran importancia y que llama la atención desde el primer momento. De otro lado, se insiste en el hecho de que las formas vegetativas de la Entamoeba histolytica pueden contener glóbulos rojos, mientras que las de la E. coli no, tomándose en consecuencia la presencia o ausencia de glóbulos rojos en el protoplasma de la ameba como un carácter fundamental de diferenciación. Pero, los trabajos de Dobell (1936) quien demostró la ingestión de glóbulos rojos in vitro, por ciertas razas de Entamoeba coli, las cuales desarrollaban en cultivo, ha puesto en duda la veracidad de este fenómeno como un carácter de diagnóstico distintivo. Ya Lynch (1934) había considerado a la Entamoeba coli con capacidad para la ingestión de glóbulos rojos, pero las opiniones ofrecidas por él, no fueron lo suficientemente concluyentes para dejar este hecho establecido. Si bien es cierto que la ingestión de glóbulos rojos por la Entamoeba coli en los tubos de cultivo, como lo demostrara Dobell, constituyen un hecho sugestivo, no podía ser tomado como definitivo, en vista de que el comportamiento de los micro-organismos in vitro, es muy diferente al que presentan in vivo, por lo tanto, se requería una confirmación más fehaciente de este hecho, que lo encontramos en los trabajos de Ernest E. Tizzer (1938) quien en un caso de obstrucción intestinal, que presentara una deposición muco-sanguinolenta, pudo observar la presencia de amebas, las cuales habían ingerido glóbulos rojos. El estudio detenido del parásito, su desarrollo en los medios de cultivo, las inoculaciones en animales, etc., permitieron demostrar que se trataba de una Entamoeba coli y no de una Entamoeba histolytica, como pudo haberse pensado. De lo cual se desprende que la presencia de glóbulos rojos en el interior de una ameba, no nos autoriza para etiquetarla como histolytica, sin antes haber hecho un estudio morfológico detenido, puesto que ambas son capaces de ingerir glóbulos rojos. (Fig. Nº 3). 4. Pseudópodos. Se afirma que mientras en la Entamoeba histolytica los pseudópodos formados rápidamente por el ectoplasma pueden ser largos, en forma de dedos de guante, o cortos, después de lo cual el endoplasma progresa dentro de él, realizándose en esta forma el movimiento del parásito, en la Entamoeba coli los pseudópodos se forman lentamente, siendo a menudo retirados sin que la ameba se haya trasladado. Tal aseveración no nos parece ser incuestionable, puesto que una y otra, emiten pseudópodos rápidamente, los que se forman merced al ectoplasma hialino. En ambas especies, una vez formado el pseudópodo, el endoplasma granuloso se desplaza en su interior para volver a emitir otro pseudópodo, realizándose en esa forma el movimiento del parásito. (Fig. Nº 1 y 2). 5. Núcleo. En las preparaciones con suero fisiológico, usualmente el núcleo, tanto de la Entamoeba histolytica como el de la Entamoeba coli es invisible, pero algunas veces no obstante, puede ser visto en la E. histolytica como un anillo formado por pequeños gránulos muy refringentes con kariosoma central, mientras que en la Entamoeba coli el anillo se presenta formado por gruesos gránulos muy refringentes con kariosoma excéntrico. Es la preparación con lugol la que nos permite en fresco hacer un estudio más detallado acerca del núcleo. En la Entamoeba histolytica (preparación con lugol) se aprecia el núcleo como un fino anillo formado por pequeños gránulos muy refringentes de color amarillo canario, presentando un kariosoma también refringente en posición central o subcentral. En la Entamoeba coli, el núcleo se presenta igualmente como un anillo, pero formado por gruesos gránulos de cromatina, presentando un kariosoma grueso, la mayor parte de las veces excéntrico. Debemos tener presente que en ciertas ocasiones el kariosoma en la Entamoeba coli se presenta en posición sub-central y hasta central. En estos casos el examen en fresco no nos permite llegar a un diagnóstico, siendo necesario recurrir al examen por coloración. Formas prequísticas. Así en la Entamoeba histolytica como en la Entamoeba coli, la forma pre-quística es un estadío de transición entre la forma vegetativa y la forma quística, afectando una forma redonda o ligeramente ovoide, por lo general carente de movimiento o presentando la emisión de pequeños pseudópodos. La forma pre-quística presenta un solo núcleo que tiene las características propias del tipo a que pertenece. Algunas veces se encuentran cuerpos cromidiales en el interior del endoplasma, semejantes a los que presentan los quistes. En estas formas el diagnóstico diferencial se basa en el núcleo, cuyos caracteres hemos señalado anteriormente. Quistes. En las preparaciones con suero fisiológico los quistes de la Entamoeba histolytica se presentan de forma redondeada, muy refringentes, pudiendo su tamaño variar según la raza o tipo de este parásito. Puede notarse también la presencia de cuerpos cromidiales, sobre todo en los quistes inmaduros uni y bi-nucleados. Los cuerpos cromidiales se presentan como barras de bordes netos, muy refringentes, siendo su número variable. Es en la preparación con lugol, en la que se pueden apreciar nítidamente los núcleos, con los caracteres que señalamos anteriormente para las formas vegetativas, debiéndose indicar que en los quistes cuadrinucleados, los núcleos son más pequeños y por lo tanto, difíciles de diferenciar. Las masas de glicógeno que generalmente se presentan en los quistes inmaduros, uni y bi-nucleados, se aprecian de color bruno. Los quistes de Entamoeba coli se presentan unas veces de forma esférica, otras de forma oval, pudiendo afectar las formas más caprichosas. Otro tanto podemos decir en lo que se refiere al tamaño, pues, al lado de quistes pequeños pueden encontrarse otros de mayores dimensiones. En las preparaciones con suero fisiológico, es posible apreciar la presencia de cuerpos cromidiales en los quistes inmaduros de 1 a 4 núcleos, los que afectan formas filiformes, en bastón, o barras gruesas de bordes dentellados. (Su estudio en detalle lo haremos al ocuparnos del capitulo de coloración). En las preparaciones con lugol se pueden apreciar nítidamente los núcleos, que generalmente son 8, pudiendo encontrarse quistes con 16 ó 32. Los núcleos presentan caracteres semejantes a los de las formas vegetativas, teniendo presente que en los quistes con gran número de núcleos, éstos son más pequeños y por lo tanto más difíciles de diferenciar. En los quistes inmaduros, generalmente de 1 a 4 núcleos se puede distinguir las masas de glicógeno teñidas de un color bruno a causa del yodo. Si en la muestra en fresco se constata la presencia de quistes con 2 ó 4 núcleos, el examen deberá ser muy meticuloso, porque de lo contrario se puede cometer un grave error, diagnosticándose quistes de coli cuando se trata de histolytica o viceversa. E. DIAGNOSTICO DIFERENCIAL CON LOS LEUCOCITOS, MACROFAGOS Y BLASTOCYSTIS No es infrecuente observar muestras de heces muco-sanguinolentas, en las que se nota la presencia de macrófagos y leucocitos en abundancia, y acerca de las que con relativa frecuencia se hace el diagnóstico de amebas, error muy lamentable por cierto debido generalmente a la falta de experiencia del laboratorista. Si en las formas vegetativas de amebas es posible ver (preparaciones con lugol) un núcleo con nucleolo central (histolytica) o excéntrico (coli), en los macrófagos o leucocitos se aprecia este elemento con las características propias del tipo a que pertenece: núcleo voluminoso en los macrófagos o dividido en segmentos en los polinucleares, sin que pueda apreciarse en ninguno de estos tipos el núcleo en rueda que presentan las amebas. (Fig. Nº 20). Otro elemento que frecuentemente se presta a confusión, sobre todo con las formas quísticas es el Blastocystis hominis (Brumpt). El Blastocystis hominis se presenta en las heces, bajo la forma de elementos globosos, de un diámetro que varía entre 2 a 15 micras, formado por una cápsula incolora, mucilaginosa, más o menos espesa, según los casos, presentando una gran vacuola central que no se colorea con el yodo y posee uno o muchos núcleos con grueso kariosoma. (Fig. Nº 19). En los medios usuales de cultivo para amebas o flagelados intestinales, los Blastocystis desarrollan con gran facilidad, adquiriendo formas variadas, que semejan muchas veces amebas en división. En los cultivos también pueden encontrarse Blastocystis de 30 a 35 micras de diámetro. Entre nosotros el 75.39% de las muestras de heces presentan Blastocystis de donde se desprende la gran importancia que tiene su reconocimiento para establecer un diagnóstico diferencial. DIAGNOSTICO POR COLORACIÓN A. MÉTODO EMPLEADO Como técnica de coloración, hemos empleado la hematoxilina férrica de Heidenhain. Material: Sol. satur. de bicloruro de Hg: 2 vol. Se mezclan dos volúmenes de una solución saturada de bicloruro de mercurio y un volumen de alcohol de 95º. Esta mezcla puede guardarse como stock, adicionándosele en el momento de usar, ácido acético glacial en la proporción de 5 c.c. para 95 c.c. de mezcla. Mordiente: Alumbre de hierro: 4 grs. Para preparar la solución de alumbre de hierro (sulfato doble de amonio y sesquióxido de fierro) es indispensable emplear los cristales de color violeta claro, no debiéndose usar cristales pequeños o alumbre de hierro en polvo, sino, cristales grandes que se conservan perfectamente en bocales de boca ancha. En el momento de hacer la solución, se pulveriza en un mortero la cantidad necesaria, obteniéndose así la disolución inmediata; el líquido resultante debe ser absolutamente limpio. (Esta solución debe ser hecha en frío). La preparación de grandes cantidades resulta inoficiosa por no conservarse bien. Colorante: Sol. alcoh. de. hematox. al 10 x 100: 10 c.c. Agua destilada: 90 c.c. Se obtiene preparando una solución de hematoxilina al 10 x 100 en alcohol de 90°, de la cual se toman 10 c.c. y se le agrega 90 c.c. de agua destilada. La solución de hematoxilina así preparada, se le coloca en un frasco de color obscuro, guardándola al abrigo de la luz. (Cuanto más tiempo tenga la solución de hematoxilina tanto mejor). TÉCNICA DE COLORACIÓN 1º Extensión. Lo primero que deberá hacerse es extender la muestra, para lo cual, si ésta es pastosa, se procede de la siguiente manera: Se pone una buena cantidad sobre una lámina y se la emulsifica con suero fisiológico. De allí se saca un poco que se extiende sobre otra lámina o laminilla. Esta última tiene la ventaja del fácil manipuleo y del empleo de pequeñas cantidades de reactivos, lo que ha servido para que su uso se haya generalizado mucho, en EE.UU. y sobre todo en Inglaterra. La extensión se hace valiéndose de una pinza curva teniendo cuidado que sea delgada y uniforme. Si la muestra es mucosa, muco-sanguinolenta o liquida, se procede directamente a hacer la extensión con la pinza curva mencionada. 2º Fijación. Hecha la extensión sobre la laminilla, ésta se coloca de tal manera que el frotís flote sobre el fijador (líquido de Schaudinn) durante un minuto, luego se la invierte permaneciendo en el fijador por espacio de 10 minutos. 3º Alcohol de 50°: 10 minutos. 4º Alcohol de 70°: 12 horas. (El alcohol de 70º se lo emplea como conservador, pudiendo dejarse en él las laminillas un tiempo más largo. 5º Hidratación: Alcohol de 50º: 5 minutos 6º Mordiente. Se colocan las preparaciones en alumbre de hierro al 4 x 100 durante 24 horas. 7º Lavar con agua destilada de 1 a 2 minutos. 8º Colorear en la solución de hematoxilina férrica durante 24 horas. 9º Lavar con agua destilada de 2 a 5 minutos. 10º Diferenciación. La diferenciación se hace con una solución de alumbre de hierro, diferente de la que sirvió para mordiente. La concentración puede ser la misma o más débil, al 2 x 100. La diferenciación se deberá hacer con control microscópico, pudiendo éste variar dentro de límites muy amplios según las partes que se quieran poner en evidencia. Esta es la gran ventaja del método de Heidenhain. El, permite al observador poder diferenciar los más finos detalles citológicos, pero expone al inexperto a graves errores de interpretación. En efecto, los resultados obtenidos varían según la duración de la coloración y de la diferenciación, lo que habrá de tenerse muy presente para no sacar conclusiones erróneas de una diferenciación incompleta o muy prolongada, por eso, en una misma preparación no todos los núcleos tendrán la misma coloración; unos estarán muy diferenciados y los otros poco. En una preparación bien hecha, las estructuras celulares resaltan en negro intenso sobre un fondo incoloro o poco coloreado. La coloración es muy enérgica y precisa. 11º Lavar en agua de caño a chorro continuo 10 a 15 minutos. 12º Deshidratación: Alcohol de 10º: 5 minutos 13 Xilol: 10 minutos 14º Montaje. En bálsamo de Canadá o en resina de Damar. El método de coloración por medio de la hematoxilina férrica de Heidenhain, es el más importante entre todas las técnicas citológicas para la coloración de protozoos en frotís. Parece haber reemplazado todos los métodos con colorantes derivados de la anilina, porque dan resultados menos estables. B. DIAGNOSTICO DIFERENCIAL ENTRE LOS DIFERENTES TIPOS DE AMEBAS Citoplasma. El citoplasma en la forma vegetativa de la Entamoeba histolytica se presenta de un color plomizo, de aspecto finamente granuloso, libre de bacterias, pudiendo contener glóbulos rojos, los que se presentan de un color negro (Fig. Nº 5 y 6), pero cuando en este parásito se han producido fenómenos degenerativos, el citoplasma se torna vacuolado, pudiendo ser confundido con otras especies existentes en el intestino humano. En la Entamoeba coli el protoplasma normalmente presenta gran cantidad de vacuolas y bacterias Nº 2 y 4) no siendo extraño encontrar incluso glóbulos rojos, como lo expusimos en el capítulo anterior. (Fig. Nº 3). Núcleo. Membrana nuclear. Esta, en la forma vegetativa de la Entamoeba histolytica se aprecia como un fino anillo de color negro intenso, presentando sobre su cara interna pequeños y numerosos gránulos de cromatina intensamente teñidos (de negro) y regularmente dispuestos. (Fig. Nº 5 y 6). En la Entamoeba coli es gruesa, de color negro intenso, presentando en su cara interna gruesas y poco numerosas masas de cromatina intensamente teñidas y dispuestas de manera irregular. (Fig. Nº 3, 4, 7 y 8). Kariosoma. En tanto que en la Entamoeba histolytica se vé como un pequeño punto de cromatina teñido de negro, ocupando una posición central o sub-central en el núcleo, en la Entamoeba coli se presenta como un grueso punto de color negro, ocupando una posición la mayor parte de las veces excéntricas con respecto al núcleo. Entre el kariosoma y la membrana nuclear en la Entamoeba histolytica muchas veces se aprecian trazas de la red de linina, a manera de finas fibrillas que semejan los radios de una rueda de carreta con el que muy bien se le ha comparado. (Fig. Nº 5 y 6). En la Entamoeba coli, entre el kariosoma y la membrana también se aprecian trazas de la red de linina a manera de radios, pero dando en conjunto al núcleo, el aspecto de una rueda rota. (Fig. Nº 7). Algunas veces se nota que el kariosoma en la Entamoeba coli, lejos de presentarse como hemos dicho excéntrico se presenta en posición sub-central y hasta central (Fig. Nº 3 y 4). En estos casos, los caracteres correspondientes a la membrana nuclear, que dijimos es gruesa, las masas de cromatina también gruesas y poco numerosas, y, el kariosoma voluminoso, son los que permiten hacer el diagnóstico. Formas pre-quísticas. Las formas pre-quísticas tanto de la Entamoeba histolytica como las de la Entamoeba coli, muestran caracteres semejantes a los que presentan las formas vegetativas, en lo que al protoplasma y núcleo se refiere, y, de los que no nos ocuparemos por haberlo hecho anteriormente. No es raro apreciar la presencia de cuerpos cromidiales en el citoplasma, cuyos caracteres son semejantes a los de los quistes. De dichos cuerpos nos ocuparemos detalladamente al tratar de estos últimos. Quistes. Los quistes de la Entamoeba histolytica son característicos en su morfología, presentándose el protoplasma de un color gris azulado, mientras la estructura nuclear y la de los cuerpos cromidiales se tiñen intensamente en negro. El tamaño de los quistes varía según las razas de este parásito. Generalmente son de forma esférica, pero pueden ser ovoides y rara vez de contornos irregulares. El número de núcleos varía de 1 a 4, no obstante, se han descrito casos de quistes de Entamoeba histolytica con 6 y 8 núcleos. En los quistes uni y bi-nucleados, la estructura de los núcleos es semejante a la de las formas vegetativas: membrana nuclear muy fina, con pequeños y numerosos gránulos de cromatina dispuestos regularmente, kariosoma fino en posición central o subcentral y entre éste y la membrana nuclear, delicadas fibrillas de la red de linina. En los quistes cuadrinucleados, los núcleos son más pequeños y por lo tanto difíciles de diferenciar, pero los caracteres señalados anteriormente respecto de la membrana nuclear, kariosoma, etc., ayudan enormemente en esta labor. Los quistes inmaduros y especialmente los uni y bi-nucleados, presentan cuerpos cromidiales que generalmente desaparecen en los quistes maduros. Las masas cromidiales se presentan como barras de color negro o de forma fusiforme, de extremidades redondeadas, siendo su número variable, ya que, al lado de quistes con un cuerpo cromidial, pueden haber otros con 2 ó más. (Fig. Nº 17 y 18). Los quistes de Entamoeba coli presentan un citoplasma granuloso de color gris azulado, mientras la estructura nuclear y los cuerpos cromidiales se tiñen de negro intensamente. El tamaño de los quistes es muy variable, los hay grandes y chicos. Otro tanto podemos decir de la forma, pues hay esféricos, ovales y de contornos muy irregulares. El número de núcleos por lo general varía de 1 a 8 aunque se encuentran asimismo quistes con 16 y hasta 32 núcleos. En los quistes inmaduros, la estructura de los núcleos es semejante a la de las formas vegetativas: membrana nuclear gruesa, con gruesas masas de cromatina irregularmente repartidas, kariosoma voluminoso y excéntrico y entre éste y la membrana nuclear, delicadas fibrillas de la red de linina. En los quistes binueleados, los núcleos son mas pequeños, por lo tanto difíciles de definir, pero, los caracteres señalados anteriormente respecto de la membrana nuclear, kariosoma, etc., facilitan el diagnóstico. Usualmente, los quistes inmaduros de 1 a 4 núcleos presentan cuerpos cromidiales que afectan formas filiformes, en bastón, o barras gruesas de bordes dentellados, formas muy características de esta clase de quistes y de gran importancia para el diagnóstico. El número de cuerpos cromidiales en el interior del quiste varía grandemente, pues, puede encontrarse 1 ó más. (Fig. Nº 9, 10, 11, 12, 13, 14, 15 y 16). Las masas de glicógeno que generalmente se presentan en los quistes inmaduros de 1 a 4 núcleos se aprecian como una vacuola en el citoplasma. C. DIAGNOSTICO DIFERENCIAL CON LOS LEUCOCITOS, MACRÓFAGOS Y BLASTOCYSTIS El diagnóstico diferencial entre amebas, (Histolytica o coli) leucocitos y macrófagos en las preparaciones coloreadas es sencillo: en las amebas se aprecia el núcleo con los caracteres que hemos señalado anteriormente en detalle; en los macrófagos o leucocitos, se aprecia igualmente este elemento, pero con los caracteres propios del tipo a que pertenecen, sin que sea posible en ningún caso observar el clásico núcleo en rueda, propio de la clase de amebas que es materia de este trabajo. En lo que atañe a los Blastocystis, es igualmente sencillo poder diferenciarlos, ya que se ven como elementos globosos formados por una cápsula teñida de negro, presentando de trecho en trecho en la periferia uno o varios núcleos con grueso kariosoma y una gran vacuola central. (1) En el presente trabajo solo nos limitamos a las amebas, dejando de lado los flagelados y otra clase de parásitos intestinales. BIBLIOGRAFÍA 1. WILFRED H. KELLOG, ELIZABETH A. SCOTT: American Journal of Public Health, v. 28, p. 813, 1937. 2. CHARLES F. CRAIG: Journal Parasitology, v. 22, p. 1, 1936. Citado en Tropical Diseases Bulletin, v. 34, p. 327, 1937. 3. E. A. PAVLOVA: Med. Patasit. E. Parasitic Dis Moscow, v. 7, p. 95, 1938. Citado en Tropical Diseases Bulletin, v. 36, p. 284, 1939. 4. ERNEST E. TYZZER, QUINTIN M. GEIMAN: American Journal of Hygiene, v. 28, p. 271, 1938. 5. C. DOBELL: Parasitology, v. 30, p. 195, 1938. 6. E. BRUMPT: Précis de Parasitologie, París, 5ª edición, 1936. 7. C. WENYON: Protozoology, Londres, 1926. 8. CRAIG, FAUST: Clinical Parasitology, Filadelfia, 1940. 9. M. LANGERON: Précis de microscopie, París, 5ª edición, 1934.
Fijador: Líquido de Schaudinn.
Alcohol de 95°: 1 vol.
Ac. acético glacial, para 95 c.c.: 5 c.c.
Agua destilada: 100 c.c.
Alcohol de 30º: 5 minutos
Alcohol de 10º: 5 minutos
Agua destilada: 5 minutos
Alcohol de 30º: 5 minutos
Alcohol de 50º: 5 minutos
Alcohol de 70º: 5 minutos
Alcohol de 83º: 5 minutos
Alcohol de 95º: 5 minutos
Alcohol absoluto: 10 minutos