Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Medicina Experimental y Salud Publica
versión impresa ISSN 1726-4634
Rev. perú. med. exp. salud publica v.2 n.3 Lima sep. 1943
TRABAJOS ORIGINALES
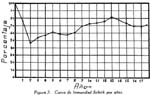
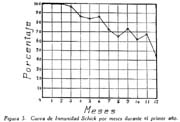
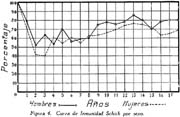
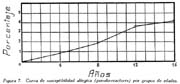
Investigación de la inmunidad natural antidiftérica Oscar Rondón S.1 1 Departamento de Inmunología del Instituto Nacional de Higiene y Salud Pública. La "inmunidad colectiva" a la infección diftérica, está dada, en gran parte, por el predominio dentro de la colectividad, de sujetos susceptibles o resistentes a la infección, y por el reconocimiento y estudio de esta forma de inmunidad del individuo, es como nos vamos a dar cuenta del estado inmunitario de la población, o en términos epidemiológicos, de la "inmunidad colectiva". Después de los trabajos de ABEL (1894) y de WASSERMANN (1895), quedó probado, que en la sangre de sujetos normales puede haber antitoxina diftérica, demostrable por inoculación subcutánea al cuy de mezclas de toxina diftérica y suero de sujetos inmunes. RÖMER (1909) facilitó grandemente el conocimiento de la distribución de esta antitoxina, en grandes masas de población, gracias al descubrimiento de su preciosa y delicada técnica intradérmica, para medir pequeñas cantidades de antitoxina, (o toxina); sin embargo, su método no se generalizó grandemente debido a que su manipulación requiere conocimientos especiales de laboratorio. Fué SCHICK (1908, 1911, 1913) el que valiéndose de esta técnica, les, proporcionó un método más sencillo y mucho más práctico, para hacer la distinción entre individuos susceptibles y resistentes en comunidades humanas. Valiéndose de esta "Reacción de Schick", como comunmente se la llama, es que nosotros hemos llevado a cabo el estudio de la "inmunidad colectiva" para la Difteria, en nuestra población. DIAGNOSTICÓ DE SUSCEPTIBILIDAD A LA DIFTERIA. MATERIALES Y METODOS Prueba de Schick. A pesar de ser comunmente conocidas las técnicas a seguir para realizar esta reacción, creo, sin embargo, indispensable exponer a grandes rasgos, los métodos y materiales usados por nosotros, tanto porque el reactivo de SCHICK ha sido preparado por nosotros mismos, como también porque así lo exige el estudio comparativo. Toxina Standard para la Prueba de Schick. La Toxina diftérica usada en la preparación de este reactivo, ha sido el lote XXX F. 2, resultante del desarrollo de la cepa NY PARK W-8, en caldo preparado con infusión de carne y el producto, de la auto-digestión péptica de estómagos de cerdo, de acuerdo a la técnica señalada por G. RAMÓN (1933). Este lote de toxina fué escogido entre otros, porque llenaba los requisitos indispensables, y que estudiaremos a continuación; fué preservado con toluol y guardado en frío durante todo el periodo de investigación, y tituló como M. L. D. (1) (Mínima dosis mortal) en 0.002 cc. a fines de 1939, valor que fué probado varias veces durante este mismo período, dando algunos cambios despreciables, que anotaremos oportunamente. La reacción de SCHICK al hacer la distinción entre sujetos inmunes y no inmunes, nos da también un valor cuantitativo de inmunidad, dentro de ciertos límites, ya que SCHICK (1913), y MICHIELS y SCHICK (1913), ajustaron empíricamente la dosis de 1/50 de M.L.D. en el cobayo, como la cantidad suficiente para producir reacción en la piel de los sujetos que no alcanzaran a tener 1/30 de unidad antitóxica por centímetro cúbico de sangre, cantidad de antitoxina que consideraron suficiente para dar inmunidad. Por este hecho, la "dosis de prueba" debe ser definida y la toxina que se escoja, para este uso, ha de llenar ciertos requisitos standard. Además la "dosis de prueba", tal como fue definida originalmente por SCHICK (1913), está valorada por la acción mortal de la toxina (M. L. D.), pero en la prueba de SCHICK no entra en función directa este valor, sino la acción tóxica sobre la piel, (M.R.D.). (2), y sobre todo "el poder de combinación", entendiéndose por este, la mayor o menor afinidad de una toxina para ser neutralizada por la antitoxina contenida en los líquidos tisulares del individuo. La. mínima dosis mortal (M. L. D.), como ha sido indicado por GLENNY (1925), no mide este "poder", ni está directamente en relación con el valor tóxico por lesión cutánea o M.R.D. (RÖMER, 1909). Por estas consideraciones se hizo la revisión de la dosis de prueba de SCHICK, y la Comisión de Higiene de la Sociedad de las Naciones, de acuerdo con la propuesta de los serólogos designados para el estudio de este punto, el año 1930, ha recomendado el año 1931 (REPORT, 1931; TAYLOR, 1937; TOPLEY, 1942; PHAIR, 1942), en un folleto del Comité de Higiene, las siguientes reglas y condiciones para escoger una toxina diftérica destinada a la prueba de SCHICK: 1° La toxina debe estar standardizada o "madura", según el término del comité, ya que los filtrados tóxicos, recientemente preparados; tienen una pérdida rápida en su poder tóxico, en los 3 ó 4 primeros meses; después de los cuales se estabiliza durante un tiempo más o menos prolongado, en el cual, solamente tiene insignificantes pérdidas en su toxicidad (MURILLO, 1920; GLENNY, 1928; PHAIR, 1942). 2° La toxina debe tener un poder tóxico señalado y además, la facultad de unirse con la antitoxina en grado y condiciones determinadas, que la Liga de las Naciones define así: "La dosis de toxina para la prueba de SCHICK, a ser inyectada en un volumen de 0.2 cc. deberá ser aquella cantidad de toxina, la cual, cuando se mezcla con 1/750 parte de una unidad internacional de antitoxina y es inyectada intradérmicamente en un cobayo normal, no causa reacción local; pero, cuando es mezclada con 1/1250 parte o menos de una unidad internacional y es similarmente inyectada, causa una reacción marcada del tipo de la Reacción de Schick , "positiva"; estipulando que la toxina sea tal que 1/25 de la dosis de prueba Schick determinada anteriormente, sin mezcla con antitoxina, cuando es inyectada intracutáneamente en un cuy normal, causa una reacción local definida del tipo de la reacción de Schick "positiva"; pero que 1/50 de la dosis de prueba Schick, simultáneamente inyectada, sin mezcla, no cause reacción local de este tipo (PHAIR, 1942)". En estas dos definiciones, la cláusula principal define la dosis SCHICK en términos de poder tóxico para la piel del cuy, y por otro lado, alterna con la cláusula que trata con el poder de combinación, o mejor dicho, valora la dosis en términos de "poder tóxico para la piel" y "poder de combinación". De acuerdo con estas consideraciones standard nosotros hemos escogido una toxina tal que 1/50 de dosis mínima mortal (M.L.D.), de acuerdo con SCHICK, reúna también las condiciones señaladas por la Liga de las Naciones. Esta toxina ha sido probada varias veces en todos sus requisitos, durante su uso y es digno de anotarse que solamente se encontró una insignificante disminución en su poder mínimo mortal (M.L.D.), pero conservando las otras condiciones. Esta pequeña baja en su poder mortal fué despreciada por nosotros, porque añadimos un 20% más de toxina a cada lote de reactivo de SCHICK, con miras de ponernos a salvo, justamente, de alguna pérdida en el poder tóxico por cualquier circunstancia y de acuerdo con W. BUNNEY (1931) y lo señalado por M. TAYLOR y P. J. MALONEY (1937) y otros investigadores corno C. JENSEN (1931 a), todos los cuales han constatado que un valor más alto que el señalado por la Liga de las Naciones, no solo no altera los resultados; sino que hace más distintas y más fácilmente interpretables las reacciones piel. Aún más, para ponernos en óptimas condiciones de trabajo y para control, hemos comparado los resultados de la "prueba de SCHICK" en varios niños con el dosaje de antitoxina en la sangre de los mismos, dosaje hecho por una modificación del método de RÖMER, resultados que analizaremos posteriormente. Diluyente de la toxina para la Reacción de Schick. Es un hecho reconocido que la estabilidad de la toxina diftérica se pierde y su título baja rápidamente en pocos días si se la diluye en un líquido no apropiado (GLENNY y Col. 1925 a; GLENNY y Col. 1928; BUNNEY, 1931) tal como, suero fisiológico y más aún si se le agrega un preservativo como el fenol u otro desinfectante. Esto nos indujo a la búsqueda y elección de un diluyente en el cual nuestra toxina conservara su estabilidad y además, de acuerdo con B. WHITE y W. BUNNEY y MALCOLM (1932), llenara otros requisitos tales como: que sea de poco costo, que permita la dilución de la toxina a la concentración del reactivo de SCHICK, sin deterioro de su toxicidad durante, por lo menos, dos meses a la temperatura, ambiente, y que no se altere por la filtración a través de una bujía Berkefeld; además, que proteja a la toxina contra la acción de un preservativo, y que, desde luego, sea satisfactorio para el uso intradérmica en el hombre. Nosotros hemos probado algunos diluyentes como: el suero fisiológico; el diluyente Buffer Borax.-Bórico de GLENNY, POPE y WADDINGTON (1928), el peptonado de BUNNEY (1931) y el de F. MODERN (1932). Habiendo encontrado muy satisfactoria para nuestra toxina, la solución de W. BUNNEY (1931), formada por 2% de peptona "Difco" en agua destilada, conteniendo 0.85% de cloruro de sodio y 0.5%, de fenol y con un pH. 7.8 a 8.0; esterilizada por autoclave a 120°C. por treinta minutos. La dilución de la toxina ha sido hecha en la forma siguiente: En un balón volumétrico de capacidad suficiente calculado para el uso de un mes, se mezcla la cantidad necesaria de toxina diftérica (para que dé una solución tal que 1 cc. de la dilución contenga 1/5 de M. L. D., más un 20% de exceso requerido), agregando al balón la solución de peptona previamente fenicada en cantidad suficiente para completar el volumen del balón aforado. La dilución es después filtrada por bujía Berkefeld y probada en su toxicidad y esterilidad acostumbrada, quedando así lista para su envase y uso durante un mes; tiempo que deberá permanecer a 4°C. y al abrigo de la luz, después del cual se eliminará y se hará una nueva preparación, con la misma toxina y el mismo diluyente, en iguales condiciones. Reactivo "Control de Schick". La inoculación intradérmica al hombre de un "filtrado tóxico de gérmenes diftéricos puede ocasionar una reacción proteínica, anafiláctica, debida al toxoide o a las proteínas, proteosas y peptonas, contenidas en el caldo en el cual desarrolló el bacilo diftérico para la producción de la toxina. Esto obliga a probar a los sujetos en los cuales se hace una reacción de SCHICK frente a una solución determinada de "toxoide" (Reacción de Moloney o R. de Zoeller), o más simplemente, frente al mismo reactivo de SCHICK preparado en la forma indicada; pero, que haya perdido todo rastro de toxicidad por calentamiento a 80°C. durante 5 a 10 minutos (PHAIR, 1942; DUDLEY, 1923). Este-último método fué el seguido por nosotros para preparar el control de SCHICK, porque permite buenas reacciones anafilácticas en los sujetos sensibles; y sobre todo, porque coloca en idénticas condiciones los dos inyectables, toxina y control de SCHICK, que es el principal requisito que debe tener todo control. Método de Inyección y Lectura de la Reacción de Schick. En principio esta técnica es simple y fácil de realizar; pero para poder obtener resultados correctos, debe ser hecha por médicos que tengan alguna práctica previa y sobre todo, con la mayor exactitud posible. No es nuestra intención añadir nada a las múltiples y excelentes descripciones dadas por los que han trabajado en este punto (PARK, 1914; ANDREWES y col. 1923). Simplemente describiremos las circunstancias y métodos con los que hemos llevado a efecto nuestro trabajo. La Toxina y el Control de SCHICK fueron inyectados usando dos jeringas del tipo "tuberculina", de una capacidad de 1 cc. y cuyos émbolos trabajaban perfectamente bien. Cada jeringa fué armada con una aguja bien adaptable, de clibre 26 y de 1.25 cms. de largo, cuidando de que la punta estuviese bien afilada. La jeringa usada para la inyección del control fué manejada por un ayudante experimentado y marcada con una banda roja para evitar cualquier confusión posible. Las inyecciones de "Toxina" y "Control" fueron hechas cuidadosamente intradérmicas, en el área de piel más despigmentada del antebrazo; usando permanentemente el brazo derecho para el control y el izquierdo para la toxina. Después de la desinfección de la piel, la aguja fué introducida procurando que el bisél quedara hacia arriba en el momento de la inyección lenta de la cantidad estrictamente requerida (0.1 cc.), y que se formara una flictena blanca, flictena que sólo se pierde después de algunos minutos. Esto nos indicaba que la inyección había sido hecha estrictamente intradérmica. No hemos encontrado necesario cubrir el punto de inoculación. Lectura de los Resultados. Los tipos de reacción que siguen a la inyección de "toxina" y "control" son variables en cada sujeto, variación que está de acuerdo con los distintos grados de inmunidad para la "Toxina" y susceptibilidad anafiláctica para el "Control". Así como también, en el mismo sujeto, en relación con el tiempo transcurrido desde el momento de la inyección. Sin embargo, los investigadores están de acuerdo en señalar un límite mínimo de reacción que dé valor a la prueba (ANDREWES y col. 1923) y poder encuadrar a los sujetos probados en cuatro grupos importantes, teniendo en cuenta el grado y calidad de la reacción y a la vez su interpretación inmunológica (COPEMAN y col. 1922). Así tenemos: 1° Positivos. Se reconoce a los sujetos Schick positivos cuando 24 6 48 horas después de inyectada la Toxina de Schick, se manifiesta una área circular roja ligeramente edematosa y bien delimitada, de 1 a 2 ó más cms. de diámetro, y que llega al máximo de evolución al 4° día. De este máximun decrece en los 7 ó 14 días siguientes, con descamación de la epidermis y dejando por espacio de 4 a 6 semanas, una pigmentación morena. La zona correspondiente al punto donde se inyecta el "control" no debe mostrar ningún signo de reacción, después de las primeras 24 ó más horas. 2° Negativos. Se reconoce a los sujetos Schick negativos, porque cuando pasadas las 24 primeras horas de la inoculación no muestran ninguna reacción en ambos antebrazos o puntos de inoculación; o por lo menos, es menor a 1 cm. de diámetro, y se pierde rápidamente en los siguientes días. 3° Pseudo-negativos. Se reconoce a los sujetos Schick pseudo-negativos, cuando dan en ambos puntos de inoculación (toxina y control) una reacción de tipo urticariante, reconocible por ser menos circunscrita y mas infiltrada que la reacción propiamente de Schick; que desarrolla rápidamente, en las primeras 24 horas y disminuye dentro de los primeros cuatro días; dejando una ligera pigmentación parduzca y muy pequeña descamación epitelial. 4° Pseudo-positivos. Se reconoce a los sujetos Schick Pseudo-positivos, cuando la inoculación de la "toxina" de Schick dá en ellos una reacción del tipo "positivo", bien manifiesta al cuarto día; y en el punto de inoculación del "control" dan una reacción del tipo "pseudo-negativo", que palidece al cuarto día o algunas veces un poco más tarde. Este tipo de reacción requiere mayor cuidado en su lectura para su correcta interpretación. La interpretación inmunológica de estos resultados son los siguientes: Las reacciones Negativa y Pseudo-Negativa, corresponden a sujetos inmunes para la difteria. Las reacciones Positiva y Pseudo-Positiva, corresponden a sujetos no inmunes. Las reacciones Pseudo en Positivos o Negativos a la toxina, indican una susceptibilidad anafiláctica del tipo de la reacción a la tuberculina. En la rutina de nuestro trabajo nosotros hemos hecho dos lecturas permanentemente; una, al segundo día, y la otra al cuarto día de realizada la inyección; midiendo en milímetros los diámetros vertical y horizontal. Lecturas excepcionales, más tardías, han sido hechas solamente para despistar los casos dudosos y en especial, para las reacciones de tipo Pseudo-Positivas. VALOR DIAGNOSTICO Y SIGNIFICADO EPIDEMIOLOGICO DE LA PRUEBA DE SCHICK El valor diagnóstico de la Prueba de Schick, como método a distinguir los sujetos inmunes de los receptibles, es aceptado por casi todos los investigadores. Sin embargo, en la literatura sobre este punto se encuentran informes, aunque escasos, referente a niños Schick-negativos (inmunes naturales o vacunados) que posteriormente han sufrido de difteria clínica y que, serían una fuerte objeción a lo aceptado generalmente, si la mayoría de estos mismos investigadores tales como B. A. PETERS (1923), R. A. O'BRIEN (1925), OKELL y PARISH (1926), N. H. R. HARRIES (1924), DAVIES, etc., no hubieran rectificado su criterio sobre la base de una observación más cuidadosa de las técnicas en la reacción de Schick y en el diagnóstico de los casos clínicos. En cambio, por otro lado, pesan a favor del valor de la reacción de Schick, las múltiples observaciones en el comportamiento de los reactores negativos o positivos en la población en general o en médicos, enfermeras, etc., las que se exponen a un alto riesgo de infección diftérica. Un hecho singular y remarcado por OKELL y PARISH (1926) es textualmente que: "Los investigadores no se han dado todavía cabal cuenta de que los "Portadores" propiamente así llamados, con bacilo virulento en sus gargantas, son siempre Schick negativos, y son inmunes a la enfermedad". Hay hechos, aunque pequeños, más concluyentes sobre este punto, como la experiencia directa llevada a cabo por G. C. GUTHRIE, B. C. MARSHALL y W. L. MOSS (1921), en la que cuatro sujetos Schick-negativos o pseudo-negativos y cuatro Schick-positivos, fueron inoculados en la garganta con un germen diftérico virulento; con los siguientes resultados: Tres de los reactores negativos se transformaron en portadores y el otro no sufrió ningún cambio; mientras que los cuatro reactores positivos desarrollaron una difteria clínica, En fin, sin negar la posibilidad de existir casos de difteria clínica en sujetos Schick-negativos, perfectamente comprobados, el número de casos de ellos y en éstos, su evolución benigna, no quitan valor al diagnóstico de la prueba de Schick, probado por un sinnúmero de observaciones concluyentes, que sería ocioso enumerar aquí. Otro hecho que requiere nuestra atención es que la dosis de prueba Schick reclama, para ser negativa, la existencia de 1/30 de unidad antitóxica por cc. de sangre en los sujetos probados, de acuerdo al ajuste de la dosis de prueba hecho por MICHIELS Y SCHICK (1913), y según BEHRING (1914) se considera más o menos esta cantidad de antitoxina en la sangre, como suficiente para colocar al individuo al abrigo de la infección diftérica. De esto se comprende, que el resultado de la prueba de Schick significa o dice, de la existencia de un "nivel" de antitoxina en la sangre de los sujetos probados y que este "nivel" es el que determina la inmunidad para la difteria, concepto que hoy es unánimemente aceptado. Queda sí un hecho por aclarar y es el grado o punto que debe alcanzar este nivel el cual ha fluctuado de acuerdo a las distintas investigaciones, entre 1/20 a 1/200 de unidad antitóxica, como lo hace notar CLAU JENSEN en sus publicaciones (1931, a, b, c, d, e). Hoy en día, es comunmente aceptado un "nivel" Schick de 0.01 de unidad antitóxica por cc. de suero, como la cantidad suficiente para hacer una reacción de Schick negativa (ANDREWES y Col. 1923; DUDLEY y col. 1934; PHAIR 1942), con algunas excepciones. Así, se ha encontrado que algunos niños recién nacidos dan reacciones de Schick negativas (WEAVER y MAKER 1915), sin poderse demostrar antitoxina en su sangre. Esto parece ser debido, como lo afirman FRIEDBERG y HEIN (1929), a una propiedad general de la piel de estos niños, a toda clase de irritantes. También es posible encontrar algunas excepciones en niños de mayor edad, tales como las señaladas por nosotros al hacer el control de nuestro reactivo de Schick con el dosaje de antitoxina, excepciones que están de acuerdo con lo comunmente encontrado por otros investigadores. En el Cuadro I y en la Figura I nosotros damos los resultados obtenidos por la titulación de antitoxina en la sangre de 44 niños, previamente probados con el reactivo de Schick. Estos niños fueron tomados al azar, pero cuidando de hacer la sangría cuando más 4 días después de hecha la inyección de toxina de Schick. Esta precaución es indispensable, ya que GLENNY (1922) y C. JENSEN (1931 a) han demostrado que pequeñas cantidades de toxina o toxoide, pueden actuar como "estimulantes secundarios" cuando el sujeto tiene experiencia previa con la toxina del bacilo diftérico o, sus derivados; y por lo tanto, causar un aumento grande y rápido de la antitoxina en la sangre; pero que ésta no se establece hasta pasados más de cuatro días de recibido el estimulante secundario", en este caso, la toxina de Schick (JENSEN 1931 f). Como hacemos notar en el Cuadro y Figura citados, los resultados de las titulaciones han sido los siguientes: Del total de niños Schick-negativos, solamente 92.4% mostraron un nivel de antitoxina igual o mayor a 0.01 unidad de antitoxina por cc.; y 7.6% mostraron desacuerdo entre la respuesta a la Reacción de Schick y la cantidad de antitoxina demostrada; aunque ésta estuvo presente en el 100% de todos los niños Schick-negativos probados. Por otro lado, 94.5 % de los probados como Schick positivos, no alcanzaron el "nivel" Schick y solamente un niño (5.5%) había sobrepasado este "nivel", teniendo 1 unidad de antitoxina por cc. de sangre a pesar de haber dado una reacción positiva; sin embargo, es necesario señalar que ésta fué débil y tardía. Además, el 72.2% de estos niños no tuvieron antitoxina demostrable y 22.2% solamente alcanzaron a tener 0.005 de unidad de antitoxina por cc. en su sangre. La técnica seguida por nosotros para el dosaje de antitoxina en la sangre de todos estos niños, fué una modificación del método de RÖMER, descrita por A. ZINGHER (1916), y usada en el grado y límites de dosaje que el mismo autor aconseja. Con este fin nosotros hemos aprovechado de la dosis L+ de toxina (2) la cual fué titulada por medio de un suero de unidades standard (S. P. Washington). Además los resultados fueron controlados haciendo, simultáneamente con las titulaciones en el suero de los niños, pruebas con un suero de título previamente conocido. Todo lo anteriormente mencionado nos lleva a afirmar, que no es posible señalar con exactitud matemática un punto límite, sobre el cual todo niño debe dar una reacción negativa, y que a la vez, marque el límite máximo, bajo el cual, siempre deba encontrarse reacciones Schick positivas. Esto parece ser debido, como ya ha sido señalado por muchos investigadores y recientemente probado por JOHN J. PHAIR (1942), a que no es posible comparar el valor de una sola observación en una muestra de sangre, la que mide un título antitóxico en condición estática, a la reacción de la piel por estímulo a la dosis Schick, que refleja una situación dinámica; o sea: que la reacción de Schick no solamente mide el grado de inmunidad a que puede haber llegado un individuo, sino también su capacidad actual o potencial para producir antitoxina. Así, por ejemplo, un niño que ha recibido una dosis de vacuna diftérica, al poco tiempo (7 días) puede dar una reacción Schíck negativa, sin que alcance a tener el "nivel" de 0.01 unidades de antitoxina por cc. en su sangre, y sin embargo, poco tiempo después (30 días) sobrepasa este "nivel". Debemos recordar, a este respecto, que ya GLENNY, en 1925, no creía completo el cuadro de dos categorías -inmunes y receptibles- en que estaban divididos los sujetos por una simple reacción de Schick o dosaje de antitoxina, y admitía la existencia de cinco categorías en condiciones distintas unas de otras, de acuerdo al número de estímulos antigénicos naturales que podían haber recibido y en consecuencia estar en condiciones de responder más rápidamente a un nuevo estímulo antigénico, aunque no fueran Schick-negativos. Hoy pues, podemos decir con J. J. PHAIR, que el valor de la reacción de Schick como medio de ensayar el estado de inmunidad a la difteria, está ampliamente confirmado, y que el significado de una reacción de Schick negativa está en relación con la antitoxina demostrable en el momento de la prueba o con la rápida habilidad para movilizar su antitoxina. Además, una reacción de Schick positiva, significa que el individuo bajo prueba no tiene antitoxina o es incapaz de producirla si se le expone a un estímulo mínimo. Este es un hecho importante para el estudio epidemiológico de la Difteria, así como también, para planear medidas profilácticas. POBLACION INFANTIL EXAMINADA La reacción de Schick fué aplicada a niños de la población en general, asistentes. a los distintos servicios del Instituto del Niño de Lima y Callao; tales como: Cunas Maternales, Dispensarios Infantiles, Clínicas de Nutrición, Colonias, etc.; así como a algunas dependencias escolares de Lima, como: Escuelas Climáticas, Colegios y Centros Escolares. Comprendiendo en la capital, a Miraflores, Barranco, Pueblo Libre (Magdalena Vieja), Magdalena del Mar, San Miguel y Chosica. El total de niños sometidos a la inyección de toxina y control de Schick, llegó a más de 4.000; pero por ausencia de muchos de ellos, no fué posible completar la lectura de todas las reacciones, quedando reducido el número, por esta razón, a 3.562. Los niños fueron registrados de acuerdo a su sexo, edad y raza; y en el momento de la prueba, todos se mostraron aparentemente sanos; sin antecedentes de vacunación, ni aplicación de suero antidiftérico, y en consecuencia, la inmunidad que mostraron correspondía a una adquisición natural. RESULTADOS OBTENIDOS Revisadas las técnicas y materiales que hemos usado para el estudio de la inmunidad diftérica en nuestra colectividad, vamos a exponerlo más resumidamente posible, los resultados alcanzados con sus aplicaciones en relación con la edad, el sexo, el lugar y la raza. Según la Edad. Del total de 3.562 sujetos, de todas las edades, probados por la reacción de Schick, 2.422 (68 %) se muestran Schick negativos o inmunes; si nosotros desdoblamos este total de acuerdo a cada una de las edades probadas, como lo hacemos en el Cuadro II y Figura 2, encontramos que a la edad de 1 año, el porcentaje de inmunes es relativamente alto (75.3 %), para inmediatamente después bajar a un mínimun de 46.9 %, correspondiente a la edad de 2 años. Desde este punto, la curva de inmunización asciende año tras año, hasta alcanzar a las edades de 13 y 14 años un máximun de 77.5% a 80.7%; después de lo cual, la curva se mantiene más o menos estable en un porcentaje casi igual al que habíamos encontrado a la edad de 1 año. En la Figura 2 hemos iniciado el trazo de la curva inmunitaria, con 100% de inmunes, a partir de ó años de edad, debido a que al desarrollar por meses los grados de inmunidad de los 34 niños comprendidos en el primer año de vida (Cuadro III, Figura 3) hemos constatado que los recién nacidos y hasta los dos primeros meses, responden con una inmunidad total (100%); nivel inmunitario que desciende escalonadamente con la edad, hasta un mínimo de 45.6%, al completar justamente los 12 meses. Según el Sexo. El estudio comparativo en relación al sexo (cuadro II) nos muestra, que de 1803 hombres probados con la reacción de Schick, 1281 (71%) respondieron como inmunes; en cambio, de un total de 1759 mujeres, solamente 1141 (64.8%) fueron negativas. Esto parece demostrar un mayor grado de inmunidad en los hombres que en las mujeres, diferencia que se hace perceptible en casi todas las edades, como se puede apreciar mejor en la Figura 4. Es curioso el hecho, de que a la vez que el nivel de inmunidad es más bajo en la mujer que en el hombre, en ésta disminuye más rápidamente en los primeros meses de vida y tarda también más tiempo en elevar su curva inmunitaria en relación con la de los hombres. Según el lugar. Para poder comparar los resultados de inmunidad Schick entre un lugar con otro, es necesario poder contar en cada ciudad o lugar, con niños de edad similar; ya que, como hemos visto, este factor influye grandemente. Nosotros no tenemos datos que reúnan estas condiciones, fuera de los niños comprendidos entre 1 a, 5 años; y sólo en cuatro lugares que son: Lima, Callao, Miraflores y Magdalena del Mar. En el cuadro IV y en la Figura 5 se muestran estos resultados, que por lo demás, no dan mayor diferencia en el porcentaje de niños inmunes para estos lugares; con excepción de Magdalena del Mar, que sólo alcanzó a tener un 51.4%. Resultado relativamente bajo si se le compara con el porcentaje dado para Miraflores, que es de 66.6%, o más simplemente con la proporción de inmunes para todos los lugares, aquí comparados, que alcanza a 64%. Según la Raza. Del total de 3.469 reacciones de Schick realizadas en sujetos pertenecientes a las razas: Blanca, Negra, Mestiza e India, un 68% se mostraron Schick-negativos o Inmunes. Este porcentaje es similar al encontrado para el total de observaciones, sin distinción de razas ni edades, a pesar de que no son tomados en cuenta muchos niños, que no fueron identificados en cuanto a su raza, o que pertenecían a la raza amarilla; en ésta última el número de sujetos probados fue insignificante y solo comprendido en una que otra edad; por lo cual fué desprecaida en nuestro estudio comparativo. En el Cuadro V y en la Figura 6, nosotros mostramos las variaciones en función de la raza: las razas negra e india, se muestran más altamente inmunes (80.1 % y 76.0%) que la blanca o mestiza (59.0 % y 69%) Pseudo-Reacciones Reuniendo a los niños que han dado reacciones alérgicas o pseudo-reacciones, ya sean Schick-positivos o negativos, en grupos formados de cuatro en cuatro años, hasta la edad de 16, con el objeto de obtener cifras comparables, podemos indicar que -como se muestra en el Cuadro VI y en la Figura 7- hemos encontrado un aumento progresivo con la edad, del porcentaje de susceptibilidad al reactivo y al control de Schick usado por nosotros. Partiendo de un mínimun, en los primeros cuatro años, de 0.9 %, hasta un máximun de 4.1%, entre los 13 a 16 años. El porcentaje sacado del total de niños que dieron este tipo de reacción alérgica, para todas las edades, no fué mayor de 2.6 %. De este total, la proporción de niños que dieron reacciones pseudo-positivas fué insignificante y alcanzó a un 0.8 La edad menor en la que se sorprendió alguna reacción de este tipo fué la de 6 meses, y aún con signos no tan característicos, como hemos podido observar en niños de mayor edad. DISCUSION Después de los primeros trabajos de R. ABEL (1894), P. H. RÖMER (1909) y B SCHICK (1908, 1911, 1913) y a continuación muchos otros como los de F. GROER y K. KASSOWITZ (1919) y los más recientes de A. ZINGHER (1924) y de J. J. PHAIR (1942), los conocimientos han llegado a tal punto, de poderse afirmar que en la sangre del cuerpo humano normal e inmune, existe antitoxina diftérica factible de ponerla en evidencia de titularla. La reacción de Schick también pone en evidencia esta antitoxina; como lo prueba el estudio comparativo realizado por nosotros, entre la respuesta del individuo a la inyección intradérmica de una dosis de Schick y el dosaje de antitoxina en la sangre del mismo sujeto; pero el hecho de que no pueda relacionarse estrechamente el resultado de la reacción de Schick con la cantidad exacta de antitoxina circulante en el momento de la prueba, no resta valor a ésta, ya que ella por ser una reacción realizada en el mismo individuo, refleja la habilidad de éste para producir o movilizar su antitoxina y conseguir así el estado de inmunidad; en consecuencia, según nuestro criterio, la prueba de Schick, además de ser un método fácil, es útil para reconocer a los sujetos inmunes o potencialmente inmunes y por lo tanto refleja mejor el estado de inmunidad del individuo; y no debe de ser desechada al llevara cabo estudios de esta índole. Desde antiguo se han encontrado distintos grados de inmunidad, que varían en relación con la edad. Así, es comunmente aceptado que en los primeros meses de vida, se encuentre un alto porcentaje de niños inmunes, que según la recopilación de los informes de ANDREWES y col. (1923), llega hasta un 78%, y según ZINGHER (1924) a 84 %. El origen de esta inmunidad parece ser una adquisición pasiva a través de la placenta, y en parte tal vez, con el calostro de los primeros días de lactancia tal como les ha sido posible constatar a GROER y KASSOWITZ (1919); que por lo demás, ya ha sido también señalado, para otros anticuerpos, por MASON, DALLING y GORDON (1930). Esta inmunidad se pierde con rapidez, quizá como resultado de ser adquirida por el niño en forma pasiva. Nuestros resultados en las primeras edades confirman y están de acuerdo con estas afirmaciones; ya que hemos encontrado una inmunidad de 100 %, dentro de los dos primeros meses de vida, la que desaparece en más del 50 % de niños cuando han alcanzado justamente los 12 meses de edad (ver Figura 3). A partir de este momento; la curva del porcentaje de inmunes se eleva en relación con la mayor edad (Figura 2) y esto es observado tanto en los niños estudiados por nosotros, como también en los estudios de los investigadores mencionados anteriormente; sin embargo, hay algunas diferencias que radican especialmente en el porcentaje más alto de inmunes encontrado entre nosotros a las edades de 1 a 2 años (75.5 % a 46.9 %), en comparación con los informes de ZINGHER (16 %) y de ANDREWES y Col. (46 %) para estas mismas edades, nivel que también se manifiesta más alto, aunque en menor grado, para las siguientes edades. Lo que significaría un grado mayor de inmunidad para nuestra población infantil, justamente más marcada en las edades de mayor susceptibilidad para la Difteria. Esto explicaría, quizás en parte, el que esta enfermedad no sea relativamente, tan frecuente entre nosotros. El hecho, ya señalado, de que el grado de inmunidad de la población aumenta con la edad, que en nosotros llega al máximun a los 13 años, con 80.7 % de inmunes, ha planteado un interrogante sobre el origen de esta adquisición de inmunidad. Para la mayoría de los autores y entre ellos los ya mencionados, esto sería el resultado de estímulos específicos procedentes del exterior traducido por infecciones inaparente o bacteriológicos -en oposición a la infección clínica- que sin llegar a dar síntomas alarmantes, promovería en la sangre del sujeto, la producción de antitoxina, dando como resultado un proceso gradual y "natural" de inmunización, a partir del momento en que el niño se pone en contacto con el medio ambiente, reemplazando en esta forma su inmunidad "pasiva" transitoria, de la primera infancia, por una inmunidad "activa" alcanzada por los niños de mayor edad. A favor de estos conceptos existen experiencias que demuestran mayor grado de inmunidad en los niños más expuestos a la contaminación, como los correspondientes a las clases pobres o media, en comparación a las clases acomodadas. Tal vez la confirmación mas clara del efecto del medio exterior y de la infección sobre el aumento de esta inmunidad, fue obtenida' por los de estudios de S. DUDLEY (1923), quien observó una pequeña comunidad aislada de niños, que durante varios años sufrió tres invasiones epidémicas del germen diftérico Aplicando DUDLEY la reacción de Schick, en diferentes períodos en esta comunidad, pudo observar olas de inmunización antitóxica asociadas a cada epidemia de la enfermedad. Nosotros podríamos relacionar a este hecho, el que la curva de inmunización de la mujer, en nuestra comunidad infantil, se mantenga más baja y aumente más tardíamente que la curva del hombre (ver Figura 4), ya que éstos por índole de su sexo, se exponen más tempranamente y con mayor intensidad a la acción del medio ambiente. Sin embargo, hay autores como L. HIRZFELD (1926), que sin negar el valor de los estímulos específicos procedentes del exterior, en el papel de producción de antitoxina, les conceden una importancia secundaria, y en cambio cree, que el principal mecanismo de inmunización radica en "órganos bioquímicos" -como él los llama- que jugarían el papel de verdaderos productores de inmunidad, independientemente de los estímulos externos, como resultado dé una función biológica al igual que las iso-aglutininas, que determinan los grupos sanguíneos en el hombre. Estos "órganos bioquímicos" alcanzarían su pleno desenvolvimiento en diferentes períodos de su desarrollo, exactamente igual como los diferentes "órganos histológicos" del cuerpo humano llegan a plena madurez en diferentes edades. Debemos hacer notar que este problema no es sólo puramente académico, sino que está ligado íntimamente a los problemas epidemiológicos y profilácticos. Hoy por hoy, nosotros debemos apoyarnos -sin negar las concepciones de HIRSZFELD- en los resultados categóricos obtenidos por trabajos -como los de DUDLEY o los numerosos resultados experimentales de vacunación (V. E. VOLK y F. BUNNEY, 1942; J. J. PHAIR y C. M. ROOT 1942 a; J. J. PHAIR, 1942 b, y L. H. MASON, 1942). De acuerdo con lo dicho, nosotros podemos concluir afirmando que los niños de nuestra colectividad nacen con una alta inmunidad pasiva, que posteriormente al perderla, es reemplazada por una inmunidad activa, producida o aumentada por, los estímulos específicos procedentes del exterior. El comportamiento de las razas en nuestra población, frente a la reacción de Schick, se presenta particularmente interesante, puesto que los niños correspondientes a rodas ellas, han sido probados en las mismas condiciones de técnica y bajo idénticos factores ambientales, esto los coloca en óptimas condiciones de experimentación. Por consiguiente, las diferencias en el grado de inmunidad que hemos encontrado, reflejan perfectamente la influencia de la raza en la epidemiología diftérica. Por lo demás, el mayor grado de inmunidad de la raza negra (80 %) en comparación con la raza blanca (58%) encontrado por nosotros, ya ha sido señalado por varios inmunólogos que han trabajado en algunos lugares del Africa. Así, recientemente G. RAMÓN y P. NELIS (1935), han llegado a afirmar que "los niños negros, presentan una inmunidad antitóxica cuyo grado es sensiblemente más elevado que la de los niños europeos de la misma edad". También mencionan el resultado, de algunas pruebas de Schick, practicadas por VAN SLYKE en 1933, en la región de Kasai, el cual quedó asombrado del fuerte porcentaje de reacciones negativas (100 %); porcentaje que también fué encontrado por H. DUBOIS (RAMÓN y NELIS, 1935) en el Alto-Uele. Por otro lado, J. B. BLANK en 1934, señala que la morbidez diftérica en ciertas regiones de los Estados Unidos es generalmente más baja en los negros que en los blancos. El estudio conjunto de los resultados obtenidos por nosotros sobre los grados de inmunidad de las razas: blanca (59%) mestiza (69.4 %), india (76%) y negra (80%), nos hace notar la mayor inmunidad para las razas negra e india que para la mestiza o blanca, y aún ésta última se presenta inferior a aquella y hasta al grado de inmunidad total para todas las razas (68 %). Estos nos hace pensar sobre el valor del papel que juega la mezcla de las razas sobre la epidemiología diftérica y en especial sobre el mayor grado de inmunidad encontrado en nuestra población, sin poder llegar a mayores conclusiones hasta que no se realicen nuevos trabajos. Nuestras observaciones en lo referente a la reacción tipo "alérgica" o pseudo-reacciones, no muestran signos de desconformidad con lo comunmente encontrado por otras observaciones, por ejemplo la de S. DUDLEY en 1923. Quizás si únicamente el número de reacciones "alérgicas" encontradas por nosotros, es algo menor que lo generalmente señalado, lo que estaría en favor de una menor interferencia en la correcta lectura de nuestras reacciones de Schick; esto no quiere decir que nuestra población sea menos sensible a este tipo de reacción, ya que nuestro "control" no ha sido ajustado para probar esta circunstancia. Por último, el estudio comparativo del nivel inmunitario en algunos de los distintos lugares comparables, en los cuales hemos realizado nuestra investigación, no nos han dado mayores diferencias, con excepción de Magdalena del Mar, que se mostró en un nivel algo menor que los otros lugares. Esta observación, si bien tiene algún significado epidemiológico, para ella misma no ha sido posible relacionarla con algunos de los otros factores estudiados aquí. CONCLUSIONES 1° La prueba de SHICK, en nuestras manos, ha demostrado ser un método fácil y útil para reconocer a los sujetos inmunes o potencialmente inmunes. 2° Los niños de nuestra población infantil nacen con una alta inmunidad, seguramente "pasiva", que al perderla, es reemplazada por una inmunidad "activa" producida o aumentada por los estímulos específicos procedentes del exterior. 3° En general hemos constatado un grado de inmunidad, para nuestra población infantil, mayor que la señalada para otros lugares, y ésta es más marcada en las edades de mayor susceptibilidad para la difteria. 4° El estudio comparativo de la inmunidad en relación al sexo, nos muestra al hombre como el más inmune. 5° El comportamiento de nuestras razas frente a la prueba de SCHICK señala a la raza negra como la más inmune y la blanca como la más susceptible, quedando la india y mestiza en un grado intermedio. 6° No hemos encontrado gran diferencia en el grado de inmunidad para los distintos lugares estudiados con excepción de Magdalena del Mar. NOTAS (1) Se entiende por M. L. D. la más pequeña cantidad de toxina que inoculada subcutáneamente a un cuy de 250 grs. de peso lo mate en 4 ó 5 días. (2) Se entiende por M. R. D. la menor cantidad. de toxina que inoculada intradérmicamente en la piel de un cuy produce en este una reacción definida. (3) Se entiende por L+ la cantidad menor de toxina que mezclada con una unidad internacional de suero, mate a un cuy de 250 grs. de peso en 4 ó 5 días. BIBLIOGRAFIA 1. ABEL, R., Deutsche med. Wehnsr., v. 20, p. 899, 936. (Topley, 1942). 1894 . [ Links ](°) 2. ANDREWES, F. W.; BULLOCH, W.; DOUGLAS, S. R.; DREYER, G.; FILDES, P.; LEDINGHAM, J., y WOLF, C. G., Diphtheria, Medical Research Council, London. 1923. [ Links ] 3. BEHRING, E., Berl. klin. Wehnschr., v. 51, p. 917. 1914. [ Links ] (°) 4. BLACK, J. B., American Journal of Hygiene, v. 19, p. 734, (RAMÓN, G., 1935). 1934. [ Links ](°) 5. BUNNEY, W. N., Journal of Immunology, v. 30, p. 1. 1931. [ Links ] 6. COPEMAN, O'BRIEN, EAGLETON y GLENNY, British Journal of Experimental Pathology, v, III, p. 42. [ Links ] 7. DUDLEY, S. F., Medical Research Council, Special Report. N° 75. 1923. [ Links ] 8. DUDLEY, S. F.; MAY, P. M. y O'FLYNN, J. A., Medical Research Council, Special Report, N° 195. 1934. [ Links ] 9. FRIEDBERGER, E. y HEIM, F., Deuts. med. Wschr., v. 55, p. 132, (Dudley, 1934). 1929 [ Links ](°) 10. GLENNY, A. T. y ALLEN, K., Journal of Hygiene, v. XXI, p. 104. 1922. [ Links ] 11. GLENNY, A. T., Journal of Hygiene, v. 24, p. 301. 1925. [ Links ] 12. GLENNY, A. T.; POPE, C. G.; WADDINGTON, H. y WALLACE, Journal of Path. & Bact., v. 28, p. 463. 1925 a. [ Links ] 13. GLENNY, A. T.; POPE, C. G. y WADDINGTON, H., Journal of Pathology & Bacteriology, v. 31, p. 133. 1928. [ Links ] 14. GROER, F. VON, y KASSOWITZ, K., Z. Immunforsch., v. 28, p. 327. (Topley, 1942). 1919 . [ Links ](°) 15. GUTHRIE, C. G.; MARSHALL, G. C. y MOSS, W. L., John Hopkins Hop. Bull., v. 32, p. 369. (Topley, 1942). 1921. [ Links ] (°) 16. HARRIES, E. H., Lancet, v. I, p. 921, (Forbes, 1927). 1924. [ Links ] (°) 17. HIRSZFELD, L., Ergrbn, Hyg. Bakt., v. 8, p. 367, (Topley, 1942). 1926. [ Links ] 18. JENSEN, CLAUS, Comptes Rendues Societé de Biologie. v. CVIII, p. 555. 1931. [ Links ] 19. JENSEN, CLAUS, Comptes Rendues Societé de Biologie, v. CVIII, p. 543. 1931 a. [ Links ] 20. JENSEN, CLAUS, Comptes Rendues Société de Biologie, v. CVIII, p. 552. 1931 b. [ Links ] 21. JENSEN, CLAUS, Comptes Rendues Societé de Biologie, v. CVIII, p. 577. 1931 c. [ Links ] 22. JENSEN, CLAUS, Comptes Rendues Societé de Biologie, v. CVIII, p. 539. 1931 d. [ Links ] 23. JENSEN, CLAUS, Comptes Rendues Societé de Biologie, v. CVIII, p. 579. 1931 e. [ Links ] 24. JENSEN, CLAUS, Comptes Rendues Societé de Biologie, v. CVIII, p. 532. 1931 f. [ Links ] 25. MASON, J. H.; DALLING, T. y GORDON, W. S., Journal of Path. & Bact., v. 33, p. 783. 1930. [ Links ] 26. MASON, L H., British Medical Journal, N° 4256, p. 121. 1942. [ Links ] 28. MICHIELS, J. y SCHICK, B., Z. Kinderheilk, v. 5, p. 255. (Topley, 1942) 1913. [ Links ] (°) 29. MODERN, F., Comptes Rendues Societé de Biologie, v. CX, p. 829. 1932[ [ Links ]STANDARDIZEDENDPARAG] 30. MURILLO, F., Monografía, El Suero Antidiftérico, Madrid. 1920. [ Links ] 31. O'BRIEN, R. A., J. Roy, San, Inst., v. 46, p. 132. (Forbes, 1927). 1925. [ Links ] 32. OKELL, C. C., y PARISH, H. J., Journal of Hygiene, v. 25, p. 363. 1926. [ Links ] 33. PARK, W. H., y ZINGHER, A., Proc. N. York Path. Soc., v. 14, p. 151. (Monografía, Difteria, 1923). 1914-15. [ Links ] (°) 34. PETERS, B A., The Lancet, II, 784, (Forbes, 1927). 1923. [ Links ] (°) 35. PHAIR, J. J., American Journal of Hygiene, v. 36, p. 283. 1942. [ Links ] 36. PHAIR, J. J., y ROOT, C. M., American Journal of Hygiene, v. 35, p. 251. 1942 a. [ Links ] 37. PHAIR, J. J., American Journal of Hygiene, v. 35 p. 292. 1942b. [ Links ] 38. RAMÓN, G., Comptes Rendues Societé de Biologie, v. 112, p. 8. 1933. [ Links ] 39. RAMÓN, G. y NELIS, P., Revue d'Immunologie, v. 1, p. 431, 1935. Report of the Permanent Commission on Biological Standardization League of Nations Health Organization, (London) 1931, p. 7, (Topley, 1942). [ Links ] (°) 40. RÖMER, P. H., Z. Immunforsch., v. 3, p. 208, (Topley, 1942). 1909. [ Links ](°) 41. SCHICK, B., Müch, med. Wschr., v. 55, p. 504, (Phair, 1942). 1908. [ Links ] (°) 42. SCHICK, B., Natuf. Aerzte, Wiesbaden, v. 27, p. 212, (Topley, 1942). 1911. [ Links ] (°) 43. SCHICK, B., Müch, med. Wschr., v. 60, p. 2608. 1913. [ Links ] (°) 44. TAYLOR, E. M. y MALONEY, P. J., Journal of Immunology, v. 33,. p. 191. 1937. [ Links ] 45. TOPLEY, W. W., y WILSON, Tratado de Bacteriología e Inmunología, Londres. 1942. [ Links ] 46. VOLK, V. K. y BUNNEY, E., American Journal of Public Health, v. 32, p. 700. 1942. [ Links ] 47. WASSERMANN, A., Z. Hyg. Infekt., v. 19, p. 408, (Topley, 1942) 1895. [ Links ] (°) 48. WEAVER, G. H. y MAKER, L., Journal of Infectious Diseases, v. 1 p. 342. 1915. [ Links ] 49. WHITE, R.; BUNNEY, W. y MALCOLM, W. H., Journal of Immunology, v. 22, p. 93. 1932. [ Links ] 50. ZINGHER, A., Journ. of Infectious Diseases, v. XIX. p. 557. 1916. [ Links ] 51. ZINGHER, A., American Journal of Public Health, t. 14, p. 955, (To pley, 1942). 1924 (°). [ Links ] NOTA.Los datos bibliográficos señalados con (°) no han podido ser consultado en el artículo original.