Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Medicina Experimental y Salud Publica
versión impresa ISSN 1726-4634
Rev. perú. med. exp. salud publica v.3 n.1 Lima mar. 1944
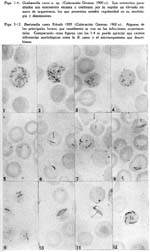
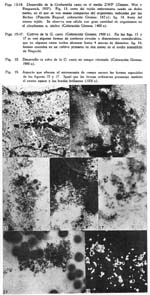
Descripción de una grahamella del perro, Grahamella canis n. sp. Arístides Herrer1 1 Departamento de Investigaciones Médicas del Instituto Nacional de Higiene SUMARIO En tres perros, de un total de 75 que fueron sometidos a hemocultivos, se ha recogido una grahamella que se describe con el nombre de Grahamella canis n. sp. La infección natural del perro parece ser imperceptible por medio de frotis de sangre. La G. canis se aisla fácilmente en cultivo en el medio semisólido de Noguchi y el agar sangre, consiguiéndose resiembras con regularidad solamente en este último. Los hemocultivos desarrollan tanto a 28º como a 37ºC. y son infectantes para su huésped. Tanto perros normales como esplenectomizados se pueden infectar experimentalmente con cultivos, obteniéndose mayor parasitismo en los esplenectomizados. Al mismo tiempo es posible obtener infecciones mixtas de Grahamella canis y Bartonella canis. La G. canis desarrolla in vitro en sangre citratada. En una nota preliminar (Herrer, 1942) decíamos que tratando de cultivar la Bartonella canis habíamos obtenido en cultivo un microorganismo en varios aspectos parecido a la B. bacilliformis. El medio empleado para su aislamiento era el semisólido de GEIMAN (1941) y el perro de donde se obtuvo el cultivo había sido esplenectomizado y estaba fuertemente parasitado por B. canis. Las observaciones realizadas hasta entonces eran incompletas por lo que nos limitábamos a afirmar que dicho organismo posiblemente pertenecía al grupo Bartonella-grahamella. Posteriormente hemos obtenido dos cepas más y llevado a cabo observaciones experimentales que nos permiten afirmar que se trata de una grahamella, la que en esta ocasión vamos a describirla con el nombre de Grahamella canis n. sp. La única referencia que hemos obtenido en la literatura sobre la existencia de grahamellas en el perro es la que ofrece BRUMPT (1928), quien al hacer una ligera enumeración de los animales en los cuales, se había encontrado hasta entonces este parásito, dice que también lo ha sido en el perro, pero sin dar mayor información al respecto. Morfología. La morfología del parásito ha sido estudiada sólo en perros infectados experimentalmente. En láminas coloreadas con GIEMSA se presenta de un color rojizo violeta, semejante a las bartonellas y demás grahamellas. Es de forma bacilar bastante constante a lo largo del curso de la infección, frecuentemente con marcada coloración bipolar (Fig. 1) y sólo raras veces se presentan elementos cocoides. No existen las formas con "ramas",en "arco de violín", "anillos", etc., que son tan frecuentes y características en la B. canis (1) Por lo general están en la parte céntrica del glóbulo (Figs. 1-4), especialmente cuando el número de organismos que contiene el eritrocito es elevado. De manera. general los glóbulos parasitados son tan escasos que se hace imposible expresarlos en porcentaje, como usualmente se acostumbra con otras especies de grahamellas. Es bastante variable el número de organismos que parasitan un mismo eritrocito, dependiendo, según parece, principalmente del estado del animal. En un caso, correspondiente a un perro esplenectomizado que mostraba cierto grado de anemia después de la extracción del bazo (3.2 mill. de glóbulos rojos), logramos contar 70, cifra esta la más alta que hemos observado. Infección natural de su huésped. Por medio de hemocultivos realizados en 75 perros, procedentes de cinco localidades distintas, logramos recoger tres cepas. Estas fueron identificadas primeramente a base de su morfología y características del cultivo, comprobándose posteriormente la identificación de dos de ellas por medio de inoculaciones. Para el aislamiento de manera general se usó el medio semisólido de NOGUCHI y el agar sangre, a excepción de la primera cepa cuyo cultivo original se obtuvo en el medio semisólido de GEIMAN (1941 ). Los tubos inoculados con la sangre de los perros se incubaba a 28ºC., usando tapones de jebe a fin de evitar la evaporación, llevándose a cabo su observación de manera rutinaria durante un mes. De la misma muestra de sangre, obtenido en todos los casos de la vena yugular, se hacía un frotis de control. Observados detenidamente estos frotis todos ofrecieron resultados negativos, inclusive aquellos que correspondían a los animales de los que se recogió en cultivo la G. canis, como se puede observar en el cuadro siguiente. La observación de este cuadro indica que la infección natural del perro por la Grahamella canis es sumamente ligera, susceptible de ponerla de manifiesto únicamente por medio del hemocultivo. CULTIVOS Características generales. Microorganismo Gram-negativo y sin movilidad. Para su cultivo requiere medios especialmente con sangre. En medios que contienen células vivas como el de ZINSSER, WEI y FITZPATRICK (ZWF), desarrolla intracelular y extracelularmente. Se cultiva tanto a 28º como a 37ºC. y es infectante para su huésped cuando menos hasta los 60 días. Aislamiento. El aislamiento de la G. canis es relativamente fácil. Lo hemos obtenido con regularidad en el medio semisólido de Noguchi, el ZWF, el agar sangre y el semisólido de Geiman (1941). El desarrollo en los cultivos primarios es lento y varía un poco según los medios. En el semisólido de Noguchi, que es con el que hemos trabajado principalmente en el aislamiento, por lo general se pone de manifiesto de los 10 a 12 días en cultivos incubados a 28ºC., aunque también es frecuente observarlo recién a los 15 ó 20 días, por lo cual es conveniente el uso de tapones de jebe a fin de conservar un buen grado de humedad en los tubos. En el agar sangre suele ser más rápido el desarrollo, pudiéndose ver las primeras colonias entre los 7 y 10 días. En los medios semisólidos las colonias se presentan de forma más o menos esférica y con la superficie irregular, de color blanco y con un diámetro que raramente alcanza 1 mm. El aspecto de estas colonias es francamente granular y se encuentran esparcidas a través de toda la extensión alcanzada por el inóculo, sin constituir una zona bien definida de crecimiento o "banda" como sucede en la Bartonella bacilliformis. Son escasos los organismos libres. Especialmente en el medio semisólido de Noguchi las colonias parecen contener alguna substancia adhesiva que reune fuertemente a los organismos, haciendo difícil el emulsionarlos. Cuando se extraen colonias aisladas y se trata de destrozarlas a fin de preparar frotis, se nota que suelen adherirse a las agujas con las que se hace la preparación. Si tales colonias se trasplantan al agar sangre, es frecuente ver que sigan desarrollándose en el sitio donde se las deposita, pero sin dar lugar a nuevas colonias o desprender organismos libres que se encontrarían en el líquido de condensación. Al tocarlas con el asa de platino o con agujas, se deslizan fácilmente sobre la superficie sólida del medio. Resiembras o subcultivos. Para los subcultivos conviene emplear medios, especialmente sólidos, que contengan considerable cantidad de sangre, tal como el agar sangre corriente, el que nosotros lo hemos usado con el 20-30 por ciento de sangre de conejo. Corrientemente durante el primer trasplante en el agar sangre, las colonias originales procedentes del medio semisólido de Noguchi, se desarrollan en el mismo sitio donde han sido depositadas. A los 4-5 días se pueden distinguirlas a manera de manchitas circulares de superficie ligeramente convexa, blanquecinas y con aspecto mucoide, que suelen alcanzar hasta 1.5 mm. de diámetro y fuera de las cuales por lo general no se encuentran organismos libres; estas colonias son un tanto más pronunciadas que las de la B. bacilliformis. Con las sucesivas resiembras en el agar sangre este aspecto cambia notablemente, obteniéndose al final un desarrollo abundante y general a toda la superficie inoculada. Entonces, debido a la presencia de numerosísimas colonias pequeñas, durante los primeros días la superficie sólida del medio ofrece un aspecto finamente granular y, posteriormente, por lo general a partir de los 12 ó 15 días en cultivos incubados a 28ºC., las colonias se van haciendo confluentes al mismo tiempo que adquieren un color blanquecino, observándose al final que la superficie donde ha tenido lugar el desarrollo parece estar cubierta por una fina capa blanquecina de superficie ligeramente rugosa. En tales cultivos el microorganismo se emulsiona con gran facilidad, y al microscopio se observan solamente organismos libres. En este estado el germen conserva todavía su infectividad. Para el medio ZWF (ZINSSER, WEI y FITZPATRICK, 1937) hemos empleado embrión de ratón, el que convenientemente triturado se mezclaba con algunos gotas de cultivo. Al colocar el tejido así inoculado sobre la superficie del agar, se le lavaba ligeramente en el líquido de condensación. La multiplicación de la G. canis en este medio es tanto intracelular como también extracelular. En frotis coloreados con Giemsa se ven, al lado de masas compactas de organismos que se hallan fuera del tejido, células notablemente distendidas (Fig. 14) por el desarrollo intracelular del germen, lo que es mucho más marcado y abundante que en la Bartonella bacilliformis (PINKERTON y WEINMAN, 1937). Por medio de cortes (fijación Regaud, coloración Giemsa) se puede observar que la multiplicación del parásito es tan intensa en determinados tejidos, que algunas veces las células llegan a destrozarse, rebasando aparentemente los organismos hasta dar la apariencia de colonias compactas (Fig. 13). Por lo general el líquido de condensación del medio contiene sangre y células libres procedentes del embrión. En frotis hechos de este líquido se ven tanto organismos individuales como también colonias que al parecer se han desarrollado de manera extracelular. Morfología. En cultivos tiernos coexisten principalmente formas bacilares y cocoides, pero siempre predominando las primeras. Las bacilares varían en sus dimensiones entre 1-3 micras de longitud por 0.2-03 micras de ancho y las cocoides tienen un diámetro medio de 0.2-0.3 micras. El microorganismo es Gram-negativo y con el Giemsa se colorea de rojizo violeta semejante a los cultivos de la B. bacilliformis. En cultivos en agar sangre de menos de 10 días, especialmente durante las primeras resiembras, algunas veces se pueden observar pequeñas cadenitas de 4-10 organismos. Es frecuente también encontrar formas especiales, por lo general de contornos circulares y con un diámetro que varía entre O.4-4.0 micras (Figs. 15 y 17), enteramente comparables a las formas descritas con el nombre de "discos" en la Bartonella Tyzzeri por WEINMAN Y PINKERTON (1938). Corrientemente se colorean de manera uniforme, dando la impresión de que se trata de una masa compacta y, al microscopio de campo oscuro, se les observa también con el contorno brillante y el centro opaco (Fig. 19); estas formas corrientemente se hallan mezcladas con las bacilares (Fig. 15). A medida que los cultivos envejecen las formas bacilares van desapareciendo ostensiblemente, llegando después de la tercera o cuarta semana a no encontrarse más que las cocoides. Estas, a su vez, parece que son cada vez más chicas, observándose a las 6-8 semanas casi como simples granulaciones, no obstante lo cual el cultivo conserva su capacidad infectante (logramos infectar perros con cultivos de tres meses, del mismo modo que hemos obtenido resiembras positivas hasta los cinco meses). OBSERVACIONES EXPERIMENTALES Infección experimental. Se puede infectar experimentalmente al perro, tanto normal como esplenectomizado, con la Grahamella canis, cualquiera que sea la edad del animal. Nosotros obtuvimos resultados positivos en seis de nueve casos ensayados, en todos los cuales usamos cultivos en agar sangre; la edad de los cultivos, variaban entre dos semanas y tres meses. En ninguna ocasión se hizo inoculaciones con sangre infectada. La observación de los animales inoculados se llevó a cabo por medio de hemocultivos y extensiones de sangre. En el caso de los frotis, cada lámina coloreada ya sea con Giemsa o con May-Grünwald Giemsa, se observaba a inmersión un tiempo mínimo de 40 minutos. La infección experimental puede ser algunas veces de duración relativamente larga. Por medio de hemocultivos nos ha sido posible revelarla en una ocasión hasta los ocho meses y medio de la inoculación (véase el perro Nº 1, en el cuadro 11). La intensidad, determinada por el número de eritrocitos parasitados que se contaban en los 40 minutos de observación, varió notablemente según la condición del animal, del mismo modo que el número medio de organismos que se encontraban parasitando los glóbulos. Para observar los organismos en la sangre periférica se necesitó de un período mínimo de 10-15 días(probable período de incubación), después de los cuales y por un espacio de tiempo variable según los casos de dos a doce semanas, se les siguió encontrando en los frotis. Después de este tiempo no se logró verlos en las extensiones de sangre, no obstante que los hemocultivos seguían ofreciendo resultados positivos durante varios meses más. De manera general al principio de la infección es reducido el número de organismos que se ven en los eritrocitos, no habiéndose encontrado más de cuatro a seis hasta después de dos semanas de la inoculación. Si son sólo uno o dos, lo que sucede corrientemente durante los primeros días, es frecuente observarlos en los bordes de los glóbulos. Organismos libres en el plasma han sido vistos únicamente durante los tres primeros días siguientes a la inoculación, en los casos que se usó gran cantidad de inóculo. Efecto de la esplenectomía. Los resultados hasta ahora obtenidos parecen indicar que la extracción del bazo tendría alguna influencia en la infección del perro por la G. canis, especialmente en lo que se refiere a la intensidad del parasitismo. Juzgados simplemente a base de los hemocultivos, como ya se ha dicho, seis de los nueve perros inoculados en forma experimental ofrecieron resultados positivos; pero en cuanto a los frotis de sangre de éstos, se notó que casi únicamente los esplenectomizados mostraban eritrocitos parasitados en la sangre periférica. A dos perros no se les extrajo el bazo en ningún momento y fueron observados tan sólo por espacio de 8 y 25 días, respectivamente, de la inoculación, sin poder ver al parásito en las extensiones de sangre. Solamente en un animal bastante tierno (44 días de edad al momento de la inoculación), aún no esplenectomizado, se encontró grahamellas en frotis, a los 10 días de la inoculación; durante los 64 días siguientes fué observado cuidadosamente, sin volver a ver al parásito, realizándose entonces la esplenectomía. A los 28 y 32 días, respectivamente, de haberse extirpado el bazo, de nuevo se hallaron algunos glóbulos parasitados. Parece que en este caso la esplenectomía motivó la reaparición del germen en la sangre periférica. El cuadro II muestra algunos pormenores observados en los seis casos que se logró la infección experimental del perro. Como se observa en el cuadro anterior, de los cuatro perros esplenectomizados dos lo fueron antes de la inoculación (1 y 2) y dos después de ella (9 y 13); en los cuatro se llegó a ver la G. canis en las extensiones de sangre. En los inoculados después de la esplenectomía los glóbulos parasitados fueron más abundantes, del mismo modo que mayor el número de organismos que se veían en ellos. De los inoculados después de la esplenectomía uno era bastante tierno (4-6 semanas de edad), siendo éste en el que se notó el mayor parasitismo que hemos observado. Reinfección. Nos ha sido imposible reinfectar un perro que había pasado su infección. Este animal fué reinoculado a los 7 meses de haber dejado de mostrar grahamellas en la sangre, durante los cuales se le hizo cuatro cultivos, resultando los dos primeros contaminados y negativos los otros dos. Durante los cuatro meses siguientes a la reinoculación fué observado cuidadosamente, sin poder recoger el germen inoculado en los nueve cultivos que se le hiciera. Resultados idénticos hemos obtenido con dos perros que se mostraron resistentes a la primera inoculación con G. canis. En estos casos fueron negativos aún los cultivos llevados a cabo al día siguiente de la reinoculación. Infección mixta de Grahamella canis y Bartonella canis. Parece no existir interferencia entre la G. canis y la B. canis, ya que es fácil obtener infecciones mixtas de ambos gérmenes. Perros infectados durante meses con G. canis, al inyectárseles sangre parasitada con bartonella hacen su infección para este organismo; del mismo modo perros que, a juzgar por los hemocultivos negativos que ofrecen, se supone que ya han pasado su infección a grahamella. No hemos puesto atención especial a fin de observar si en tales infecciones mixtas el curso de la bartonellosis varía o se altera en algún sentido. Cuando se tiene algo de experiencia, en las infecciones mixtas hasta cierto punto es posible diferenciar ambos organismos, simplemente a base de su morfología. Pero lo mas seguro es recurrir al hemocultivo para averiguar la presencia de la grahamella, del mismo modo que usar los arsenicales para eliminar la bartonella, teniendo así la seguridad que ambos microorganismos pueden infectar simultáneamente a un mismo perro. Susceptibilidad de otros animales. Además de perros, con la G. canis hemos inoculado también ratas y ratones blancos, obteniendo en ambos casos resultados negativos. Seis ratas y cinco ratones normales, de 24.0 y 8.5 grs. de peso, respectivamente, fueron inoculados por vía intra-peritoneal con cultivo de la grahamella. En todos estos animales se hicieron frotis y cultivos con sangre del rabo a los 5 y 10 días, de la inoculación; más o menos la tercera parte de estos cultivos se contaminaron, mientras que los restantes fueron negativos del mismo modo que los frotis. A los 12 días se sacrificaron las ratas y a los 18 los ratones, haciéndose entonces tanto cultivos como frotis con sangre del corazón, todos los cuales también fueron negativos. Supervivencia in vitro. Si se extrae sangre de un perro infectado con G. canis y se la conserva citratada, el microorganismo sobrevive y se desarrolla, semejante a lo que sucede con la Bartonella bacilliformis. Como los glóbulos parasitados son en extremo escasos, al menos durante la primera semana de extraída la sangre es difícil constatar microscópicamente la supervivencia del germen, lo que se consigue con facilidad valiéndose del cultivo. Después de los 10-12 días ya se ven en los frotis pequeñas colonias como también algunos organismos libres, haciéndose el desarrollo más manifiesto a las 3-4 semanas. Las colonias (Fig. 18) por lo general son más chicas y menos compactas que las que se observan en los cultivos hechos en el medio semisólido de Noguchi. La sangre se puede conservar ya sea a 28ºC. o a la temperatura del laboratorio. No hemos podido observar que in vitro el germen invada los eritrocitos, DISCUSION El microorganismo que describimos con el nombre de Grahamella canis n. sp. posee características morfológicas y biológicas por medio de las cuales se le puede diferenciar con precisión de la Bartonella canis, parásito con el que se podría confundir. Entre estas características se encuentra la facilidad de su cultivo, su notable resistencia in vitro, la falta aparente de patogenecidad y la regularidad de su morfología, más o menos constante a lo largo de todo el curso de la infección. Estas dos últimas ya han sido observadas en diversas especies de grahamellas llegándose a considerarlas, al lado de otras, como peculiaridades del género, entretanto que el cultivo de las mismas es todavía reciente (Tyzzer. 1941). El hecho de que la Grahamella canis parasite con mayor intensidad en los animales esplenectomizados sería contrario a lo que se ha creído hasta ahora en relación con las grahamellas y, por consiguiente, aparentemente lo acercaría a las bartonellas zoóticas. Sin embargo creemos que la extracción del bazo en el perro no tiene para la G. canis tanta importancia como para la B. canis, siendo su efecto comparable más bien a la mayor susceptibilidad del hamster por la Leishmania donovani (WANG y CHUNG, 1940), a la reaparición del Cytoecetes microti en la sangre periférica de varios roedores pequeños (TYZZER, 1938), a la alteración del ciclo normal de reproducción del Trypanosoma lewisi en la rata (TALIA-FERRO, CANNON y GOODLOE, 1931), etc., observados por medio de la esplenectomía. Compara la Grahamella canis con las demás especies de grahamellas es seguramente la que parasita en menor grado los eritrocitos al estado natural, así como la que ha ofrecido infecciones experimentales con mayor facilidad. Desde que en las infecciones naturales por lo regular no se le encuentra en los frotis corrientes de sangre, es explicable que no haya sido observada por tantos investigadores que han trabajado en la bartonellosis del perro. Aunque la presencia de la G. canis parece que no alteraría en forma apreciable el curso de la bartonellosis en el perro, podría sin embargo motivar errores especialmente al apreciar los resultados de ensayos sobre el cultivo de la B. canis. Además, se ha señalado que en los últimos períodos de la infección experimental del perro por la bartonella, suelen presentarse algunas veces solamente escasos glóbulos parasitados, los que contienen por lo regular un elevado número de bacilos bastante uniformes en cuanto a su forma y dimensiones. Es posible que en algunos de estos casos esté presente también la grahamella, la que en tales circunstancias sería sumamente difícil de identificarla simplemente a base de su morfología. NOTAS 1 Raramente parece que por efecto mecánico del frotis, algunos organismos se reunen o juntan de tal manera que a primera vista parecen formas especiales, como la que expusiéramos en nuestra nota preliminar (Herrer, 1942). 2 Las figuras 1, 14 y 15 ya han sido publicadas en una nota preliminar (Herrer, 1942). BIBLIOGRAFIA 1. E. BRUMPT : C. R. Acad. Sci., 187, p. 1079, 1928. [ Links ] 2. Q. M. GOMAN : Proc. Soc. Exp. Biol. and Med., 47, p. 329, 1941. [ Links ] 3. A. HERRER : Revista de Medicina Experimental, Lima, t. 1, p. 84, 1942. [ Links ] 4. H. PINKERTON y D. WEINMAN : Proc. Soc. Exp. Biol. and Med., 37, p. 587, 1937. [ Links ] 5. D. WEINMAN y H. PINKERTON : Ann. Trop. Med. and Parsit., 32, p. 215, 1938. [ Links ] 6. E. E. TYZZER : Parasit., 30, p. 242, 1938. [ Links ] 7. E. E. TYZZER : Proc. Nac. Ac. Sci., 27, p. 158, 1941. [ Links ] 8. C. W. WANG y H. L. CHUNG : Proc. Soc. Exp. Biol. and Med., 44, p. 35, 1940. [ Links ] 9. W. H. TALIAFERRO, P. R. CANNON y S. GOODLOE : Am. Jour. Hyg. 14, p. 1, 1931. [ Links ] 10. H. ZINSSER, H. WEI y F. FITZPATRICK : Proc. Soc. Exp. Biol. and Med., 37, p. 604, 1937.