Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Medicina Experimental y Salud Publica
versión impresa ISSN 1726-4634
Rev. perú. med. exp. salud publica v.11 n.1-2 Lima dic. 1957
Curvas standard y determinación de potencia antibiótica.
Julio Morales1; Carmela Velazco1
1 División de Control del Instituto Nacional de Salud Pública, Lima, Perú.
SUMARIO
Presentamos el método de la placa-disco-cultivo adaptado con ligeras variantes para la determinación de curvas standard y certificación de potencia antibiótica.
Hemos estandarizado por este método la sensibilidad de nuestras cepas frente a antibióticos proporcionados por el Food and Drug Administration. Con estas cepas así estandarizadas, efectuamos la determinación y certificación de potencia antibiótica de los productos que llegan a la División de Control Técnico del I.N.S.P. en las diferentes formas de presentación, solos o asociados a otras drogas.
Recomendamos este método por considerarlo con menos factores de error que otros.
SUMMARY
The placa-disco-cultivo method, for antibiotic testing, has been adopted, with slíght modifications, by the Instituto Nacional de Salud Pública for determining standard curves and certífication of antibiollic potency.
The sensitively of Institute strains of bacteria were standardízed against antibiotics supplied by the Food and Drug Administration, U. S.A. Using these standards, samples of antibíofics submitted to the 1. N.S.P. for potency, are being routinely performed.
It is believed that the recommended modifications to the test make the technique liable to fewer errors.
El trabajo de valoración de potencia antibiótica y constatación de la exactitud en las concentraciones de droga declarada en cada uno de los numerosos productos que con antibióticos aislados o combinados llegan a la División para su análisis, nos han llevado a seleccionar cepas bacterianas y determinar las curvas de sensibilidad antibiótica en cada caso, para lo cual hemos empleado el método que denominamos placa-disco-cultivo, con diluciones en progresiones aritmética, este último procedimiento comparado con los recomendados por diversos autores, (COLLINS y Col., 1954; CANDLER Y SHAW, 1946; JACKSON y FINLAND, 1951; ROGER y Col., 1955) lo consideramos con menos factores de error por proporcionar lecturas mucho más precisas en un menor número de placas (WELCH, 1956). Creemos de interés dar a conocer esta técnica a fin de que sea ensayada por cualquier persona que desee verificarla.
Las cepas bacterianas que hemos utilizado en estas pruebas han sido todas ellas aisladas de variados cuadros clínicos e identificadas por los métodos usuales de laboratorio; a todas ellas les hemos probado el grado de sensibilidad (JACKSON y FINLAND, 1951) o resistencia frente a 14 antibióticos y 6 quimioterápicos, (MORALES y MIRANDA, 1954; MORALES, 1957); posteriormente al disponer de antibióticos standard enviados por el Food and Drug Administration de Washington U.S.A., procedimos a estandarizar las curvas de sensibilidad de nuestras cepas, las cuales nos han servido de base para la valoración de la potencia antibiótica de los numerosos preparados que informamos.
MATERIALES Y MÉTODOS
Materiales. Placas Petri con agar triptosa; discos de papel de filtro de 1 mm. de espesor y 6 mm. de diámetro esterilizados y capaces de absorver 0.01 ml.; frascos apropiados para las diluciones y soluciones buffer estériles del pH indicado para cada caso; cepas bacterianas de sensibilidad conocida, recientemente transplantadas y emulsionadas en suero fisiológico a una concentración de 600 millones por ml., una pinza de extremo afilado y pipetas estériles.
Método. Después de una serie de estudios comparativos empleando discos, cilindros y dilución en tubos (OSWALD y RANDALL, 1945; COLLINS y Col., 1954) hemos elegido para nuestras pruebas el método de la placa-disco-cultivo con diluciones del antibiótico en progresiones aritmética y geométrica, empleando solamente dos placas para cada concentración.
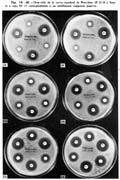
Determinación de la curva standard. Establecidas las concentraciones deseadas, ya sea en microgramos o unidades por ml. según el tipo de antibiótico, se procede a hacer las diluciones manteniendo en todo momento la esterilidad. Las placas de cultivo que previamente han sido controladas a 370C. son inoculadas con la suspensión bacteriana elegida, cultivo de 24 horas, cubriendo toda la superficie y retirando el exceso de inóculo; luego son colocados los discos imbibidos con las distintas concentraciones de antibiótico, en la superficie de las placas a un radio de 2.8 cm. y a un ángulo de separación de 600. Las placas son incubadas durante 20 horas a 350 ó 370C., después de lo cual se hace la lectura de las zonas de inhibición expresando el diámetro en milímetros.
Como ejemplo vamos a determinar la curva standard de la Penicilina (F. D. A. ) con la cepa N9 17, Correspondiente a un estafilococo coagulosa positivo, sensible a esta droga, para lo cual se hacen diluciones con fosfato buffer de pH 6.0 hasta poder llegar a obtener concentraciones de 0.02, 0.03, 0.05, 0.1, 0.2, 0.3, 0.4 unidades por ml.
Se utiliza un total de 12 placas para cada curva, o sea dos para cada concentración con seis lectura, a excepción de la de 0.1 unidad que la utilizamos corno punto de referencia y.,va incluida en todas las placas proporcionándonos 36 lecturas de la siguiente manera (GROVE y col., 1955): en cada una de las placas sembradas con el germen elegido son colocados 3 discos con 0. 1 u. intercalados con 3 discos de cada una de las otras concentraciones mencionadas, de este modo tendremos 36 determinaciones para el punto de referencia (0. 1 u. ) y 6 lecturas para cada una de las otras concentraciones (Láminas I y II) . Después de una incubación de 20 horas a 370C. se hace la lectura midiendo los diámetros de las zonas de inhibición. Se determina primero el promedio de las lecturas del punto de referencia (0. 1 u. ) y luego las lecturas promedio de cada una de las otras concentraciones. El promedio obtenido de las 36 lecturas de 0. 1 u. sirve como punto de referencia para corregir el valor promedio de cada una de las otras lecturas, para lo cual se establece primero el factor de corrección de la siguiente manera: determinado el valor promedio de las 36 lecturas de 0.1 u. que para este caso de la Penicilina fué 19.2 mm., se procede a medir separadamente en cada grupo de dos placas el diámetro de inhibición de 0. 1 u., si se toma por ejemplo las placas de 0. 3 u. el promedio parcial de 0. 1 en ellas es de 18.1 mm., este promedio parcial sirve para establecer la relación con el promedio total de las 36 lecturas y obtener el factor de corrección que puede resultar con signo positivo o negativo; en nuestro ejemplo se tiene:
En este caso siendo el valor promedio total mayor que el promedio parcial, se resta de aquél y la diferencia es el factor de corrección con signo positivo o sea + 1 . 1 .
Cuando el valor promedio parcial de la lectura de las dos placas resulta mayor que el valor promedio total de 0. 1 u., la diferencia es el factor de corrección con signo negativo; por ejemplo: en la placa de la concentración 0.4 u. (Figs. 6A y 6B):
El factor de corrección que se obtiene en cada una de las concentraciones, se suma o resta al valor promedio del diámetro de inhibición para cada concentración, resultando de esto una cifra que constituye el punto corregido de la curva de dicha concentración; así para la placa de 0.3 u. (Figs. 5A y 5b):
Y para la concentración de 0.4 u. (Figs. 6A y 6B), se tiene:
Anotamos estos valores corregidos de cada una de las concentraciones incluyendo el promedio del punto de corrección en un papel semilogarítmico de doble ciclo, colocando la concentración en unidades como ordenadas y el diámetro de la zona de inhibición en mm. como abscisa, uniendo estos puntos se tiene la curva standard de la cepa 17 como se puede apreciar en la figura 7.
Certificación de la potencia antibiótica de los productos que llegan a control. Para la certificación de la potencia cuantitativa del antibiótico contenido en determinado producto, se procede a hacer la extracción y diluciones con soluciones apropiadas en cada caso de acuerdo con las regulaciones y métodos de ensayo que establece el Food and Drug Administration (GROVE y COI., 1955) y la U.S.P. 1955.
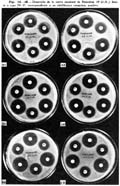
Como ejemplo citaremos los resultados obtenidos en un producto recientemente examínado que declaraba 400,000 unidades de penicilina (Pronapen, Fig. 8).
El contenido del frasco se diluye convenientemente con fosfato buffer pH 6.0 hasta un volumen que permita obtener una concentración de 100 unidades por mL, a partir de la cual por diluciones sucesivas se obtienen las concentraciones equivalentes a 0.02, 0.03, 0.05, 0.1, 0.2, 0.3, 0.4 unidades por mI.; luego se procede a realizar la prueba como lo hemos descrito para la determinación de la curva standard (Fig. 7).
Se obtienen las lecturas promedio de las zonas de inhibición del standard y del problema, se procede al trazado de las curvas obtenidas en papel semilogarítmico de doble ciclo; cuando el producto ensayado tiene mayor concentración que la que declara, el trazado de la curva estará siempre a la derecha del standard como en este caso (Fig. 8); si no tiene la concentración que declara, la curva estará situada a la izquierda del standard (Fig. 9, Cepa 3).
La estimación del porcentaje de actividad se obtiene comparando los resultados del problema y del standard. Así por ejemplo para la concentración 0.1 unidad, el standard muestra su actividad con un diámetro de 19.2 mm. y el problema con un diámetro de 20.1 mm.
Cálculo de potencia. Si consideramos 19.2 mm. como 100% de actividad; 20.1 mm. a cuánto corresponderá:
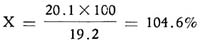
Con el objeto de obtener mayor precisión se puede proceder a interpolar todos los demás puntos de la curva problema con el standard y sacar un porcentaje promedio. En nuestro caso, interpolando los puntos centrales, el porcentaje promedio para el producto de 400,000 unidades, fué de 105.1 por ciento. Los requerimientos mínimos de potencia para penicilina de esta concentración determinan que deben tener no menos del 85 por ciento de actividad. En consecuencia el producto controlado al tener 105.1 por ciento de actividad reúne las condiciones requeridas y contiene un exceso sobre las unidades que declara.
Las figuras 9 y 10 corresponden a las curvas standard de los antibióticos cloramfenicol y tetraciclina (KOCK, 1955) realizadas con cuatro cepas de distinto grado de sensibilidad y que pueden ser usadas para la determinación y certificación de potencia de los antibióticos mencionados en cualquiera de sus formas de presentación.
Igual procedimiento hemos seguido con otros antibióticos, cuyos resultados serán motivo de una comunicación posterior.
REFERENCIAS
1. COLLINS, ANNE M., CRAIG, GRACE, ZAIMAN, ELISABETH y Roy, T. E. A comparison between disk-plate and tube-dilution methods for antibiotic sensitivity testing of bacteria. Canad. J. publ. Hlth. 45: 430-439. 1954 [ Links ]
2. CHANDLER, VELMA y SHAW, R. D. Dropping device for cylinder plate assay of penicillin. Science 104: 275. 1946 [ Links ]
3. FISCHBACH, H. y LEVINE, J. The identification of the antibiotics. Antibiot. and Chemother. 3: 1159 - 1169. 1953 [ Links ]
4. GROVE, D. C. y RANDALL, W. A. Assay methods of antibiotics. A laboratory manual. New York, Medical Encyclopedia Inc. 238 p. 1955 [ Links ]
5. JACKSON, G. G. y FINLAND, M. Comparison of metheds for determining sensitivity of bacteria to antibiotics in vitro, Arch. intern. Med. 88: 446-460. 1951 [ Links ]
6. KOCH, MARIE L. An evaluation of the in vitro antibacterial activity of the tetracyclines. ..Antibiot. and Chemother. 5: 340-344. 1955 [ Links ]
7. MORALES, S. J. y MIRANDA, H. La importancia de la determinación del espectro antibiótico frente al problema de la resistencia bacteriana. Arch. Perú. Patol, Clín. VIII: 167-176. 1954 [ Links ]
8. MORALES, J. Importancia clínica de la determinación del espectro antibiótico y el problema de la resistencia bacteriana. Rev. Pat. Clín. I: 30-38. 1956 [ Links ]
9. OSWALD, ELIZABETH J. y RANDALL, W. A. A cylinder guide for use in plate assay of penicillin. Science 101: 99-100. 1945 [ Links ]
10. THE PHARMACOPEIA OF THE UNITED STATES OF AMERICA. FIFTEENTH REVISION (U.S.P. XV) Penicillin microbial assay. Easton, Pa., Mack Printing Co. pp. 856-857. 1955 [ Links ]
11. ROGERS, M. A., RYAN, W. L. y SEVERENS, J. M. A new method for the rapid determination of bacterial sensitivity. Antibiot. and Chemother. 5: 382-385. 1955 [ Links ]
12. WELCH, H. Antibiotic sensitivity testing (Editorial). Antibiotic. and Chemother. 6: 321-323. 1956 [ Links ]