Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Peruana de Medicina Experimental y Salud Publica
Print version ISSN 1726-4634
Rev. perú. med. exp. salud publica vol.14 no.1 Lima Jan./jul. 1997
ARTÍCULOS CIENTÍFICOS
Vigilancia de la resistencia a los medicamentos antituberculosos en el Perú, 1995-96
Vásquez C. Lucy1; Asencios S. Luis1; Quispe T. Neyda1; Díaz V. Susana1; Carrillo P. Carlos2,3; Portocarrero C. Jaime4; Suárez A. Pedro4,5; Canales Roberto4; Alarcón Edith4; Yi Chu Augusto6; Agapito P. Juan7; Sabogal T. Iván7 y Torres T. Alfredo8.
1 Laboratorio de Microbacterias, División de Bacteriología, Centro Nacional de Laboratorios de Salud Pública. Instituto Nacional de Salud, A.P. 451 Lima, Perú.
2 Jefatura, Instituto Nacional de Salud, A.P. 451 Lima, Perú.
3 Departamento Académico de Microbiología, Universidad Peruana Cayetano Heredia, A.P. 451 5045 Lima 100, Perú.
4 Programa Nacional de Enfermedades Transmisibles - Control de la Tuberculosis, Ministerio de Salud, Lima Perú.
5 Dirección, Programa Nacional de Enfermedades Transmisibles - Control de la Tuberculosis, Ministerio de Salud, Lima, Perú.
6 Hospital Cayetano Heredia, Lima, Perú.
7 Hospital Daniel A. Carrión, Callao, Perú.
8 DISURS Lima - Sur, Ministerio de Salud, Perú.
RESUMEN
La tuberculosis es un importante y serio problema de salud en el Perú. La resistencia antibiótica constituye un problema emergente de magnitud no totalmente definida. A fin de determinar la prevalencia de la resistencia del M. tuberculosis a los medicamentos antituberculosos e iniciar un estudio de vigilancia, se efectuó un proyecto multicéntrico en 31 subregiones de salud del país, que incluyó muestras de esputo de pacientes diagnosticados de TB, con baciloscopía positiva procedentes de 814 hospitales y centros de salud. Se completó una muestra de 1958 pacientes nuevos y antes tratados de quienes se obtuvo muestras de esputo, las cuales se cultivaron en los medios de Lowenstein-Jensen y Ogawa y los aislamientos fueron sometidos a pruebas de sensibilidad a los medicamentos anti TB por el método de las proporciones.
Los resultados fueron: resistencia a uno o más medicamentos en el 15,4% de 1500 casos de TB no tratados previamente (NT), y en el 36,0% de 458 casos ya tratados (AT). La multirresistencia (MR) afectó a 2,4% de los pacientes NT y a un 15,7% de los AT. En 9 casos (0,4%) se reportó positividad para HIV, de los cuales seis no tratados (NT) fueron sensibles a los medicamentos anti TB y los otros 3 ya tratados (AT) un (1) caso fue sensible y 2 resistentes de éstos uno de ellos presentó MR.
El estudio permitió el fortalecimiento de la Red Nacional de Laboratorios en TB de, país, contribuyendo a la seguridad y a la oportunidad en el diagnóstico y control de la enfermedad.
Palabra clave: Resistencia a medicamentos, Tuberculosis.
ABSTRACT
Tuberculosis is an important and serious health problem in Peru and resistance to antituberculous drugs is an emergent problem of undetermined magnitude.
A multicentric project was implemented with 31 Health Subregional Offices to assess the prevalence of M. tuberculosis resistant to antituberculous drugs and to begin a surveillance study. This surveillance study included samples obtained from patients in whom TBC was diagnosed from 814 hospitals and health centers.
The sputum sample was cultured in Lowenstein-Jensen and Ogawa Media and the isolations were submitted to sensitive tests to anti TBC Medicines.
Resistance to one or more drugs was found in 15,4% of 1 500 previously untreated patients (NT) and in 36,0% of 458 of previously treated patients (AT). Mult1drug resistance (MDR) affected 2,4% of NT and 15,7% of AT cases, HIV positivity was recorded in 9 patients (0,4%), one of them presented a MDR isolate.
The study strenghthened the National Laboratory TBC Network's security and opportunity capabililities for diagnostic and control of TB.
Key word: Drug resistence, Tuberculosis.
INTRODUCCIÓN
Se ha demostrado ampliamente que la eficacia del esquema del tratamiento acortado de la tuberculosis (TB) -que incluye isoniazida (H), rifampicina (R) y pirazinamida (Z), usualmente asociadas con etambutol (E)- es cercana al 100%. La principal causa del fracaso es la presencia de la resistencia simultánea del Mycobacterium tuberculosis a H y a R, conocida como multirresistencia (MR)1 que puede estar también acompañada de resistencia a otros medicamentos.
La Organización Mundial de la Salud ha recomendado el establecer la vigilancia de la resistencia del M. tuberculosis a los fármacos antituberculosos en los distintos países. Se recomienda, en primer lugar, determinar la prevalencia de la resistencia inicial (RI) y de la resistencia adquirida (RA) por medio de encuestas nacionales. Estos estudios deben ser realizados en una muestra representativa de los pacientes TB, empleando métodos y procedimientos normalizados, y un sistema de control de calidad, a fin de obtener resultados confiables y comparables entre las distintas regiones del mundo.2,3
En la década de los 80, en un promedio histórico, sólo el 50% de las personas que eran diagnosticadas con TB en Perú culminaban su tratamiento, y eran consideradas curadas.4,5,6 Los pacientes no curados pasaban a engrosar el número de fuentes de infección, muchas de ellas ya con bacilos TB resistentes a uno o más fármacos.
En efecto, en un estudio sobre la resistencia inicial (RI) a medicamentos antituberculosos, realizado en una muestra de cerca de mil pacientes bacilíferos, provenientes de 10 países de América Latina y el Caribe, se halló en el Perú un 43% de cepas resistentes de un total de 75 casos, porcentaje significativamente más alto que la media de 16,8% hallada en ese estudio.7 No existe información disponible a nivel nacional, sobre los porcentajes de la resistencia adquirida (RA), ya sea en fracasos terapéuticos o en recaídas.
La situación comenzó a cambiar a partir de 1990, cuando se organiza y comienza a operar en Perú un moderno Programa de Control de Tuberculosis, con cobertura nacional. Así el porcentaje de Centros de Salud que realizan actividades de control de TB se ha incrementado en los últimos años. En 1993 un 67,6% de 4464 establecimientos de salud realizaban actividades de control de TB; en 1994 ese porcentaje fue del 70% y en 1995 alcanzó al 91% de los 5789 establecimientos de salud existentes en todo el territorio del Perú.8
El número de laboratorios locales que participan en las acciones de control de la TB se ha incrementado en un 93% durante el período 1991-1995; de 425 laboratorios que efectuaban baciloscopias en 1991, se ha llegado a un total de 823 laboratorios en 1995. Los laboratorios intermedios o Regionales que hacen cultivos para diagnóstico de TB han aumentado en 254% para el mismo período, llegando a 46 en Diciembre de 1995.8
La búsqueda de pacientes de TB entre los pacientes sintomáticos respiratorios que acuden a los servicios de salud continúa en expansión. Se observa también una mejoría sustancial en la calidad y oportunidad del registro y de la información, así como del seguimiento de los pacientes en tratamiento mediante la baciloscopía. Ello ha permitido obtener indicadores tales como la proporción de sintomáticos respiratorios examinados en relación a los identificados, que se elevó desde 36% en 1991 a casi 90% en 1995. Esto significó un incremento, de 290,647 baciloscopías de diagnóstico en 1991, y a 817,036 en 1995.7
Se observó asimismo un incremento en las baciloscopías realizadas entre 1993 y 1995 y el total de casos de TB con baciloscopías positivas disminuyó en un 13,5%.
Durante 1995 se han diagnosticado y tratado gratuitamente 48 074 pacientes de TB en todo el país, en las diversas instituciones del Sector Salud con una tasa de morbilidad: 208,7 por 100 0008.
El PCT del Perú ha empleado entre 1990 y 1995, un esquema acortado único: 2(HRZE)6 4(HR)2, tanto para pacientes aparentemente no tratados (NT) como para los antes tratados (AT). A partir de 1996 se utilizan 3 esquemas acortados y diferenciados de acuerdo a la carga bacilar, localización y antecedentes de tratamiento, según las recomendaciones de la OMS.8
Los estudios operacionales de cohortes de tratamiento, realizados por el PCT del Perú, han demostrado una eficacia del 98% bajo el esquema único. Los fracasos a este esquema pueden estar en relación a la resistencia simultánea a H y R, ya sea sola o asociada a otros fármacos anti TB (multiresistencia).
La eficiencia evaluada a través del estudio de cohorte de tratamiento mejoró de 74,1% para la cohorte del primer semestre de 1991, a 87,7% en el primer semestre de 1995; esto significa una mejoría de 13,6% en este indicador en el período indicado y de 37,7% en relación a 1989/90.8
Teniendo en cuenta estos cambios en la situación epidemiológica, en la organización del tratamiento, en los indicadores operacionales ocurridos en los últimos 5 años y las recomendaciones de la OMS, se decidió efectuar una encuesta nacional sobre las RI y RA a fármacos anti TB en el Perú. Los objetivos de este estudio fueron los siguientes:
1. Determinar la prevalencia de la resistencia de Mycobacterium tuberculosis a los medicamentos anti TB en el Perú.
2. Iniciar la vigilancia de la resistencia a fin de establecer su tendencia.
3. Fortalecer la Red Nacional de Laboratorios en Tuberculosis.
MATERIAL Y MÉTODOS
Localización del estudio: Perú, Sud América. Área: 1285 216 KM2. Población en 1995: 23 029 603 habitantes, 62% de ellos con más de 15 años de edad, y 70% de población urbana. Aproximadamente el 30% de los habitantes del Perú viven en el área de Lima-Callao.
Definiciones básicas2,3: Un caso de RI se define como un paciente nuevo de TB, sin historia de tratamiento previo (NT), de quien se aisla M. tuberculosis resistente a uno o más medicamentos.
Un caso de RA es un paciente antes tratado (AT) de quien fue aislado M. tuberculosis resistente a uno o más medicamentos. Integran este grupo las recaídas y abandonos recuperados.
Una cepa multirresistente (MR) es aquella resistente, a la Isoniazida(H) y a la Rifampicina(R).
Diseño de la muestra: Se utilizó: (a) una prevalencia estimada de la resistencia inicial a H de 5,5%; (b) el universo a estudiar se basó en el numeró de pacientes con TB pulmonar y baciloscopía positiva, diagnosticados en 1994; (c) un error alfa de 0,05; (d) una precisión en el estimado fijado en 20%, medido por los intervalos de confianza (IC), y (e) las condiciones operacionales bajo las cuales el estudio sería realizado.9
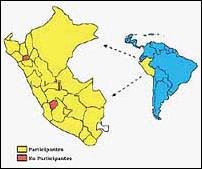
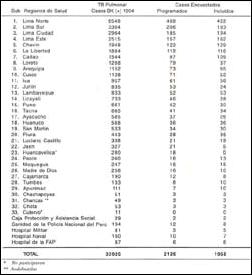
El tamaño de la muestra se fijó en 1718 pacientes, que fue luego ajustada tentativamente a un total de 2 126. Ese número representa el 6,3% de los 33 925 casos bacilíferos de TB diagnosticados en 1994 en el Perú. Esta muestra incluyó a 5 subregiones de Lima y Callao, con la mayor densidad de población del país, y a 26 subregiones en provincias, El 98% de la población peruana habita en estas 31 subregiones y allí se notifica el 99% de los casos de TB. Dos(2).
Los pacientes fueron diagnosticados e ingresados en el estudio, en 814 hospitales y centros de salud de esas 31 subregiones, en número asignado en base a su notificación anual (Tabla 1)
Figura 1. Mapa del Perú, regiones y Subregiones que participaron
en el Estudio de Vigilancia de la Resistencia a los medicamentos
Antituberculosos en el Perú 1995-1996
Tabla 1. Vigilancia de la resistencia a los medicamentos
antituberculosos en el Perú, distribución regional
y subregional de pacientes
INVESTIGADORES COLABORADORES
Aproximadamente 100 personas del Ministerio de Salud del país entre médicos, enfermeras, biólogos, químico-farmacéuticos y técnicas de laboratorios colaboraron en la recolección y procesamiento de las muestras desde los diferentes hospitales, centros de salud y puestos de salud de las regiones y subregiones del Perú (Lista del personal participante al final del artículo)
Admisión de pacientes
A partir del 1o de Octubre de 1995, hasta el 31 de Marzo de 1996, cada paciente diagnosticado en un servicio de salud participante, con baciloscopía de esputo positiva, ingresó en el estudio, hasta completar el número de pacientes asignados.
El personal de Salud aplicó una encuesta (formulario 1) a cada paciente incluido en el estudio, en la que registró sus datos personales, antecedentes de tratamiento y condición HIV.
De acuerdo a la información obtenida, los pacientes fueron asignados a uno de dos grupos: los presuntamente no tratados previamente (NT) y los ya tratados (AT) (Tabla 2). La información sobre los pacientes co-infectados con HIV fue incluida en el total y también analizada por separado.
Métodos bacteriológicos
Se siguieron los métodos y procedimientos descritos en las Normas OPS/OMS sobre bacteriología de la tuberculosis.10 Las baciloscopías se procesaron por el método de Ziehl Neelsen.
Las muestras de esputo fueron procesadas por el método de Petroff u Ogawa Kudoh, y cultivadas en los medios de Lowenstein Jensen y Ogawa, respectivamente.
El método de las proporciones de Canetti, Rist y Grosset se empleó para las pruebas de sensibilidad11. Las concentraciones de medicamentos adicionadas al medio de cultivo, en mg/L fueron las siguientes: 0,2 para H; 40,0 para R; 4,0 para SM y 2.0 para E. Los criterios de resistencia fueron 1% para H, R y E y 10% para SM.
El 50% de las pruebas de sensibilidad (PS) a los medicamentos antituberculosos y las pruebas para confirmación de M. tuberculosis fueron efectuadas en el nivel central (INS); aproximadamente el otro 50% fue realizado por 3 laboratorios subregionales que actuaron como laboratorios de nivel central en este estudio (Lab. H. Cayetano Heredia, Lab. H. Daniel A. Carrión y Lab. S.R.S. Lima Sur). Una copia de los formularios 1 y 2, conteniendo este último la información bacteriológica (los resultados obtenidos del cultivo y/o prueba de sensibilidad realizados) que era enviada desde el centro de salud al laboratorio subregional, y de éste al nivel central correspondiente, donde se completaba con los resultados obtenidos de la prueba de sensibilidad.
El total de los formularios 1 y 2 con la información respectiva llegó al laboratorio de Referencia Nacional de Micobacterias para su ingreso a la base de datos del Programa SDRTB especialmente preparado por el Programa de Tuberculosis de la OMS (EPI INFO. 5.1) y su posterior análisis
Sistema de control de calidad de las Pruebas de Sensibilidad Antibiótica (PS).
EL Instituto Panamericano de Zoonosis INPPAZ (OPS/OMS) envió 20 cepas de M. tuberculosis codificadas al INS para. PS. Se comprobó un 98% de concordancia en los resultados de ambos centros. El INS, a su vez, envió 5 cepas codificadas a cada uno de los 3 laboratorios subregionales que efectuaron PS: Hospital D. A. Carrión de Callao, Cayetano Heredia de Lima Norte y DISURS de Lima Sur. Hubo más de 90% de concordancia en los resultados. Estos 3 laboratorios enviaron al INS el 10% de los cultivos analizados por PS para su control y el INS envió al INPAZZ el 10% del total de cepas estudiadas para ser reanalizadas.
RESULTADOS
El INS y el PCT recibieron los formularios 1 y 2 correspondientes a 2450 pacientes de las 31 subregiones participantes. Un total de 492 formularios fueron excluídos por razones diversas: datos incompletos, información incompleta sobre tratamiento anterior, cultivos contaminados o sin desarrollo en la PS.
Los resultados de 1958 pacientes se incluyeron en el estudio: 1500 sin antecedentes de tratamiento y 458 ya tratados. El 61,2% fueron de sexo masculino. 101 pacientes informaron haberse efectuado una prueba HIV para descarte, con resultado positivo en 9 casos, 8 de ellos de Lima-Callao y uno de Arequipa.
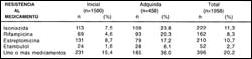
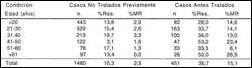
El porcentaje de casos con RI en 1500 pacientes NT fue 15,4%: un 10,1% presentó resistencia a un medicamento, 3,9% a dos medicamentos, 1.0% a tres y finalmente 0,4% a cuatro medicamentos. Se detectó Multiresistencia (MR) en 2,4% de los 1500 pacientes (Tabla 3 y 4).
La prevalencia de Resistencia Adquirida (RA) fue determinada en 458 pacientes antes tratados (AT), de los cuales 165 presentaron resistencia a uno o más medicamentos (Tablas 3 y 5). El 16,2% de esos 458 pacientes mostraba resistencia a un medicamento, 10.9% a dos medicamentos, 6,3% a tres y 2,6% a cuatro medicamentos. Se detectó MR en 15,7% del total de pacientes AT (Tabla 4).
La resistencia total, tanto Resistencia Inicial (RI) como Resistencia Adquirida (RA), se presenta en la Tabla 5. El mayor porcentaje de casos resistentes se halló para la SM (8,7%) entre los pacientes NT, mientras que entre los pacientes Antes Tratados (AT) predominó la resistencia a H (23,8%).
Seis de los 1500 pacientes NT eran HIV positivos (0,4%); ninguno de ellos presentó aislamientos resistentes. La prevalencia de positividad a HIV fue 0,8% entre los 458 pacientes AT (3 casos). Dos de ellos presentaron aislamientos con resistencia: uno a SM y otro MR. Ambos provenían de importantes hospitales de Lima y Callao.
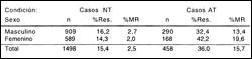
En las Tablas 6 y 7 se muestran los resultados de RI y RA y sus respectivos porcentajes de MR, de acuerdo con el sexo y la edad de los pacientes NT y AT. El mayor porcentaje de RI y MR entre pacientes NT se encontró en el grupo de 31 a 40 años, y la RA fue mayor en el grupo de 41 a 50 años, en quienes también se observó una mayor frecuencia de casos MR.
No se observó un perfil uniforme en relación al sexo de los pacientes: la RI fue ligeramente más elevada en hombres, mientras que la RA fue algo mayor entre las mujeres.
Los pacientes diagnosticados en establecimientos de salud de Lima-Callao constituyeron el 58,2% de los NT y el 51,3% de los AT.
En la Tabla 8 se comparan los porcentajes de casos con RI y con RA para estas áreas, con los observados en las provincias. Se observó una frecuencia significativamente mayor de casos MR entre los AT (RA) en las Provincias que en Lima-Callao.
Tabla 2. Porcentajes de pacientes no tratados previamente,
y antes tratados (NT y AT) de acuerdo a la notificación nacional,
y a la muestra para el estudio de resistencia.
Periodo Octubre 1995-Marzo 31, 1996.Perú
Tabla 3. Resistencia Inicial y Adquirida a medicamentos
antituberculosos. Perú, 1996
Tabla 4. Resistencia inicial y Adquirida según tipo y número
de medicamentos antituberculoso. Perú, 1996
Tabla 5. Resistencia Inicial,Adquirida y
Total a medicamentos antituberculosos. Perú,1996
Figura 2. Resistencia inicial y adquirida con respecto
a 1, 2, 3 y 4 medicamentos antituberculosos
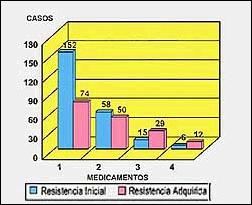
Tabla 6. Resistencia inicial y adquirida, medicamentos
antituberculosos, por sexos. Perú, 1996
Tabla 7. Resistencia inicial y adquirida, medicamentos
antituberculosos, por Edades .Perú, 1996
Tabla 8. Resistencia Inicial y Adquirida (RI) y(RA)
a medicamentos antituberculosos,
de acuerdo a la región. Perú, 1996
DISCUSIÓN
Si se toma en consideración el único estudio previo sobre resistencia inicial realizado en una muestra de pacientes del Perú en 1988, en el que 43 % de ellos presentaron cepas de M. tuberculosis resistentes a uno o más medicamentos, el actual porcentaje de 15,4% muestra una clara disminución del problema.
En aquella oportunidad la MR inicial afectó a 4 de 75 pacientes (5,3%). También ese problema ha mostrado una disminución, siendo 2,4% en la muestra actual.
No existe información anterior sobre análisis de la resistencia adquirida en el Perú, por lo tanto el 36,0% ahora encontrado servirá de referencia para determinar la tendencia futura.
De acuerdo a estos resultados, la MR afectó al 5,6% de los 1958 pacientes estudiados. De ellos, 37 NT (2,4% de 1500) y otros 72 AT (15,7% de 458). Si estos porcentajes se extrapolan al total de casos de TB notificados en el Perú en los 6 meses en que se tomó la muestra para este estudio, se podría esperar que un total de 1120 pacientes (443 NT y 677 AT), hubieran presentado aislamientos de M. tuberculosis MR, en ese período (Tabla 2).
La frecuencia de MR observada en pacientes AT ha sido significativamente más elevada en las Provincias, que en Lima-Callao (Tabla 8).
En la Tabla 2 se comparan las proporciones de pacientes AT diagnosticados en el mismo período, en provincias y en Lima-Callao, según notificación, y de acuerdo a la muestra incluida en esta encuesta. Esta información indicaría que hubo una proporción de pacientes AT, en las provincias, significativamente mayor en la muestra que en la notificación. Vale decir, que hubo en las provincias una selección de pacientes AT en la inclusión para la encuesta, que no se dió en la notificación.
Los establecimientos de salud participantes en la encuesta, en algunas provincias, fueron usualmente los hospitales más importantes, situados en áreas urbanas. Se incluyó en ellas, comparativamente, menos centros de salud periféricos que en Lima-Callao, debido a dificultades operacionales para el transporte de las muestras y para la realización de los cultivos, vinculados a las limitadas facilidades allí existentes.
Se puede suponer que los pacientes AT provenientes de los pequeños distritos y aldeas, recurren a los hospitales de las ciudades para su atención. En consecuencia, el universo de los pacientes de esas provincias puede no estar correctamente representado en la muestra; ello sería el origen del aumento en el número de pacientes AT en las provincias y también de su componente con RA.
El porcentaje de RA es un indicador indirecto de la eficiencia en la administración del tratamiento actual y -sobre todo- en el pasado cercano. En el Perú, en 1995, los porcentajes de curación en las cohortes de tratamiento de pacientes nuevos, con baciloscopía positiva, son del 87,8%, por lo tanto es de esperar una disminución estable y sostenida de la RA5.
La magnitud de la coinfección por HIV es aún baja. No obstante, la detección de un caso de MR en un paciente HIV positivo AT, en un hospital importante de Lima, no debe ser subestimada. Las microepidemias intrahospitalarias de TB-MR, producidas en otras grandes urbes, representan un desafío para el control de la TB. La asociación con el SIDA significa diseminación acelerada de la infección y de su progreso a enfermedad, con elevados porcentajes de letalidad, en cortos períodos de tiempo.12,13
La prevención de este problema emergente se basa, fundamentalmente, en la aplicación temprana de los modernos esquemas de tratamiento, directamente observados (DOT). Por el contrario, en aquellos hospitales donde los ambientes de atención y de hospitalización son compartidos por casos de TB crónica, fracasos terapéuticos y pacientes inmunodeprimidos (HIV/SIDA), sería de esperar la aparición de microepidemias y la diseminación de cepas de M. tuberculosis MR. Ello ha sido recientemente observado en Argentina, durante la encuesta sobre resistencia a los medicamentos antituberculosos.14
El presente estudio ha contribuído a reforzar la red de laboratorios de salud, y su coordinación con el PCT, contribuyendo a la seguridad y la oportunidad en el diagnóstico de la TB. En 1995 se constató un aumento del 25% en las baciloscopías diagnósticas realizadas. Ello aumenta la especificidad en el diagnóstico de la TB pulmonar, con una reducción del porcentaje de casos no confirmados bacteriológicamente. Un sistema de control de calidad de la baciloscopía se aplica en forma continua, en la red de laboratorios. A su vez, en los últimos dos años, 46 laboratorios intermedios o regionales han comenzado a efectuar cultivos, y se está implementando actualmente un sistema de control de calidad de esta técnica, entre los niveles regionales y el Laboratorio Nacional de Referencia de Micobacterias del INS.'
Finalmente, se debe hacer énfasis en la importancia de mantener en la próxima década, el nivel de eficiencia alcanzado por el PCT, para reducir significativamente la magnitud del problema de la TB en el Perú, y compensar el posible aumento debido al avance esperado de la infección por HIV.15
AGRADECIMIENTO
A todo el personal de salud, y los equipos multidisciplinarios de los Puestos de Salud; Centros de Salud; Hospitales; UTES; AIS-SBS; ZONADIS; Regiones y Sub Regiones de Salud, que hicieron posible realizar y culminar exitosamente este estudio. Un agradecimiento muy especial a la Dra. Isabel N. de Kantor/ INPPAZ/OPS/MOS, quien volcó su experiencia para hacer de esta responsabilidad un objetivo cumplido oportunamente con lo programado.
BIBLIOGRAFÍA
1 Raviglione MC, Snider DE, Kochi A: Global Epidemiology of Tuberculosis. JAMA 1995;273: 220-6. [ Links ]
2. WHO TB Programme and IUATLD: Guidelines for Surveillance of Drug Resistance in Tuberculosis. Doc. WHO/TB/94.178, Geneva, 1994. [ Links ]
3. Vareldzis BP, Grosset J, de Kantor I, et al.: Drug resistant tuberculosis: laboratory issues. WHO recommendations. Tubercle and Lung Disease 1994;75:1-7. [ Links ]
4. Hopewell PC, Sánchez Hernández M, Baron R B, Ganter B. Operational evaluation of treatment for tuberculosis. Am Rev Respir Dis 1984;129:439-43 [ Links ]
5. Programa de Control de Tuberculosis. Tuberculosis en el Perú, Año 1994. Ministerio de Salud, Arequipa, Perú, 1995. [ Links ]
6. Ministerio de Salud. Actualización de la Doctrina, Normas y Procedimientos para el Control de la Tuberculosis en el Perú. Salud Básica para todos. Lima, 1995. [ Links ]
7. Laszlo A., de Kantor I. A random sample survey of initial drug resistance among tuberculosis cases in Latin America. Bull. WHO 1994;72:603-610. [ Links ]
8. Programa Nacional de Control de Tuberculosis. Tuberculosis en el Perú. Informe 1995. Ministerio de Salud, Lima, 1996. [ Links ]
9. Lwanga SK, Lemeshow S. Sample size determination in health studies. A practical manual. WHO, Geneva, 1991. [ Links ]
10. OPS/OMS. Normas sobre Bacteriología de la Tuberculosis. Publicación Electrónica, INPPAZ, Buenos Aires, 1994. [ Links ]
11. Canetti G., Fox W, Khomenko A, Mahler H T et al: Advances in techniques of testing mycobacterial drug sensitivity and the use of sensitivity tests in tuberculosis control programmes. Bull WHO 1969; 41:21-43. [ Links ]
12. Edlin B R, Tokars J I, Grieco MH, et al. An outbreak of multidrug resistant tuberculosis among hospitalized patients with the acquired immunodeficiency syndrome. N Engl J Med 1992; 326:1514-21. [ Links ]
13. Aita J, Barrera L, Reniero, A, et at Hospital transmission of multidrug resistant Mycobacterium tuberculosis in Rosario, Argentina. Medicina (B. Aires) 1996;56:48-50.
14. Argentine Commission on Tuberculosis Bacteriology and the Tuberculosis Laboratory Network: Surveillance of antituberculous drug resistance in Argentina (Summary). Tubercle and Lung Disease 1995;76(Suppl.2):97. [ Links ]
15. Luelmo F.: Report on the National TB Programme in Peru. Lima, Perú, March 1996. (Comunicación Personal) GTB/NP/WHO. April 17, 1996, Geneva. [ Links ]