Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Medicina Experimental y Salud Publica
versión impresa ISSN 1726-4634
Rev. perú. med. exp. salud publica v.14 n.1 Lima ene./jul. 1997
ARTÍCULOS CIENTÍFICOS
Diagnóstico molecular para Leishmaniasis
Montoya Ysabel1,2; Padilla Carlos1; Nolasco Oscar1; León Carlos1,2; Talledo Michael1; Choque Juana1; Cáceres Omar1; Barreto Teresa1; De Los Santos Maxy1; Campos lván1; Douglas Susan1; Yabar Carlos1 y Barker Douglas3
1 División de Biología Molecular, Centro Nacional de Laboratorios de Salud Pública, Instituto Nacional de Salud, A.P 451 Lima, Perú.
2 Instituto Medicina Tropical "Alexander von Humboldt", Universidad Peruana Cayetano Heredia, Perú.
3 Departamento de Patología, Universidad de Cambridge, Reino Unido.
RESUMEN
El potencial diagnóstico de epitopes inmunodominantes seleccionados fue ensayado satisfactoriamente a fin de obtener una prueba serodiagnóstica alternativa para la Leishmaniasis Tegumentaria Americana. Dos proteínas recombinantes prometedoras de L. (v.) peruviana referidas como T-26-U2/T26-U4 fueron reconocidas por sueros individuales de pacientes con Leishmaniasis Tegumentaria Americana usando Western Blot. La sensibilidad de la prueba fue de 86% con sueros permanentes con Leishmaniasis peruana.
Palabra clave: Western Blot, Suero Leishmania, Leishmaniasis.
ABSTRACT
The potential diagnosis of selected immunodominant epitopes was successfully assessed as an alternate serodiagnostic tool for American Tegumentary Leishmaniasis (ATL). Two provisory recombinant proteins of L. (V) peruviana referred to as T26-U2/T26-U4 were recognized by individual sera from ATL patients using Western blot. This test sensitivity was 86% with peruvian leishmaniasis sera.
Key word: Western blot, sera, Leishmania, Leishmaniasis.
INTRODUCCIÓN
Las leishmaniasis comprenden un grupo de enfermedades con doce a catorce millones de personas infectadas en el mundo, con una incidencia de dos millones de casos nuevos anuales, de ellos 1´500,000 son casos cutáneos y 368 millones de personas tienen riesgo de infección en el mundo1,2.
El Perú, como muchos otros países americanos, es afectado por la leishmaniasis tegumentaria americana (LTA), causada principalmente por parásitos del complejo braziliensis4. Dos formas clínicas han sido detectadas: la leishmaniasis cutánea andina (LCA) conocida como uta, causada por L. (V.) peruviana y la leishmaniasis selvática (LS) o espundia causada por L (V.) braziliensis. La uta causa lesiones cutáneas benignas, responde al tratamiento clínico o autocura y se distribuye principalmente en los valles interandinos. Por otro lado, la espundia es la forma más severa de la enfermedad, causando lesiones mucocutáneas metastásicas desfigurantes y se distribuye geográficamente en la selva3. Durante mucho tiempo, el diagnóstico de leishmaniasis estuvo restringido al diagnóstico clínico y al examen parasitológico. Posteriormente se incorporaron, los métodos inmunológicos tales como: ELISA y DOT-ELISA usando proteínas totales como antígenos, los cuales están siendo usados para detectar anticuerpos circulantes en pacientes con diferentes formas de la enfermedad4. Sin embargo, el uso de antígenos totales presenta una especificidad limitada (65%) debido a la presencia de epítopes compartidos entre patógenos come, T cruzi y Plasmodium.
La tecnología del ADN recombinante está permitiendo disponer de Kits de diagnóstico altamente sensibles y específicos basados en proteínas recombinantes. Es decir, actualmente es posible aislar un gen responsable de la expresión de una proteína e introducirla a organismos como E. coli para que puedan ser mantenidos y perpetuados, de tal manera que es posible utilizar estas bacterias como fábricas biológicas para la producción y purificación de estas proteínas foráneas (proteínas recombinantes).
Usando esta estrategia Burns y col2 y Schreffer y col6, han obtenido proteínas recombinantes para el diagnóstico de leishmaniasis visceral tales como K-392 y la proteína recombinante rgp63. Por lo que resulta importante disponer de un Kit de diagnóstico basado en el uso de proteínas recombinantes específicos y sensibles para el diagnóstico de Leishmaniasis Tegumentaria Americana (LTA).
MATERIALES Y MÉTODOS
Pacientes y sueros
Se obtuvieron sueros de pacientes con LTA de diferentes dreas geográficas del Perú y remitidos al Instituto Nacional de Salud u obtenidos de los pacientes que llegaron al Instituto de Medicina Tropical Alexander von Humboldt de la Universidad Peruana Cayetano Heredia (Lima, Perú). Todos estos pacientes poseen historia clínica y fueron diagnosticados clínica y serológicamente de uta (n=22), o LS (n=42) presentando lesiones cutáneas (LCS=24) o mucocutáneas (LMS=18). Diez sueros de individuos sanos procedentes de áreas no endémicas fueron usados como controles negativos.
Sueros de pacientes con otras enfermedades tales como: parasitarias, la enfermedad de Chagas (n=15), malaria (n=5); las bacterianas, Bartonelosis (n=2), tuberculosis (n=4) y micóticas, Paracoccidiosis (n=8), Esporotricosis (n=5) fueron incluidos en este estudio.
Biblioteca de ADNc de Leishmania (V.) peruviana e inmunorrastreo de clones recombinantes
Se preparo una biblioteca de ADNc en, el vector de expresión λgt11 a partir de ARNm polyA+ extraídos de promastigotes de L. (V) peruviana en fase estacionaria. La biblioteca de ADNc (25,000 ufp) fue inmunorrastreada con una mezcla de sueros provenientes de pacientes LCA aislándose diez clones recombinantes que expresan proteínas de fusión5,7. Para mayores estudios fueron seleccionados dos clones denominados T26-U2 y T26-U4 por su alta reactividad frente a sueros de LTA.
Expresión y producción de proteínas recombinantes
Para la expresión y producción de proteínas recombinantes se utilizaron E. coli Y 1090 como hospederas del fago λgt11. Las bacterias incubadas en placas con medio LB-ampicilina fueron infectadas e incubadas a 42oC por 4 horas y las proteínas recombinantes inducidas con IPTG por 3 horas a 37oC. Finalmente, las proteínas fueron colectadas y conservadas a-80oC.
ELISA Y Western Blot
Las técnicas de ELISA y Western blot fueron utilizadas para detectar anticuerpos contra el extracto crudo de parásitos L.(V) braziliensis y los productos de expresión obtenidos de los clones recombinantes respectivamente. Para el Western blot, se sometieron 100 ug. de proteínas totales de L. (V) braziliensis y 300 ug de proteína recombinante a electroforesis en gel de poliacrilamida desnaturante (SDS-PAGE al 10% y 7%), transferidas a membranas de nitrocelulosa y enfrentadas a los sueros incluidos en el estudio.
RESULTADOS
Producción de proteínas recombinantes de Leishmania usando E. coli como huésped
Fueron obtenidas satisfactoriamente las proteínas recombinantes de L. (V.) peruviana referidas como T26-U2 y T26-U4 por la infección de sus respectivos bacteriófagos usando E. coli como huésped en el lapso de ocho horas. Se estima que la producción debe estar por el rango de 500 ug a 1mg de proteína total por placa de cultivo, de los cuales el % constituye la proteína recombinante expresada. Esta cantidad es suficiente para evaluar 150 a 200 sueros de pacientes por western blot.
El fago recombinante T26-U4 expresa con mayor eficiencia su proteína recombinante en comparación con la obtenida por el fago T26-U2. Asimismo, el producto de expresión de la clona T26-U4 fue más intensamente reconocido por los anticuerpos de los pacientes con Leishmaniasisis Tegumentaria Americana. Sin embargo, los anticuerpos de los pacientes con uta reaccionaron con mayor preferencia a la proteína recombinante T26-U2 que a la T26-U4.
Reactividad individual de las proteínas recombinantes con las formas clínicas de Leishmaniasis
La proteína recombinante T26-U2 evaluada con sueros de pacientes con LTA presentó una sensibilidad diagnóstica de 54% (Figura 1). Cabe mencionar que el 64% de los sueros de pacientes con LCA, 46% con LCS y el 50% con LMS reaccionaron con la proteína T26-U2. En contraste, la proteína recombinante T26-U4 presentó una reactividad para LTA, LCA, LCS y LMS correspondiente a 78%, 59%, 62% y 89% respectivamente (Figura 1).
Valor Diagnóstico de T26 U2/T26 U4
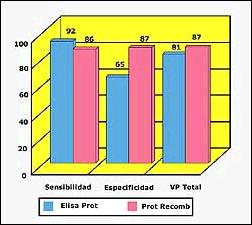
Al combinar los resultados obtenidos con ambas proteínas recombinantes T26-U2/T26-U4, se obtuvo un incremento significativo en la sensibilidad diagnóstica del test para LTA (86%), valor comparable a la utilización de proteínas totales como antígeno, (92%) (Figura 2).
La especificidad del test de diagnóstico usando ambas proteínas recombinantes es mayor que cuando se utilizan proteínas totales, 87% versus 65% respectivamente (Figura 2). De las dos proteínas recombinantes evaluadas, T26-U2 es la que muestra reacción cruzada con el 40% de los sueros de pacientes chagásicos mientras que T26-U4 presenta una alta especificidad al no reaccionar con los sueros de otras enfermedades. El valor predictivo total del test diagnóstico T26-U2/T26-U4 usando suero a de pacientes con LTA fue superior que el Western blot usando parásitos totales (87% versus 81%). (Figura 2)
Figura 1. Reactividad de las proteínas recombinantes
frente a las formas clínicas de Leishmaniasis en
ensayos de Western Blot
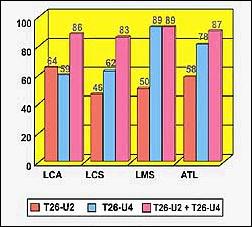
Figura 2. Sensibilidad, especificidad y valor predictivo total de ELISA
con proteínas totales versus el test de antígenos recombinantes
en ensayos por Western Blot
DISCUSIÓN
Una prueba para inmunodiagnóstico rápido y específico basado en el uso de proteínas recombinantes ha sido desarrollado y evaluado para el diagnóstico de leishmaniasis en el Perú con resultados satisfactorios.
Las proteínas recombinantes evaluadas mostraron una preferencia de reactividad de epítopes en relación con cada forma clínica del paciente con leishmaniasis. La proteína recombinante T26-U2 presento una reactividad preferencial con sueros de pacientes cutáneos, (LCA=64%, LCS=58%) a diferencia de los obtenidos de los pacientes con lesiones mucosas (37%). Sin embargo, la especificidad de la prueba se ve fuertemente incrementado (87%) versus el obtenido con proteínas totales (65%). Esta especificidad mejorada tendrá un impacto mayor en aquellas zonas geográficas donde coexisten Leishmania y otros patógenos que comparten epítopes homólogos tales como la enfermedad de Chagas.
Es importante mencionar que algunos sueros provenientes de pacientes infectados con leishmaniasis de los departamentos de San Martín, Huanuco y Cuzco no presentaron niveles de anticuerpos lo suficientemente altos para ser detectados por las proteínas totales, sin embargo haciendo uso de las proteínas recombinantes pudieron ser detectados y recibir un tratamiento apropiado.
La disponibilidad de estas proteínas recombinantes permitirá su uso como una herramienta de diagnóstico sensible y específica. Esta tecnología nos ofrece la ventaja de no cultivar in vitro al parásito y en contraste permite analizar rápidamente un gran número de sueros (150 a 200 análisis) disminuyendo por ende los costos de preparación y producción de antígenos para el diagnóstico de leishmaniasis.
Los insertos de las clonas T26-U2-U4 han sido secuenciados, su secuencia aminoacídica deducida y con programas de computación se han seleccionado epítopes con valor diagnóstico, los cuales permitirán simplificar y abaratar aun más los costos en el diagnóstico de leishmaniasis.
AGRADECIMIENTO
Esta investigación recibió financiamiento económico del Programa de la Unión Europea (TS3*CT-0123) y del UNDP/World Bank/WHO Special Programme for Research and Training in Tropical Diseases.
BIBLIOGRAFÍA
1. WHO report. Control of the leishmaniases. Report of a WHO expert Committee. By World Health Organisation 1995. [ Links ]
2. Burns JM, Schreffler WG, Benson DR, Badaro R and Reed SG. Molecular characterization of a Kinesin. related antigen of L. chagasi that defect specific antibodies in Africa and American visceral leishmaniasis. Procedings of the National Academy of Sciences of the USA.1993 [ Links ]
3. Lumbreras H & Guerra H. Leishmaniasis in Perú. Chang, KP, Bray RS eds. In: Leishmaniasis. New York: Elsevier Science Publication 1995; 297-312. [ Links ]
4. Peters W & Killick Kendrick R. The Leishmaniasis in biology and Medicine Vol. I Biology and Epidemiology, London, Academic Press,1987. [ Links ]
5. Montoya Y, Leon C, Talledos M, Nolasco O, Padilla C, Muñoz - Najar U. & Barker D.C. (1997) Transaction of the Royal Society of Tropical Medicine and Hygiene (in press). [ Links ]
6. Schreffler W, Burns J Jr, Badaro R, Ghalib H, Button L, McMaster R & Reed S. Antibody responses of visceral leishmaniasis patients to gp63, a major surface glycoprotein fo Leishmanis species. The Journal of Infection diseases. 1993; 167: 426-430. [ Links ]
7. Montoya Y. Molecular analysis of antigen genes in Peruvian Leishmania. Ph. D. Thesis. University of Cambridge. Cambridge U.K. 1993. [ Links ]
8. Montoya Y, Leon C, Talledos M, Nolasco O, Padilla C, Muñoz - Najar U. & Barker D.C. (1997) Transaction of the Royal Society of Tropical Medicine and Hygiene (in press). [ Links ]














