Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Medicina Experimental y Salud Publica
versión impresa ISSN 1726-4634
Rev. perú. med. exp. salud publica v.14 n.2 Lima jul./dic 1997
ARTÍCULOS CIENTÍFICOS
Utilización de hematíes de primates sudamericanos en la prueba inhibición de hemaglutinación para el diagnóstico del Virus del Sarampión
Palacios, Rosa 1; Montoya, Enrique 2; Torres, Ivonne 1; Ortiz, Ana Cecilia 1.
1 Laboratorio de virus inmunoprevenibles. Centro Nacional de Laboratorios de Salud Pública, Instituto Nacional de Salud, A. P 451, Lima, Perú
2 IVITA - Universidad Nacional Mayor de San Marcos, Iquitos - Perú.
RESUMEN
La utilidad del empleo de hematíes de especies sudamericanas de primates no humanos durante pruebas de hemaglutinación e inhibición de la hemaglutinación con virus sarampión ha sido evaluada. El estudio se Ilevó a cabo en 18 meses, habiéndose iniciado a fines de 1995 y terminado a comienzos de 1997.
Se obtuvo muestras de sangre de primates en solución citratada, en la sede del Instituto de Investigaciones Tropicales y de Altura en Iquitos (IVITA) y en el Parque de las Leyendas en Lima; el procesamiento se realizó en el Laboratorio de Virología del Instituto Nacional de Salud. Se analizaron muestras de 22 primates de 8 especies de la Amazonía peruana, probándolos en paralelo con hematíes patrón de monos Rhesus y Cercophitecus, por hemaglutinación con antígeno purificado de virus sarampión. Las especies Saimiri boliviensis peruvianus y Sanguinus mystax exhibieron afinidad hemaglutinante con el virus, siendo ésta parcial o incompleta y no persistente, con elusión espontánea a los 30 minutos. Se hizo ensayos de inhibición de hemaglutinación con sueros pareados de personas que estuvieron con infección sarampionosa 10 a 15 días antes de obtener la segunda muestra. No se recomienda su empleo rutinario durante encuestas serológicas por IHA, dados los sesgos en lecturas e interpretación que podrián presentarse.
Palabras claves: Hematíes, primates, hemaglutinación, sarampión.
ABSTRACT
The usefullness of red blood cells (rbc) of south-american non-human primates in hamegglutination and the hemagglunation inhibition with measles virus was evaluated in an 18 months study finished at the earlier's in 1997
Primate blood samples were obtained in a citrated solution at the Instituto de Investigaciones Tropicales y de Altura (IVITA) in Iquitos, and at the Parque Las Leyendas Zoo in Lima. Samples obtained from 22 monkeys of 8 different species from the Peruvian Amazon Region were tested in parallel with standard rbc of Rhesus an Cercopithecus monkeys through hemagglutination with measles virus purified antigen. Rbc of the species Saimiri boliviensis and Sanguinus mystax showed hemagglutinant affinity with the virus, being this partial or incomplete and nonpersistent, with spontaneous elution after 30 minutes. Hemagglutination inhibition assays were performed with paired sera samples obtainet from patients suffering measles infection with a 10 to 15 days interval. The utilization of Peruvian non-human primates rbc in IHA used for serological surveys is not recommended due to the possible blases in reading and interpretation of results.
Key words: Red blood cells, primates, hemagglutination, measles.
INTRODUCCIÓN
La necesidad de contar con una técnica simplificada para estudios de prevalencia de anticuerpos al sarampión, que pueda aplicarse en trabajos de campo y con reducidos costos impulsó la idea de utilizar hematies de primates del Perú en pruebas de inhibición de la hemaglutinación para el diagnóstico de sarampión. Los propósitos generales de la investigación han sido estudiar la factibilidad del empleo difundido de una técnica sencilla. de alta especifidad y bajo costo para el diagnóstico del sarampión, posibilitando el empleo de recursos naturales del país aplicados al área de la salud pública.
La hemaglutinación es una prueba biológica que aprovecha la característica estructural y fisiológica del virus sarampión para evidenciarlo e identificarlo preliminarmente en ensayos sencillos y prácticos de laboratorio y para cuantificarlo con el propósito de ser utilizado en pruebas rutinarias de laboratorio; para ello se requiere contar con los hematíes de los primates correspondientes 1.
Las pruebas de hemaglutinación (HA) e inhibición de la hemaglutinación (IHA) utilizadas desde los comienzos de la moderna virología aprovechan la particular capacidad del virus de unirse a la membrana de los eritrocitos de ciertas especies de primates y su contraparte serológica lo utiliza como un índice de reactividad para la evaluación de niveles de anticuerpos 2,4,5.
Aún cuando se considera de baja sensibilidad relativa en comparación a pruebas de inmunoensayo y neutralización, se le utiliza en valoraciones de tamizaje durante estudios epidemiológicos por su buen nivel de especifidad.
Los objetivos principales del estudio fueron:
- Validar el empleo de hematíes de especies de primates no humanos de la región amazónica peruana en pruebas de hemaglutinación para titulación de virus sarampión.
- Estandarizar las pruebas de hemaglutinación e inhibición de la hemaglutinación para virus sarampión, empleando hematíes de especies de primates de la Amazonía peruana comparándolas con hematíes patrón.
-Validar el uso de hematíes de especies de primates no humanos durante encuestas serológicas por prueba IHA.
-Estudiar la caracterización de receptores presentes en la membrana de los hematíes utilizados.
MATERIALES Y MÉTODOS
Se preparó antígeno de virus sarampión a partir de una cepa vacunal Enders Lote 2, 1964, existente en el laboratorio propagada en cultivo celular VERO (riñón de mono verde Cercophitecus aethiops) con un título neutralizante de 10 -3.2. Se empleó el método por gradiente de densidad de sucrosa para la purificación y concentración de antígeno. También se utilizó antígeno crudo obtenido de lisado de cultivos celulares infectadas con virus vacunal.
Se utilizó hematíes de 22 individuos pertenecientes a 8 especies distintas: Aotus sp., Aotus nancymae, Lagotrix lagotrichia, Saimiri scireus macrodon, Saimiri boliviensis peruvianus, Saimiri sp., Saguinus mystax y Saguinus fuscicollis.
Los hematíes patrón fueron obtenidos por gestiones ante el Patronato del Parque de Las leyendas, en donde se crían monos de las especies Maccacus rhesus y Cercophitecus aethiops, la obtención de sangre, estuvo a cargo de personal calificado de las respectivas instituciones. Se hizo por punción venosa, previa aplicación de Ketalar® como tranquilizante obteniéndose de 2 a 4 mL de sangre total en tubos con solución anticoagulante estéril.
El transporte se hizo en condiciones de frío moderado y protegidas de acción mecánica. Se realizó la prueba de hemaglutinación por micrométodo empleando volúmenes a la décima. Las lecturas a la hora de incubación a 37 ºC.
Para hematíes de referencia se observa estabilidad de la reacción a 4 ºC hasta por 12 hrs.
Se hizo la prueba de inhibición de hemaglutinación a 40 sueros previamente probados por ELISA con IgG comercial, 20 de ellos pareados. El procedimiento incluyó tratamiento para remoción de inhibidores no especifícos y aglutininas no específicas.
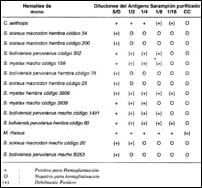
RESULTADOS
En las tablas 1 y 2, se presentan los resultados obtenidos en las pruebas realizadas. La concentración del antígeno con sucrosa incrementa en 35% el rendimiento con relación al antígeno crudo según se deduce de los títulos obtenidos.
T
Cuadro resumen consolidado de resultados de la prueba
de IHA para 40 sueros en 4 ensayos.
T
Prueba de Inhibición de Hemaglutinación para detección
del virus del sarampión utilizando hematíes de mono:
efecto de las diluciones de antígeno Viral.
Se encontró satisfactorio el manejo de las variables independientes: concentración del antígeno. Es necesario aún efectuar mayores ajustes para las variables suspensión de hematíes y temperatura de incubación.
En primera instancia se observo afinidad hemaglutinante diversificada para con hematíes de varias de las especies ensayadas: Aotus nancymae, Saimiri boliviensis peruvianus y Saimiri scireus macrodon, y ligeramente para Lagotrix. En una segunda etapa, y en presencia de hematíes de referencia de Maccacus rhesus y Cercophitecus aethiops, se encontró reproducibilidad únicamente para Saimiri; además también la especie Saguinus exhibió afinidad; motivo por el que en un tercer ensayo se probaron las especies Saimiri scireus macrodon, Saimiri boliviensis peruvianus y Saguinus mystax, observándose afinidad, con elusión espontánea prematura, lo cual sugiere que la cinética de hemaglutinación sigue otro.
DISCUSIÓN
Se ha reportado 17 que recientes aislamientos del virus sarampión no aglutinan hematíes de mono verde africano. Asimismo se ha observado disminución de la capacidad hemaglutinante después de varios pasajes en células VERO. En un estudio22 se hizo una prueba de inmunofluorescencia de la membrana de las células infectadas, revelando que la disminución de la actividad de unión a los hematíes del mono verde africano no se debía a variaciones en la expresión de la proteína hemaglutinina sobre la superficie celular, sino a la existencia de otra proteína viral diferente que contribuye a la unión del virus sarampión a los hematíes del mono verde africano y que probablemente funcione también para otras especies de hematíes. En el caso de nuestra cepa, la capacidad hemaglutinante del virus, exacerbada por procedimientos de purificación de antígeno19, es indudable.
La identificación para la unión hemaglutinina viral-receptor del hematíe se da a nivel de la molécula CD46 o proteína cofactor de membrana, ligada al complemento12, ausente en hematíes de humanos pero presente de manera análoga en los hematíes de primate, las variaciones en la glicosilación del carbohidrato de esta glicoproteína generará las diferencias en la afinidad para la unión reactiva. Para los primates peruanos ésta se ha presentado de manera diversificada e inestable, probablemente debido a las diferencias en la distribución de la molécula análoga al CD46 que se encuentra en las superficies celulares de las diversas especies de hematíes de primates5.
Las lecturas deben realizarse en un máximo de una hora a 37 ºC, observándose importantes cambios en los patrones de aglutinación a tiempos mayores de incubación a la misma temperatura, las pruebas de inhibición de la hemaglutinación (IHA) para sueros simples o pareados detectan anticuerpos totales y esencialmente indican infección pasada o contacto previo con virus vacunal o salvaje por parte de los individuos muestreados1.
El empleo de sueros pareados tiene significado diagnóstico para infecciones activas.
Habiéndose trabajado con un número escaso de muestras, cuarenta sueros comprobadamente positivos, negativos o con valores límite de anticuerpos a sarampión, mediante pruebas ELISA IgG, hallan su validez básicamente como instrumentos para evaluación de la utilidad de los hematíes durante pruebas IHA, en lugar de servir para estimaciones estadísticas.
Se han observado ciertas reacciones inespecíficas para algunos de los sueros ensayados con hematíes de Saimiri y Sanguinus posiblemente ocasionadas por pretratamiento insuficiente, evento que se presenta en muy pocos casos.
Los títulos IHA para los sueros probados fueron relativamente bajos, comparativamente con los resultados por ELISA, mas aún al emplear los hematíes de prueba, observándose reproducibilidad de los resultados en las lecturas IHA para casos de positivos fuertes y claramente negativos, lo cual verifica su buena especifidad dentro de los valores límites, pero se encuentran faltas de sensibilidad.
CONCLUSIONES
El presente estudio ha ratificado la utilidad de los hematíes de monos del viejo mundo, mantenidos en cautiverio, de las especies Maccacus rhesus y Cercophitecus aethiops, y ha despertado la expectativa para su utilización rutinaria. En cuanto a la utilización de los hematíes de las especies peruanas de primates de la Amazonía, se considera posible, ya que se ha observado afinidad, aunque inestable, predominando los patrones de hemaglutinación parcial o incompleta, lo cual puede ser debido a la escasa, desigual o limitada distribución de los receptores CD46 u otros análogos en las membranas celulares de estos eritrocitos. En condiciones controladas de tiempo de vida media de la unión hemaglutinante (según cinética) de hemaglutinación, pueden ser utilizadas en pruebas de titulación de antígeno sarampión, mas no en pruebas de inhibición de hemaglutinación porque cabe la posibilidad de captar falsos negativos en casos de valores límite.
BIBLIOGRAFÍA
1. Black FL. Measles active and passive immunity in a worlwide perspective. Prog. Med. Virol. 1989; 36: 1-33 [ Links ]
2. Brunnel, Phillip A. Measles control en the 1990s: Measles serology. WHO/EPOI/GEN/90.4. [ Links ]
3. Cutts Ft., Henderson RH, elements CJ, Chen RT Principles of measles control. Bulletin WHO, 1991. [ Links ]
4. Davis B. & Dulbecco R. Tratado de Microbiología. Cap. Virología, 3ra. ed. 1985. [ Links ]
5. Dorig RE, Marcil A, Chopra A, Richardson CD. The human CD46 molecule is a receptor for measles virus (Ed-monston strain). Cell 1993; 75:295-305. [ Links ]
6. Evaluación del Proyecto Peruano de Primatología Manuel Moro Sommo, Iquitos-Perú, 1992. [ Links ]
7. Fields BN, Knipe DM, Howley PM. Virology, Cap. 43, 3ra Ed., Pha. New York, 1996. [ Links ]
8. Gershon AA & Krugman S. Measles virus. In: Lennette EH & Schmidt NS. Editors. Diagnostic procedures for viral and rickettsial infections, 5th Ed. N. Y. APHA, 1979, p. 665-93. [ Links ]
9. Hierholzer Jhon C. and Morris T. Suggs. Standardized viral hemagglutination and hemaglutination inhibition test. Applied Microbiology, Vol. 18, Nº 5, 1969. [ Links ]
10. Kalter SS, Heberling RL & Barry JD. Detection and titration of measles virus antibody by hemagglutination inhibition and by dot immunobinding. J Clin Microbiol 1991, 29: 202-204. [ Links ]
11. Krah DL. Receptors for binding measles virus on host cells and erythrocytes. Microbiol Pathogenesis 1991; 11: 221-228. [ Links ]
12. Liszewski MK, Atkinson JP. Membrane cofactor protein. Curr Top Microbiol Inmunol. 1992; 178:7-60. [ Links ]
13. Naniche D, Wild TF. Rabourdin-Combe C, Gerlier D, A monoclonal antibody recognizes a human cell surfac glycoprotein involved in virus binding. J Gen Virol 1992; 73: 2617-2624. [ Links ]
14. Nickells MW, Atkinson JP. Characterizacion of CR1-and membrane cofactor protein-like proteins of two primates. J. Immunol 1990; 144:4262-4268. [ Links ]
15. Norrby E. Hemagglutination by measles virus. Arch Ges Virusforsch 1962; 12:164-172. [ Links ]
16. Norrby E. Hemagglutination by measles virus. 4. A simple procedure for production of high potency antigen for hemagglutination inhibition test. Proc Soc 1962; 11:814-818. [ Links ]
17. Saito H, Sato H, Abe M. et al. Isolation and characterization of measles virus strains with low hemaglutination activity. Intervirology 1992: 33:57-60. [ Links ]
18. Schmidt NJ, Emmons RW. Diagnostic procedures for viral, rickettsial and chlamydial infections, 6th ed. N.Y. APHA, 1989. [ Links ]
19. Shibahara K, Hotta H, Katayama Y, Homma M. Increased binding activity of measles virus to monkey red blood cells after long-term passage in Vero cell cultures. J Gen Virol. 1994, 75 (Pt 12):3511-6, England. [ Links ]
20. Shesshberadaran H, Chen S-N, Norrby E. Monoclonal antibodies against five structural components of measles virus. Virology 1983; 128:341-353. [ Links ]
21. Souza VAUF Pannuti CS, Sumita LM & Albrecht P. ELISA for measles antibody. A comparison with hemagglutination inhibition, immuno-fluorescence and plaque neutralization test. Rev Inst Med Trop Sao Paulo 1991, 33(1):32-36. [ Links ]
22. Varsanyi TM, Utter G, Norrby E. Purification, morphology and antigenic characterization of measles virus envelope components. J Gen 1984; 65:355-366. [ Links ]