Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Medicina Experimental y Salud Publica
versión impresa ISSN 1726-4634
Rev. perú. med. exp. salud publica v.17 n.1-4 Lima 2000
TRABAJOS ORIGINALES
Control de Calidad de Discos de Calidad de Sensibilidad antibiótica comercializados en el Mercado Peruano (1998-1999)
George Obregón B1; Alfonso Zavaleta M2.
1 División de Garantía de la Calidad, Centro Nacional de Control de Calidad, Instituto Nacional de Salud.
2 Departamento de Ciencias Fisiológicas, Facultad de Ciencias y Filosofía, Universidad Peruana Cayetano Heredia.
RESUMEN
Objetivo: Se realizó el control de calidad de los discos utilizados en la evaluación de la sensibilidad de microorganismos patógenos frente a los antibióticos. Materiales y métodos: Se evaluó la calidad de 36 lotes de discos de sensibilidad antibiótica de cinco marcas de diverso origen de fabricación, comercializadas en el mercado peruano, empleando la norma M2A5, Suplemento M100-S7 del NCCL-S (método de Kirby-Bauer). Se evaluaron lotes de discos de amicacina, amoxicilina/ácido clavulánico, ampicilina, ceftazidima, cefuroxima, cloranfenicol, eritromicina, estreptomicina, gentamicina y penicilina. Los resultados fueron comparados con los valores indicados en la norma, utilizando para ello la prueba de límites de confianza (t0,05). Resultados: 41,7% del total de lotes de discos evaluados cumplieron los requisitos de la norma; 48,3% de los lotes de discos de fabricación extranjera evaluados cumplieron con dichos requisitos, a diferencia de los discos nacionales, los cuales no cumplieron con los parámetros de la norma en ninguno de los casos. Conclusiones: La elevada proporción de discos no conformes sugiere que la calidad de los discos de sensibilidad antibiótica comercializados en el Perú no es la óptima, por lo que es necesario realizar monitoreos y controles periódicos a fin de asegurar la calidad de este producto en el mercado peruano.
Palabras clave: Control de calidad; Antibióticos; Perú (fuente: BIREME).
ABSTRACT
Objective: We performed quality control testing of the disks used to assess the susceptibility of pathogenic microorganisms to antibiotics. Materials and Methods: The quality of 36 lots of antibiotic sensitivity disks of five different brands traded in the Peruvian market was assessed using NCCLS˝s (Kirby-Bauer technique) M2-A5, supplement M100-S7 standard . Lots of disks of Amicacine, Amoxiciline/Clavulánic Acid, Ampiciline, Ceftazidime, Cefuroxime, Cloranphenicol, Erithromicyn, Estreptomicyn, Gentamicyn and Penicillin were assessed. The findings were compared to the values stated in the standards, using the Confidence Limits Test (t0.05). Findings: 41,7% of the lots of disks assessed met the requirements stated by the standards; 48.3% of the disks manufactured abroad met the aforementioned requirements. On the other hand, none of the disks manufactured in Perú met the requirements. Conclusions: The high proportion of disks that do not meet the requirements point out that the quality of the antibiotic sensitivity disks available in Perú is not optimal and that, in order to assure the quality of this product in the Peruvian market, surveys and controls should be performed periodically.
Key words: Quality control; Antibiotic; Peru (source: BIREME).
INTRODUCCIÓN
El creciente aumento de microorganismos resistentes a los antibióticos en el mundo, como consecuencia del uso indiscriminado o no racional de los antibióticos, tanto en medicina humana como en medicina veterinaria, han ocasionado la aparición de cepas seleccionadas de gérmenes resistentes asociados a patologías severas, y en ocasiones, epidemias asociadas a un incremento de la mortalidad producto de las infecciones ocasionadas por estos gérmenes1,2,3. Ello trajo consigo, el establecimiento, desde 1977, en varios países, de programas nacionales de farmacovigilancia, y la creación de programas nacionales de resistencia de bacteriana a los antibióticos, sobre todo, de aquellas que provocan las denominadas infecciones intrahospitalarias (IIH).
La metodología empleada por los programas de vigilancia incluye las técnicas de difusión en agar, susceptibles de estandarización y control, y que proporcionan resultados precisos y claros que pueden ser comparados4,5,6. En ese contexto, en 1966, la Organización Mundial de la Salud (OMS) recomendó la utilización con fines clínicos del método modificado por Kirby-Bauer para discos de sensibilidad antibiótica (DSA) debido a su sencillez y reproducibilidad7,8. Asimismo, la Administración de Alimentos y Drogas de los Estados Unidos de Norteamérica (FDA), publicó en 1972 el primer método normalizado internacional mente, el que luego es adoptado en 1990, con pequeñas modificaciones, por el Comité Nacional para Estándares de Laboratorio Clínico de los Estados Unidos de Norteamérica (NCCLS). En este procedimiento se establecen los parámetros microbiológicos para la evaluación de los DSA.
En la actualidad, la prueba de sensibilidad antimicrobiana, está regulada por la norma M2-A7, Suplemento M100-S10, aprobada el año 2000 por el NCCLS9, siendo este el método de difusión de discos descrito de manera más completa, para el cual se han desarrollado tablas de interpretación, respaldadas por datos clínicos y de laboratorio realizados en diversos hospitales e instituciones de salud en los EE.UU. Este método es utilizado para microorganismos de crecimiento rápido y ha sido modificado para microorganismos de crecimiento fastidioso, sin embargo, aún no se han desarrollado estándares reproducibles para la interpretación de los resultados de algunos microorganismos (p. ej. Corynebacterium spp, Bacillus spp, Campylobacter). Asimismo, la obtención de resultados satisfactorios con las cepas patrones de control de calidad no garantiza que se obtendrán también resultados satisfactorios con los aislamientos clínicos. Sin embargo, las principales ventajas de este método radican en ser una norma internacional estandarizada, validada y de amplia difusión a nivel mundial.
En el mercado peruano se pueden obtener comercialmente DSA de fabricación nacional, chilena, norteamericana, francesa y británica. Cabe mencionar, que nuestro país carece de una norma técnica para la evaluación de dichos productos. En reporte previo sobre la calidad de los DSA comercializados en el mercado peruano, se analizaron 24 lotes de 18 discos comerciales pertenecientes a dos marcas (una nacional y otra norteamericana), obteniéndose que sólo la mitad de los lotes evaluados cumplieron con los requisitos de calidad exigidos en la norma M2-A5, Suplemento M100-S710, mientras que 66,7% del total de DSA norteamericanos ensayados cumplieron con dicha norma. Sobre la base de estos resultados se sugirió la realización de un mayor número de evaluaciones con el objetivo de conocer la real calidad de los DSA comercializados en el mercado nacional11. El presente estudio aplicó los criterios establecidos en la norma M2-A5, Suplemento M 100-S710 del NCCLS a 36 lotes de DSA de 5 marcas comercializadas en el mercado nacional, evaluadas durante el período agosto 1998 - agosto 1999.
MATERIALES Y MÉTODOS
Se evaluaron un total de 36 lotes de DSA de 5 marcas disponibles en el mercado peruano: Emerme (Perú, 5 lotes), Sensidiscos-EMV (Chile, 8 lotes), Oxoid (Inglaterra, 7 lotes), y 2 de origen norteamericano (8 lotes de la marca BBL y 8 lotes de la marca Difco). Los lotes de DSA evaluados fueron proporcionados por diversos proveedores de DSA comerciales. La muestra fue seleccionada por muestreo aleatorio simple. Todos los discos se ensayaron siguiendo los criterios establecidos por la norma M2-A5: "Normas para el desempeño de pruebas de discos de sensibilidad antimicrobiana" del NCCLS10.
En el estudio se evaluaron discos conteniendo amicacina 30 μg, amoxicilina/ácido clavulánico 20/10 μg, ampicilina 10 μg, ceftazidima 30, μg, cefuroxima 30 μg, cloranfenicol 30 ug, eritromicina 15 μg, estreptomicina 10 μg, gentamicina 10 μg y penicilina 10 UI. Los discos nacionales analizados presentaron fechas de expiración para el año 1999, los discos de fabricación chilena fecha de expiración para el año 2000, los discos británicos fechas de expiración comprendidas entre los años 2000-2001, los discos norteamericanos marca BBL fechas de expiración comprendidas entre los años 2000-2001, y los discos norteamericanos marca Difco fechas de expiración entre los años 2000-2002.
Los discos fueron enfrentados a cepas de Escherichia coli ATCC; 25922, Pseudomonas aeruginosa ATCC 27853 y Staphylococcus aureus ATCC 2592310 y los diámetros de los halos de inhibición de los DSA registrados en los análisis de control de calidad, fueron comparados con los registros de los diámetros de zona indicados en la norma M2-A5, Suplemento M100-S7, utilizándose para ello la prueba de límites de confianza (t0,05) y la distribución t de Student. Para la conformidad de los discos evaluados se siguieron los siguientes criterios:
- Cuando los valores registrados del diámetro de la zona de inhibición antimicrobiana (mm) cumplen con los valores indicados en la norma M100-S10 del NCCLS; y
- De cada 20 repeticiones de discos de sensibilidad antimicrobiana evaluados con un determinado microorganismo de control, sólo un resultado puede salir defectuoso.
Además, si el diámetro de la zona de inhibición antimicrobiana excedió en 1 mm en el límite superior o fue menor en 1 mm en el límite inferior del diámetro de zona indicado en la norma, el resultado fue considerado no conforme10.
Finalmente, con la intención de comparar la variabilidad de los rangos del diámetro de la zona de inhibición antimicrobiana de los discos analizados, se realizó el análisis de coeficiente de variabilidad (CV)12.
RESULTADOS
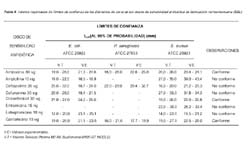
Los resultados de la evaluación de la calidad de los DSA se muestran en las Tablas 1 a 5.
En la tabla 1 se muestran los resultados de la evaluación de DSA nacionales, apreciándose la no conformidad con los parámetros de la norma en ninguno de los casos.
En la tabla 2 se registran los resultados de los DSA chilenos (Sensidiscos-EMV), mostrando valores de no conformidad en la mitad de los casos (50,00%).
En la tabla 3 se presentan los resultados de los DSA británicos (Oxoid), siendo el porcentaje de no conformidad mayor que en cualquier otro caso (71,43%).
En las tablas 4 y 5 se muestran los valores experimentales de los DSA norteamericanos, presentando no conformidad tanto BBL (62,50%) como Difco (25,00%).
De manera general, se registraron dos tipos de no conformidades. En el primer caso (figura 1) se presentó no conformidad por deficiencia en la actividad antibiótica de los discos evaluados marca Emerme de amicacina, estreptomicina y discos BBL de cefuroxima, todos con valores de CV mayores a 5, así como los Sensidiscos sensidiscos- EMV de amoxicilina/ácido clavulánico, cefuroxima, cloranfenicol y discos Oxoid de ampicilina, amicacina y ceftazidima, estos últimos con valores de CV iguales o menores a 5.
En el segundo caso (figura 2) se presentó no conformidad por exceso de actividad antibiótica de los discos marca Emerme de cloranfenicol y gentamicina, así como en los Sensidiscos sensidiscos-EMV de ampicilina, discos BBL y Difco de ceftazidima, todos con valores de CV mayores a 5, así como discos BBL de ampicilina y eritromicina, discos Difco de amoxicilina/ácido clavulánico, discos BBL y Oxoid de estreptomicina y discos Emerme y Oxoid de penicilina, estos últimos con valores de CV iguales o menores a 5.
Se determinó que 41,67% de los lotes de discos evaluados, cumplieron con los parámetros de la norma. Se observó que cerca de la mitad de los discos de las marcas extranjeras fueron conformes (48,4%). Los lotes de discos nacionales evaluados no cumplieron con los parámetros de la norma en ninguno de los casos, tanto por exceso como por deficiencia de la actividad antibiótica, además se observó que presentaron halos de inhibición defectuosos.
La mayoría de los discos extranjeros no conformes (51,61%) presentaron un exceso de potencia en su respectiva concentración antibiótica, a excepción de la amicacina, ampicilina y ceftazidima (discos Oxoid), cefuroxime (discos BBL y sensidiscos -EMV) y amoxicilina/ácido clavulánico y cloranfenicol (sensidiscos-EMV), que registraron valores menores a los señalados por la norma M2-A5, Suplemento M100-S710.
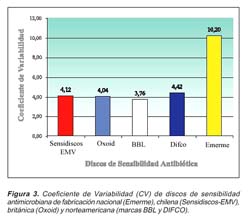
Los discos extranjeros presentaron coeficientes de variabilidad (CV) menores a 5 (Sensidiscos-EMV=4,1; Oxoid=4,0, BBL=3,7, y Difco=4,4), lo cual se verifica en rangos de actividad estrechos y valores que están dentro de los límites de la norma, a diferencia de los discos nacionales Emerme que presentaron en promedio valores mayores del coeficiente de variación (CV=10,2), y como consecuencia rangos amplios que no cumplen con los límites establecidos (Figura 3).
DISCUSION
Los resultados porcentuales de lotes aceptados (41,67%) y rechazados (58,40%) obtenidos en el presente estudio, efectuado con un mayor número de marcas (n=5) y número de lotes (n=36), son similares a lo reportado previamente, donde 50,00% de los lotes de DSA evaluados arrojaron resultados no conformes11.
Se ha observado una disminución en la proporción de discos extranjeros que cumplieron con los requisitos de la norma. Así, en el estudio previo 66,60% de los lotes de discos extranjeros cumplieron los requisitos, en este estudió sólo 48,30% cumplieron los requisitos de la norma empleada. Esta disminución del porcentaje de lotes conformes se podría asociar al mayor número de marcas y lotes evaluados en este estudio.Por otro lado, los discos de la marca evaluada de discos fabricados en nuestro país no cumplieron con los requisitos exigidos por la norma en ninguno de los casos, al igual que en el anterior estudio11.
Los resultados del CV de los DSA evaluados (CV extranjero < 5; CV nacional = 10,20), fueron bastante similares a los registrados en el anterior trabajo11, lo cual se verifica en rangos de actividad estrechos, para los DSA de origen extranjero, evidenciando una calidad homogénea, comportamiento que fue opuesto en los DSA nacionales. Se determinó que la homogeneidad encontrada en los DSA extranjeros no condicionó el cumplimiento de las especificaciones de la norma.
La calidad de los DSA está condicionada a la naturaleza del antibiótico, procesos de manufactura y control de calidad del laboratorio fabricante, también puede verse afectada por condiciones de conservación inadecuadas, involucrando variables como la temperatura y la humedad durante el almacenamiento de los mismos. Los resultados obtenidos sugieren que la calidad de los DSA comercializados en el Perú no es la más adecuada, constituyéndose en fuente potencial de distorsión o error, ya que la información recopilada podría estar induciendo a falsas interpretaciones en torno a los verdaderos problemas de resistencia bacteriana a los antibióticos, lo cual afectaría negativamente la correcta toma de decisiones por parte de las autoridades del sector salud en el diseño de programas de resistencia bacteriana.
Dado que el uso racional de los antibióticos en enfermedades comunes, así como en las infecciones intrahospitalarias se basa en pruebas de laboratorio que emplean frecuentemente discos para la prueba de sensibilidad antibiótica, es indispensable la puesta en marcha de un programa de control de calidad de dichos productos, a fin de garantizar la suficiencia de los programas de utilización antibiótica desarrollados por el Ministerio de Salud del Perú.
Asimismo, es necesario que en el país se considere el desarrollo de una norma para el control de calidad de DSA, así como implementar un plan nacional de capacitación para el personal integrante del Sistema Nacional de DSA en la ejecución estandarizada de la Prueba de Sensibilidad de DSA, método Kirby-Bauer. También, es recomendable la ejecución de proyectos periódicos de vigilancia de estos productos a fin de garantizar el cumplimiento de los requisitos mínimos de calidad exigidos por la normativa internacional.
AGRADECIMIENTOS
Al personal técnico de la División de Microbiología del Centro Nacional de Control de Calidad del INS por el apoyo brindado durante la realización de este estudio.
REFERENCIAS
1 .Jawetz E. Microbiología Médica. 1 ra. Ed. México D.F.: Manual Moderno, 1992. [ Links ]
2. Isaacson W. El siglo de la biotecnología. Reportaje especial. Ed. Time & Life Building, New York. 1998; 1: 4-6. [ Links ]
3. Vandepitte J, Engbaek K, Piot P, Heuk C. Métodos básicos de laboratorio en bacteriología clínica. Serie de Informes Técnicos Nº793. Ginebra: OMS, 1993. [ Links ]
4. Vincent JG, Vincent HW. Filter paper modification of the Oxford Cup Penicillin determination. Proc Soc Exp Biol Med 1944; 55: 162-4. [ Links ]
5. Morly DC. A Simple method of testing the aensitivity of wound bacteria to penicillin and sulfathiazole by use of Impregnated blotted paper disc. J Pathol Bacteriol 1945; 57: 379-482. [ Links ]
6. Bondi A, Smith JG, Bass K. A routine method for rapid determination of susceptibility to penicillin and other antibiotics. Am J Med Sci 1947; 213: 221-5. [ Links ]
7. Anderson TG. An evaluation of antimicrobial susceptibility testing. In: Antimicrobial agents annual; 1961: 86-100. [ Links ]
8. Bauer AW, Kirby WM, Sherris JC, Turck M. Antibiotic susceptibility testing by a standardized single disk method. Am J Clin Pathol 1966; 45:493-6. [ Links ]
9. National Committee for Clinical Laboratory Standards. Approved Standar M2-A7: Performance standars for antimicrobial disk susceptibility test. 7th Ed. Villanova, Pa.: NCCLS, 2000. [ Links ]
10. National Committee for Clinical Laboratory Standards. Approved Standar M2-A5: Performance standars for antimicrobial disk susceptibility test. 5th Ed. Villanova, Pa.: NCCLS, 1993. [ Links ]
11. Obregón G, Zavaleta A. Perú: Evaluación de la calidad de discos de sensibilidad antimicrobiana. Rev Med Exp 1998; XV(1 -2): 18-25. [ Links ]
12. Calzada J. Métodos estadísticos para la investigación. 2da. Ed. Lima: Sesator, 1964. [ Links ]
Correspondencia: George Obregón Beltran. Centro Nacional de Control de Calidad. Instituto Nacional de Salud Av. Defensores del Morro 2268 (ex Huaylas), Chorrillos, Perú. Telf.:(0511) 4676669- Fax:(0511) 4671216. Email: inscncc@terra.com.pe