Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Medicina Experimental y Salud Publica
versión impresa ISSN 1726-4634
Rev. perú. med. exp. salud publica v.17 n.1-4 Lima 2000
TRABAJOS ORIGINALES
Estudio de validación de la Metodología para la determinación de Vitamina A en Alimentos infantiles instantáneos por Cromatografía Líquida de alto rendimiento (HPLC)
Ruth Pérez Calderón1.
1 División de Química, Centro Nacional de Alimentación y Nutrición, Instituto Nacional de Salud.
RESUMEN
Con la finalidad de controlar la calidad de alimentos infantiles instantáneos se efectuó la validación de la metodología para la determinación de la vitamina A por cromatografía líquida de alto rendimiento (HPLC). Para la precisión del sistema se evaluaron tres parámetros: tiempo de retención, área y altura, hallándose una desviación estándar relativa (RSD) máxima de 1,78%. En la linealidad se obtuvo un coeficiente de correlación r = 0,99 y una precisión con un RSD de 2,70%. La exactitud del método se evaluó en términos de recuperación mediante la adición de vitamina A al alimento obteniéndose un porcentaje de recuperación de 97,98%; y para la sensibilidad del método se obtuvo un límite de detección (LOD) de 0,06 μg/g y un límite de cuantificación (LOQ) de 0,58 μg/g. Con los resultados obtenidos se demuestra que el método en estudio es preciso, exacto, lineal y altamente sensible para ser utilizado en el control de calidad de alimentos infantiles instantáneos para la determinación de vitamina A.
Palabras claves: Vitamina A; Cromatografía líquida; Alimentos infantiles (fuente: BIREME).
ABSTRACT
Validation of the methodology used to determine Vitamin A through High Performance Liquid Cromatography (HPLC) was performed to assess instant food for children. Three parameters were assessed in order to determine the system´s accuracy: retention time, area and height and a maximum variation (RSD) of 1.78% was found. A correlative coefficient of r = 0.99 was obtained for the lineal parameter, and an accuracy with 2.70% for RSD. The accuracy of the method was evaluated in terms of recovery through the addition of Vitamin A to the food, the recovery percentage obtained was 97.98%, and for the sensitivity a limit of detection (LOD) 0,06 μg/g was obtained, as well as a limit of quantification (LOQ) 0,58%. The findings demonstrate that the method assessed is accurate, exact, lineal and highly sensitive to be used in quality control of instant food for children for the determination of Vitamin A.
Key Words: Vitamin A; Liquid cromatography; Infant food (source: BIREME).
INTRODUCCION
Vitamina A es el nombre genérico utilizado para describir al retinol, sus ésteres y los correspondientes isómeros. Sólo está presente, como tal, en los alimentos de origen animal, aunque en los vegetales se encuentra como provitamina A en forma de carotenos.
Los diferentes carotenos se transforman en vitamina A en el cuerpo humano, se almacenan en el hígado en grandes cantidades y también en el tejido graso de la piel (palmas de las manos y pies, principalmente), por lo que podemos subsistir largos períodos sin su aporte 1.
La principal función de la vitamina A es la protección de la piel y su intervención en el proceso de visión de la retina. También participa en la elaboración de enzimas en el hígado y de hormonas sexuales y suprarrenales. El déficit de vitamina A produce ceguera nocturna, sequedad en los ojos (membrana conjuntiva) y en la piel, y afecciones diversas de las mucosas. En cambio, el exceso de esta vitamina produce trastornos como alteraciones óseas, e incluso inflamaciones y hemorragias en diversos tejidos.
La vitamina A se encuentra principalmente en productos animales tales como leche, crema, mantequilla, queso, huevos, carne, hígado, riñón y aceite de hígado de bacalao. Por lo general, se encuentra como ésteres de ácidos grasos de cadena larga pero también se encuentra como retinol. Se destruye muy fácilmente con la luz, con la temperatura elevada y con los utensilios de cocina de hierro o cobre 2.
Los alimentos infantiles instantáneos, en su gran mayoría, son fortificados normalmente utilizando formulaciones especiales que mejoran su estabilidad y valor nutritivo, siendo la ingesta diaria recomendada (RDA) de 400-700 μg de vitamina A, para niños de 1-10 años de edad 3.
En el Perú, los programas de complementación alimentaría distribuyen alimentos instantáneos a la población con alto riesgo de desnutrición; en ese sentido, el desarrollo de tecnologías adecuadas para la evaluación de micronutrientes como la vitamina A, son necesarias para el control de calidad de los productos designados a los beneficiarios de estos programas.
El análisis de las vitaminas en los alimentos es un gran desafío para los analistas dado que se asocia con problemas significativos. Muchos de estos problemas han sido eliminados gracias a los recientes avances en la tecnología y el desarrollo de nuevos enfoques analíticos. A pesar de ello, no es una tarea fácil analizar vitaminas y se necesita experiencia y los conocimientos adecuados para producir resultados reproducibles, que sean exactos y válidos.
El primer método válido para la determinación de Vitamina A fue un bioensayo 4; luego, se establecieron los métodos espectrofotométrico y fotométrico 5, sin embargo, ambos métodos están expuestos a interferencias, desde algunas sustancias como carotenos, derivados y productos de descomposición de la vitamina A que podrían absorber luz en la misma región ultravioleta o dar colores similares con los reactivos utilizados en la determinación fotométrica. Es así, que estos métodos no son lo suficientemente específicos para determinar esta vitamina, además que la confiabilidad de sus resultados depende del éxito en los pasos de purificación y los procedimientos de trabajo.
Como vemos, el problema realmente no son los métodos de determinación, sino más bien los procedimientos de extracción, ya que debido a su inestabilidad, algunos autores prefieren extraer separadamente cada vitamina liposoluble 6.
En ese sentido, y buscando una óptima metodología de análisis, en el presente estudio se realizó la validación de la metodología por HPLC para la determinación de vitamina A contenida en alimentos infantiles instantáneos.
MATERIALES Y METODOS
EQUIPOS
Se utilizó un equipo de cromatografía líquida de alto rendimiento (HPLC), marca Shimadzu, modelo LC10A, con inyector automático, bomba con sistema de degasificación, con integrador o sistema de registro, software para el procesado de datos cromatográficos, detector de arreglo de diodos (longitud de onda variable). La columna cromatográfica fue de acero inoxidable LC-18 para fase reversa, de 25 cm x 4,6 mm de diámetro interno, 5 μm de diámetro de partícula, y guarda columna con cartucho C18, Supelco. Las condiciones típicas de operación fueron: sistema isocrático, flujo 1,2 mL/min, volumen de inyección 20 μl, detección UV 242 nm, temperatura de horno, ambiente, y tiempo de corrida 7 min. La fase móvil fue metanol al 100% grado HPLC.
REACTIVOS
Metanol grado HPLC( Merk), estándar all-trans Retinol: Vitamina A (Sigma), hexano p.a. (Merck), etanol absoluto p.a. (Merk), solución de hidróxido de potasio al 50%, BHT ó Ácido Ascórbico (antioxidantes), y agua tridestilada o grado HPLC. Solución stock estándar de vitamina A: Se disolvieron 100 mg del estándar en 100 mL de etanol absoluto, con aproximadamente 0,002g de BHT, y se guardó la solución en congelación (-20°C), se verificó la pureza del estándar mediante la medición de su espectro de absorción (la vitamina A y los correspondientes ésteres muestran un espectro de absorción característico, donde la posición del pico máximo depende del solvente): en etanol, el retinol a 325 nm, tiene un coeficiente de extinción (E 1 %- 1 cm.) de 1843).
PROCEDIMIENTO
Se pesaron 20 g de la muestra de alimento infantil (papilla) en un balón de base plana, se colocó un magneto y se adicionó 70 mL de etanol absoluto. Se colocaron los tubos de reflujo y se agitó la mezcla hasta su ebullición con corriente de nitrógeno. Luego, se adicionó 20 mL de solución de KOH al 50% y se saponificó la mezcla por 30 minutos con agitación moderada. Antes de finalizar esta etapa se enjuagó el contenido con 50 mL de agua en 3 porciones. La solución se enfrió a temperatura ambiente y luego se filtró al vacío. Se colocó inmediatamente el contenido en una pera de separación de 250 mL y se adicionó 50 mL de hexano p.a. para proceder a la extracción. Se agitó la mezcla por 20 segundos y al separarse las fases se colocó la capa superior (fase orgánica) en un balón de 250 mL de base redonda que contenía aproximadamente 0,5 g de BHT ó ácido ascórbico. Se efectuó dos veces más la extracción y se juntaron los extractos en el balón de 250 mL. Se evaporó a sequedad el solvente, haciendo uso de un rotavapor con baño de agua a 40°C, se diluyó inmediatamente con metanol grado HPLC el residuo, y se llevó a volumen en un matraz volumétrico de 10 mL. Finalmente, se pasó la solución final por un filtro de 0,2 μm, llenándolos en viales ámbar de 2 mL para colocarlos en el inyector del cromatógrafo.
CÁLCULOS
Donde: Am (Área del pico de vitamina A en la muestra), As (Área del pico de vitamina A en el estándar), Cs (Concentración de vitamina A en el estándar, mg/ml), D (Factor de dilución), Wm (Peso de la muestra, g).
DISEÑO EXPERIMENTAL
Se analizaron muestras de papilla realizándose los ensayos en las muestras previamente homogenizadas con 2 analistas en 2 días diferentes para cuantificar la vitamina A expresada en μg/g. Cada analista realizó 08 ensayos por día, bajo condiciones de repetibilidad y reproducibilidad. La temperatura en el área de cromatografía líquida fue 23°C ± 2°C. La precisión del método analítico se estudió sobre el sistema, evaluando la dispersión de 4 inyecciones por cada uno de los 5 niveles de concentración de la solución estándar de vitamina A; y sobre el método, evaluando la dispersión de la preparación de la muestra. La evaluación correspondió a todo el procedimiento, desde la preparación de la muestra hasta la medición del analito por parte del instrumento.
La exactitud del método se evaluó en términos de recuperación. El analito se adicionó a la matriz, disuelto en el mismo solvente usado para la extracción, y se dejó en contacto con ésta por muchas horas antes de la extracción, para permitir su interacción. Para tal efecto, se trabajó con 3 niveles de concentración diferentes adicionados a la muestra. Las concentraciones de trabajo adicionadas fueron las siguientes: Nivel 1 = 3 ppm; Nivel 2 = 5 ppm; Nivel 3 = 7 ppm. Se tomaron 0,76 mL, 1,27 mL y 1,78 mL de una solución estándar de 100 ppm de vitamina A y se adicionaron a 6 muestras de papilla por nivel. Se dejó en contacto la solución estándar con las muestras durante toda la noche bajo refrigeración y, al día siguiente, se realizó el tratamiento y se hicieron las lecturas de los resultados de las 18 muestras.
La especificidad del método se representó mediante los espectros y el reporte de su correspondiente pureza con las muestras empleadas para la evaluación de la precisión y con la solución estándar. La evaluación de la especificidad del sistema se realizó mediante el software del equipo, trabajándose con la solución estándar y la evaluación. La determinación de los límites de detección y cuantificación se evaluó sobre las muestras empleadas para la prueba de precisión. Estos parámetros también fueron determinados por el software del equipo 6.
RESULTADOS
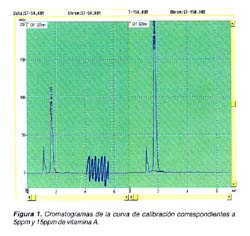
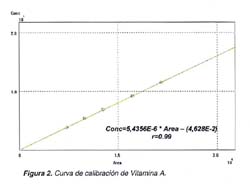
En la Figura 1 se muestran los cromatogramas representativos de dos concentraciones (mayor y menor) de vitamina A para la curva de calibración. El tiempo de retención de la vitamina A fue 3,91 ± 0,5 min, siendo el tiempo total de análisis para una muestra de 7 min. La respuesta de detección fue lineal en el rango de concentraciones de 5- 15 μg/g (Figura 2), obteniéndose un coeficiente de correlación r=0,99. El límite de detección del método en base a la señal / ruido (S/N) fue de 0,06 μg/g y el límite de cuantificación de 0,58 μg/g. El perfil de la precisión que se obtuvo en 16 determinaciones por analista en dos días diferentes, fue: CV de repetibilidad de 3,09% para el analista A, y 2,25% para el analista B vs. en tanto, el método oficial de la AOAC (CV de 3,62%); el CV de reproducibilidad fue 2,70 % vs el obtenido por el método oficial (de 9,72%).
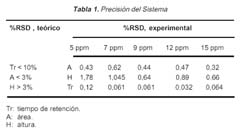
Los resultados de la precisión del sistema, basados en la variación del tiempo de retención, área y altura; se muestran en la Tabla 1. La recuperación obtenida fue de 97,98% vs. la obtenida por el método oficial de la AOAC (de 98,8%).
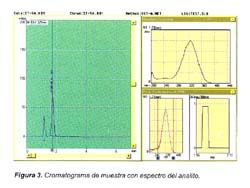
La especificidad del método se muestra en la Figura 3, donde se observa la ausencia de interferencias debido a la adecuada extracción del analito, y además se muestra la comparación del espectro del estándar puro vs el espectro del analito en la muestra.
DISCUSION
Varias técnicas han sido propuestas para la medición de la vitamina A en alimentos infantiles ó fórmulas infantiles. Cada una de ellas tiene sus ventajas y limitaciones, pero, comparado con otros métodos por HPLC, nuestra metodología propuesta tiene la ventaja de que el tratamiento de la muestra se realiza en menos tiempo, en relación al método oficial de la AOAC 992.06 Vitamina A (Retinol) in Milk-Based Infant Formula. Además, la columna que se utiliza en el método propuesto (C18) es más comercial que la columna del método de la AOAC (ciano), ya que esta última trabaja en fase normal siendo, por tanto, más difícil de controlar y por la naturaleza no polar del extracto, se debe usar cromatografía en fase reversa. El tiempo de corrida por muestra es también más corto en nuestra metodología (7 minutos), comparado con el método oficial que es de 10 minutos. Estas características contribuyen al menor costo del análisis.
Es necesario tener presente que tanto la saponificación, la isomerización y la ruptura de la vitamina A son retardados por la adición del antioxidante (ácido ascórbico) y el uso de nitrógeno, el cual interfiere con los agentes de oxidación presentes. Asimismo, el retinol y sus ésteres son rápidamente destruidos por la luz, el oxígeno y los ácidos, por lo que deben almacenarse en frascos ámbar o cubiertos con papel platino o su equivalente.
La muestra y el extracto de la muestra deben protegerse de la luz y la oxidación, evitándose la luz solar directa y la luz brillante. La iluminación artificial es mejor proporcionada por tubos fluorescentes dorados ó equivalentes. En ciertos casos, las diferentes etapas en el procedimiento deberían realizarse en material de vidrio ámbar para prevenir la degradación.
Dado que el calor también contribuye a la isomerización o a una posterior alteración de las vitaminas, debería evitarse el calor innecesario. Por lo tanto, debe tenerse cuidado que, por ejemplo, la evaporación de los solventes se realice lo más suave posible utilizando un evaporador rotatorio, con un buen control de la temperatura, un enfriamiento adecuado de los condensadores y un vacío óptimo. Además, se debe hacer un control espectrofotométrico de la pureza del estándar.
De acuerdo a los resultados obtenidos, podemos concluir que el Método de ensayo CENAN-DQ.ME.16: Método para la Determinación de Vitamina A (retinol) en alimentos infantiles instantáneos por HPLC es preciso, exacto, específico y sensible para los parámetros evaluados en este estudio, ya que se encuentran dentro de los rangos establecidos.
REFERENCIAS
1. Curso de Alimentación y Salud. 1998 Octubre 07; pág.1. URL disponible en: http://laisla.com/uned/guianutr/compdt1.htm [ Links ]
2. Morón C, Zacarías Y. Producción y manejo de datos de composición química de alimentos en nutrición. Universidad de Chile. Instituto de Nutrición y Técnica de los Alimentos (INTA). Santiago de Chile; 1999. [ Links ]
3. Curso de Alimentación y Salud. Recomendaciones RDA 1996 sobre vitaminas. URL disponible en: http://laisla.com/uned/guianutr/tablvita [ Links ]
4. Jebrell WH, Harris RS. The vitamins. Vol. 1. 2nd ed. New York: Academic Press; 1967. [ Links ]
5. Freed M. Methods of vitamin assay. 3ra ed. The Association of vitamins Chemists. New York: Interscience Publishers; 1966. [ Links ]
6. Rougereau A, Person O, Rougereau G. Determination of vitamins. In: ROCHE. Analysis of food constituents. Chapter 9. 1987. [ Links ]
Correspondencia: Ruth Pérez Calderón. Centro Nacional de Alimentación y Nutrición Tizón y Bueno 276, Lima 11, Perú. Telf.:(05111) 46395888-Fax:(0511)4639617 Email: r_whittembury@yahoo.es