Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Medicina Experimental y Salud Publica
versión impresa ISSN 1726-4634
Rev. perú. med. exp. salud publica v.17 n.1-4 Lima 2000
TRABAJOS ORIGINALES
Detección de Anticuerpos IgG Específicos para Sarampión mediante la Técnica de Inmunofluorescencia Indirecta
Mónica Nieto Z1; Ana Ortiz A2; José Chauca C3
1 Facultad de Ciencias Naturales y Matemáticas, Universidad Nacional Federico Villarreal.
2 División de Virología, Centro Nacional de Laboratorios en Salud Pública, Instituto Nacional de Salud.
3 Instituto de Medicina Tropical "Alexander Von Humboldt", Universidad Peruana Cayetano Heredia.
RESUMEN
La técnica de ínmunofluorescencia indirecta para detectar anticuerpos IgG específicos a sarampión (IFI-IgG) fue evaluada con la prueba de neutralización por reducción de placas (PRN) con 128 muestras de suero de personas con edades entre 0 y 15 años, 64 con antecedente de vacunación y 64 sin éste antecedente. El IFI-IgG alcanzó una sensibilidad de 80,4% y una especificidad de 100,0%, mostrando ser una prueba sencilla, reproducible, y tener correlación con PRN, aunque menos sensible que ésta última, especialmente cuando la PRN estimó títulos bajos de anticuerpos. Se concluye que la técnica IFI-IgG puede ser usada como método de rutina para la confirmación de sarampión en muestras de fase aguda y convalesciente de la enfermedad (sueros pareados), así como para estudios de prevalencia de anticuerpos en la comunidad, aunque no reemplazaría a la PRN.
Palabras claves: Técnica del anticuerpo fluorescente indirecta; IgG; Sarampión (fuente: BIREME).
ABSTRACT
Indirect Immunofluorescence testing for detection of measles specific IgG antibodies (IF-IgG) performed in National Institute of Health (Perú) was assessed using Plaque Reduction Neutralization test (PRN) in 128 sera from people aged between 0 and 15 years, 64 vaccinated and 64 unvaccinated. IF-IgG facilitated the detection of IgG antibodies, showing be simple to perform, good reproducibility and correlation with PRN, although it was less sensible than this, especially when the titers for antibodies were low. IFI-IgG technique can be used as a routine method for the confirmation of measles in samples from acute and convalescent phase of the illness (serum pairs) and it would be also useful in studies of antibodies prevalence in the community, although it would not replace PRN. 95.31% of the vaccinated group and 71.88% of the unvaccinated group were positive for measles using PRN.
Keys word. Fluorescent antibody technique, Indirect; IgG; Measles (source: BIREME).
INTRODUCCION
El sarampión es una enfermedad infecciosa altamente contagiosa, de etiología viral, importante como problema de salud pública debido a que su impacto en la morbilidad y mortalidad de los niños ha sido reconocido por muchos años en todo el mundo1-6. En 1994, la Organización Panamericana de la Salud (OPS) se propuso la meta de erradicar el sarampión en todos los países de América para el año 2000; sin embargo, a pesar de la extensión de las coberturas de vacunación y la disminución del número de casos notificados, esta enfermedad sigue siendo un problema en muchos países5.
En el Perú, el sarampión ha sido la enfermedad inmunoprevenible más importante de las últimas décadas, habiéndose notificado mayor número de casos en la niñez3,7 . La última epidemia de gran magnitud fue en 1992 con un registro de 22 605 casos y 347 defunciones, la que se extendió hasta 1993 con 1730 casos y 24 defunciones2,3,7. Ante esta situación, el Ministerio de Salud ha efectuado acciones preventivas para alcanzar la erradicación, logrando altas coberturas de vacunación durante los últimos cinco años, mediante intensas jornadas en menores de 15 años y la puesta en práctica de un sistema de vigilancia epidemiológica8.
El número de individuos con anticuerpos contra sarampión varía en cada país y región, por lo que es necesario realizar estudios periódicos de seroprevalencia que determinen los grupos susceptibles que harían posible la propagación de la enfermedad, pues la ausencia de circulación del virus no impide la posibilidad de brotes1,9. Para dicho propósito, se requiere de una prueba que sea eficaz, simple y de bajo costo, que permita realizar en forma rápida un diagnóstico serológico de la comunidad; por ello, el Laboratorio de Virus Inmunoprevenibles y Respiratorios del Instituto Nacional de Salud (INS) ha implementado la técnica de Inmunofluorescencia Indirecta (IFI) para la detección de anticuerpos IgG contra sarampión. La técnica de IFI es ampliamente utilizada y presenta muchas ventajas cuando se desea determinar cuantitativamente los niveles de anticuerpos10; sin embargo, antes de aplicar una técnica, es necesario evaluar su utilidad comparándola con un método referencial 11 que en el caso de sarampión es la prueba de Neutralización por Reducción de Placas (PRN), la cual es muy tediosa, costosa e involucra mucho tiempo6,12,13.
En el presente estudio se realizó la evaluación de la detección de anticuerpos IgG específicos para el virus del sarampión mediante la técnica de Inmunofluorescencia Indirecta estandarizada en nuestro laboratorio.
MATERIALES Y MÉTODOS
Selección de la muestra
El estudio se realizó con muestras de suero conservadas a –20°C, en el Laboratorio de Virus Inmunoprevenibles y Respiratorios del INS, recepcionadas durante el año 1998 de casos sospechosos de sarampión procedentes de diferentes departamentos del Perú.
Se incluyeron 128 muestras de personas con edades entre 0 y 15 años, con datos completos sobre inmunización, agrupándolos en: a) 64 muestras de personas con antecedente de vacunación y b) 64 muestras de personas sin antecedente de vacunación; cada muestra presentó resultado negativo a infección por sarampión (IgM negativo por ELISA). Se excluyeron las muestras de personas de 16 años de edad a más, así como las muestras hemolizadas o contaminadas. Se emplearon sueros controles positivos, de pacientes con diagnóstico positivo a infección por sarampión (IgM positivo por ELISA), confirmados por el Instituto de Salud Pública de Chile: 2 muestras positivas por respuesta a vacunación (de fase aguda y convalesciente) y 1 muestra positiva por respuesta a infección natural (de fase convalesciente).
Cultivo Celular
Se trabajó con la línea celular Vero (ATCC #CCL-81), la que se propagó en MEM-E (medio mínimo esencial con sales de Earle) suplementado con SBF (suero bovino fetal), pH de 7,1-7,2. El crecimiento de las células se mantuvo en medio con 8% de SBF y el mantenimiento en medio con 2% de SBF; a temperatura de 37°C 14.
Virus de Sarampión
Se trabajó con el virus de sarampión cepa vacunal Edmonston-Zagreb, utilizados en el Programa Ampliado de Inmunizaciones (PAI), de características: viva, atenuada, liofilizada, con 1000 TCID50 y desarrollada en células diploides humanas (WI-38).
El virus fue replicado en dos pasajes en células Vero. El antígeno de sarampión se obtuvo por lisis celular mediante congelamiento y descongelamiento (temperatura ambiente y –70ºC), seguido de centrifugación a 2500 rpm, por 15 minutos en refrigeración y la preservación del sobrenadante a –70°C15.
La titulación del antígeno de sarampión, se realizó por el método de plaqueo en cultivo de células Vero16, para determinar la concentración de partículas virales infectantes (en UFP/mL).
Prueba de Neutralización por Reducción de Placas (PRN)
Se procedió según el método descrito por Albrecht 12. Los sueros fueron diluidos seriadamente, al doble, empezando desde 1:4. Se determinó el título de anticuerpos del suero como la dilución del suero que redujo al 50% el número de placas virales por el método de Karber 17.
Técnica de Inmunofluorescencia Indirecta (IFI-IGG)
El fundamento de la técnica de inmunofluorescencia indirecta para detectar anticuerpos IgG contra sarampión se basó en los reportes de Riggs10.
En la producción de láminas para inmunofluorescencia se utilizó células Vero infectadas con virus de sarampión y células no infectadas (control de células normales). Las células presentaron 50-75% de efecto citopático, las que fueron dispersadas con tripsina-EDTA y homogenizadas con MEM-H (medio mínimo con sales de Hank), seguido de 3 lavados con MEM-H a 1200 rpm por 5 minutos, el precipitado celular se resuspendió en MEM-H + 10% SBF para obtener una concentración de 5 x 105 cel/mL. Luego, se dispensó 10 mL de suspensión celular en cada pocillo de la lámina, así como, células no infectadas, en la misma concentración. Las láminas se dejaron secar toda la noche y se fijaron en acetona a –20°C por 30 minutos, preservándose a –70°C hasta su uso.
Se empleó el conjugado anti-IgG humano marcado con FITC (isotiocianato de fluoresceína), de origen comercial (SIGMA), específico a la cadena G de la inmunoglobulina G humana.
El título de anticuerpos IgG de los sueros se estimó mediante diluciones seriadas al doble, en PBS 1X pH 7,2-7,4 empezando desde 1:4. Se colocó 10 mL de una dilución del suero en cada 2 pocillos (antígeno y control de células normales), empleando 1 control positivo, 1 control negativo y PBS 1X por cada prueba, se incubó a 37°C en cámara húmeda por 30 minutos, se lavó 2 veces con PBS, se agregó 10 mL de conjugado y se incubó a 37°C por 30 minutos con 2 lavados posteriores; finalmente, se hizo el montaje de las láminas con buffer glicerinado, pH 8,5.
La lectura se realizó en el microscopio de inmunofluorescencia, siendo el título del suero la dilución mayor en que se observó 1+ de fluorescencia en las células.
La reproducibilidad de los resultados de la técnica IFI-IgG, se determinó estimando el título de anticuerpos en 20 muestras de suero (elegidas de manera aleatoria), por repetición en dos tiempos diferentes, según Heck18. Se evaluó de manera paralela la estabilidad de las láminas de inmunofluorescencia conservadas a -70°C, usando láminas producidas con 6 meses de anterioridad.
Análisis de Datos
El análisis consistió en determinar el grado de relación lineal entre los títulos estimados por PRN e IFI-IgG, el porcentaje de respuesta positiva a la presencia de anticuerpos contra sarampión por PRN e IFI-IgG, y la reproducibilidad de PRN e IFI-IgG; para ello se recurrió al coeficiente de correlación de Pearson en sus formas bivariante y parcial (controla 3 o más variables), intervalos de confianza al 95%, y el test de Wilcoxon 19. Se utilizaron los programas SPSS/PC versión 9,0 y EPIINFO versión 6,1 en el análisis estadísticos.
RESULTADOS
Los títulos de anticuerpos contra sarampión de las muestras séricas de personas vacunadas presentaron valores entre 5 - 2089 por PRN y entre 4 -1024 por IFI-IgG; las muestras séricas de personas sin antecedente de vacunación mostraron títulos con valores entre 1 - 676 por PRN y entre 0 - 512 por IFI-IgG.
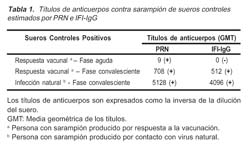
De los 3 sueros controles positivos, sólo 2 fueron positivos por IFI-IgG (Tabla 1).
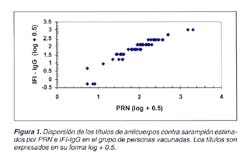
En la figura 1 se observa la dispersión de los títulos de anticuerpos contra sarampión de muestras séricas de personas vacunadas, estimados por PRN e IFI-IgG. El coeficiente de correlación bivariante de Pearson (r) entre los títulos estimados por ambos métodos fue significativo (r=0.941, p<0.001) así como el coeficiente de correlación parcial de Pearson (r=0.9388, p<0.001). La diferencia entre las formas bivariante y parcial no fue significativa (0.2%).
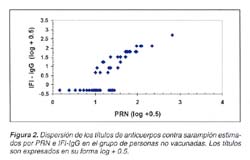
La figura 2 muestra la dispersión de los títulos de anticuerpos contra sarampión de muestras séricas de personas sin antecedente de vacunación, estimados por PRN e IFI-IgG. El coeficiente de correlación bivariante de Pearson (r) entre los títulos estimados por ambos métodos fue significativo (r=0,88, p<0,001), así como el coeficiente de correlación parcial de Pearson (r=0,8345, p<0,001). En tanto que la diferencia entre las formas bivariante y parcial no fue significativa (5,2%).
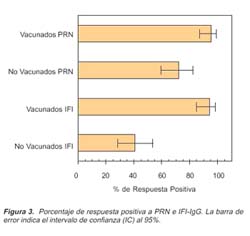
Al evaluar la presencia de anticuerpos contra sarampión con la prueba PRN fueron positivas: 95,31% (61/64) de las muestras de personas vacunadas y 71,88% (46/64) de las muestras de personas sin vacunar. Los intervalos de confianza al 95% fueron: 86,91% - 99,02% y 59,24% -82,40% para vacunados y no vacunados, respectivamente. En el caso de la técnica IFI-IgG, fueron positivas: 93,75% (60/64) de las muestras de personas vacunadas y 40,63% (26/64) de las muestras de personas sin vacunar. Los intervalos de confianza al 95% fueron: 84,76% - 98,27% y 28.51% - 53,63% para vacunados y no vacunados, respectivamente (Figura 3).
En el grupo de muestras estudiadas, la técnica IFI-IgG mostró una sensibilidad de 80,4% y una especificidad de 100%. IFI-IgG no detectó títulos menores a 16 y 32, en el grupo de vacunados y no vacunados, respectivamente.
Finalmente, al evaluar la reproducibilidad, no se encontró diferencias significativas entre los títulos estimados en dos réplicas por la técnica IFI-IgG (p=0,414).
DISCUSIÓN
El presente estudio se desarrolló para evaluar la detección de anticuerpos IgG específicos contra sarampión por la técnica de inmunofluorescencia indirecta (IFI-IgG) estandarizada en el Instituto Nacional de Salud.
Este método es usado en diversas etiologías, y permite determinar de manera cuantitativa los niveles de anticuerpos10. Es de suma importancia para la confirmación diagnóstica de sarampión, ya que se pueden titular los anticuerpos circulantes en fase aguda y convalesciente en muestras de suero20. También se empleó en estudios seroepidemiológicos en la comunidad, para evaluar la inmunidad y detectar grupos de riesgo (susceptibles)21 a esta enfermedad y aquellos que requieren refuerzos de vacunación.
En nuestro estudio, para determinar la utilidad de la prueba IFI-IgG, se empleó la prueba de Neutralización por Reducción de Placas (PRN) por su alta sensibilidad y especificidad6,12,13,21. La relación entre IFI-IgG y PRN, se determinó analizando los títulos de anticuerpos contra sarampión estimados por ambos métodos mediante el coeficiente de correlación de Pearson (r). En estudios de seroepidemiología se ha observado que los títulos varían de acuerdo a la edad 2,22, y los niveles de anticuerpos conferidos por la vacunación pueden decaer con el tiempo de vacunación20; por lo que se determinó el coeficiente de correlación de Pearson en sus formas bivariante y parcial, esta última incluyó las variables: edad y tiempo de vacunación, pues estas podían distorsionar la relación entre los títulos de anticuerpos. Se consideraron dos grupos de muestras séricas: a) de personas con antecedente de vacunación y b) de personas sin antecedente de vacunación; los coeficientes de correlación de los títulos de anticuerpos entre IFI-IgG y PRN, fueron significativos para ambos grupos. Es importante señalar que en ambos grupos, la corrección del coeficiente de correlación con las variables edad y tiempo de vacunación no distorsionó la relación entre los títulos de anticuerpos, pues no existió diferencia significativa, siendo menores al 10% entre los valores determinados por las formas bivariante y parcial19.
En la figura 2, se observó la dispersión de los títulos de anticuerpos de muestras de personas sin antecedente de vacunación, donde el coeficiente de correlación fue menor al de vacunados, por lo que el gráfico presentó un comportamiento diferente en los títulos bajos. Los títulos mayores o iguales a 8 fueron considerados positivos para PRN de acuerdo al CDC17. Según el estudio realizado por De Souza21 en inmunofluorescencia, los títulos mayores o iguales a 5 se consideraron positivos. En el presente estudio las diluciones de las muestras séricas en inmunofluorescencia iniciaron en 1:4, considerándose positivas aquellas con títulos mayores o iguales a 8 (1:8).
Con respecto a los porcentajes de respuesta positiva por PRN e IFI-IgG en personas vacunadas y no vacunadas (Figura 3), como era de esperarse, se observó mayor respuesta positiva en los vacunados, existiendo semejanza entre los intervalos de confianza de IFI-IgG y PRN; sin embargo, IFI-IgG presentó problemas para detectar títulos menores a 16. De manera contraria, los intervalos de confianza para ambos métodos en los no vacunados no tuvieron valores comunes, lo que hace suponer que ambas pruebas tienen un comportamiento diferente en este caso; asimismo, IFI-IgG no detectó eficazmente los títulos de anticuerpos menores a 32.
Por otro lado, se emplearon 3 controles positivos (IgM positivos por ELISA): dos por respuesta a la vacunación (de fase aguda y convalesciente) y uno por infección natural (de fase convalesciente). La tabla 1 muestra que los tres controles fueron positivos por PRN; sin embargo sólo dos sueros (de fase convaleciente) fueron positivos por IFI-IgG. La muestra de fase aguda negativa por IFI-IgG fue obtenida un día posterior al exantema, en que los niveles de anticuerpos en el suero son mínimos, especialmente las inmunoglobulinas G 20, observándose nuevamente que IFI-IgG no detectó los niveles bajos de anticuerpos.
La seroconversión es un incremento significativo mayor a 4 títulos entre dos muestras séricas obtenidas en fase aguda y convalesciente (sueros pareados) de la enfermedad 23 , dicho incremento fue evidente mediante la técnica de IFI-IgG, en los sueros pareados positivos por respuesta vacunal.
Se evaluó la utilidad de la técnica de inmunofluorescencia indirecta determinando su sensibilidad y especificidad para detectar anticuerpos IgG contra sarampión en suero humano enfrentándola con la prueba PRN sobre la base de los resultados (positivo y negativo) de las 128 muestras en estudio. La prueba PRN detecta toda clase de inmunoglobulinas específicas al virus del Sarampión 6, por ello, es importante mencionar que las muestras en estudio presentaron resultado negativo a anticuerpos IgM contra Sarampión (por ELISA), por lo que aparentemente ambas técnicas detectaron lo mismo, es decir anticuerpos IgG. La técnica IFI-IgG presentó una sensibilidad menor a PRN, lo que se evidenció claramente cuando los títulos de anticuerpos fueron bajos. De acuerdo a otros investigadores 4,6,12,21.24 la prueba PRN capta títulos muy bajos en comparación con otros métodos; de manera similar y bajo las condiciones en que el presente estudio fue realizado, en tanto que la técnica IFI-IgG no fue útil para captar los títulos bajos de anticuerpos. La especificidad de la técnica IFI-IgG fue alta y comparable con PRN.
La variabilidad de una prueba se mide mediante su reproducibilidad. Al respecto, en nuestro estudio no se encontró diferencias significativas entre los títulos de la primera y segunda réplica por IFI-IgG. Además, las láminas para IFI-IgG presentaron estabilidad de antígeno hasta 6 meses después de su producción.
En conclusión, la técnica IFI-IgG puede ser de mucha utilidad como método de rutina para confirmar y evaluar seroconversión en los casos de sarampión, por su aplicación sencilla, y reproducibilidad; además de ser útil para los estudios de seroprevalencia y facilitar la descentralización a través de la Red Nacional de Laboratorios de Referencia en Salud Pública, aunque teniendo presente que no puede sustituir a la prueba PRN, cuando los niveles de anticuerpos son bajos.
REFERENCIAS
1. Alvarez MT, Muñoz O, Bugarín JC, Magos C, Gómez A, Tapia R. Seroepidemiología del sarampión en individuos de 5 a 14 años de edad de la República Mexicana. Bol Méd Hosp Infant Méx 1995; 52 (5): 274-9. [ Links ]
2. Cabezas C, Kanashiro R, Reyna MC, Strull M, Seminario R, López J, et al. Seroprevalencia de anticuerpos contra sarampión en población escolar de Coishco - Ancash (Perú) 1993. Bol Soc Peru Enf Infec Trop 1994; 3(3-4): 15-8. [ Links ]
3. Castillo ME. Comportamiento clínico epidemiológico del sarampión en infantes hospitalizados en el Instituto de Salud del Niño durante el año 1992. Bol Soc Peru Enf Infec Trop 1994; 3(3-4): 7-13. [ Links ]
4. Oliveira SA, Siquiera MM, Mann GF, Costa AJ, Almeida MT, Stavola MS, et al. Measles antibody prevalence after mass immunization campaing in Niterói, State of Río de Janeiro, Brazil. Rev Inst Med Trop Sao Paulo 1996; 38(5): 355-8. [ Links ]
5. Organización Panamericana de la Salud (OPS). La Erradicación del Sarampión. Guía Práctica. Cuaderno Técnico Nº 41. Washington, D.C. 1999. [ Links ]
6. Ratnam S, Gadag V, West R, Burris J, Oates E, Stead F, et al. Comparison of commercial enzyme immunoassay kits with plaque reduction neutralization test for detection of measles virus antibody. J Clin Microbiol 1995; 33(4): 811-5. [ Links ]
7. Ministerio de Salud (MINSA) - Programa Ampliado de Inmunizaciones (PAI). Sarampión. Bol Soc Peru Enf Infec Trop 1994; 3(3-4): 14. [ Links ]
8. Aguinaga A, Mesarina A, Toledo J, Falconí E, Minaya P, Cerna F. Talleres Macroregionales "Fortalecimiento de las Actividades para la Erradicación del Sarampión". Manual Técnico. Perú. 2000. [ Links ]
9. Centers for Disease Control and Prevention (CDC). Progress toward elimination of measles from the Americas. Morb Mortal Wkly Rep 1998; 47(10):189-93. [ Links ]
10. Riggs JL. Immunofluorescence staining. In: Schmidt NJ, Emmons RW. Diagnostic procedures for viral, rickettisial and chlamydial Infections. 6ta edition. American Health Association. Washington D.C. 1989. [ Links ]
11. Riegelman RK, Hirsch RP. Cómo estudiar un estudio y probar una prueba: lectura crítica de la literatura médica. Bol Of Sanit Panam 1991; 111 (6): 534-55. [ Links ]
12. Albrecht P, Herrmann K, Burns GR. Role of virus strain in conventional and enhanced measles plaque neutralization test. J Virol Methods 1981; 3: 251-60. [ Links ]
13. Chen RT, Markowitz LE, Albrecht P, Stewart JA, Mofenson LM, Preblud SR, et al. Measles antibody: reevaluation of protective titers. J Infect Dis 1990; 162:1036-42. [ Links ]
14. Schmidt NJ. Cell culture procedures for diagnostic virology. In: Schmidt NJ, Emmons RW. Diagnostic procedures for viral, rickettsial and chlamydial Infections. Sexta edición. American Health Association. Washington D.C. 1989. [ Links ]
15. De Oliveira LC. Preparo de antígeno de sarampo para inoculaçao animal. En: Controle de qualidade da vacina contra o sarampo - Controle Microbiológico. TCTP. Módulo 2,1997. p.54. [ Links ]
16. Ferreira E, Coutinho E. Teste de potência - Método plaqueamiento. En: Controle de qualidade da vacina contra o sarampo - Controle Microbiológico. TCTP. Módulo 2,1997. p.42-47. [ Links ]
17. Heath JL. Measles IgG and IgM Enzyme Immunoassay - Isolation and identification of measles virus. Versión 3. 1997. [ Links ]
18. Heck FC, Williams JD, Pruett J. Interpretation of spectrophotometric absorbance values to define results of enzymelinked inmunosorbent assays. J Clinic Microb 1980; 11 (4):398-401. [ Links ]
19. Daniel W. Bioestadística. Quinta edición. Ed. Limusa S.A. México. 1995. [ Links ]
20. Griffin DE, Bellini WJ. Measles virus. In: Fields P, Knipe DM, Howley PM Fields Virology. 3era edición. Lippincott-Raven Publishers, Philadelphia. 1996. [ Links ]
21. De Souza VA, Pannuti CS, De Godoy CV, Albrecht P, Lopes MH, Mendoça J. Comparison of indirect immunofluorescence test for measles antibodies with hemagglutination inhibition and plaque neutralization tests. Rev Inst Med Trop Sao Paulo 1990; 32(5): 360-3. [ Links ]
22. Herrera EA, Santos JI, Escamilla G, Villaseñor A, Avila C, Alvarez MT, et al. Estudio seroepidemiológico de sarampión en ciudad Nezahualcóyotl, México: una estrategia de evaluación. Bol Méd Hosp Infant Méx 1995; 52(12): 690-6. [ Links ]
23. Taylor RN. Quality control in immunoserology. In: Rose NR, Friedman H, Fahey J. Manual of clinical laboratory immunology. 3ra edition. 1986. [ Links ]
24. Goncalves G, Cutts F, Forsey T, Andrade HR. Comparison of a commercial enzyme immunoassay with plaque reduction neutralization for maternal and infant measles antibody measurement. Rev Inst Med Trop Sao Paulo 1999; 41(1):21-6. [ Links ]
Correspondencia: Ana Ortiz Armas. Instituto Nacional de Salud. Calle Cápac Yupanqui 1400, Lima 11, Perú. Apartado Postal 471.Telf.: (0511) 4719920-Fax:(0511) 4710179. Email: inmuno@ins.sld.pe