Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Peruana de Medicina Experimental y Salud Publica
Print version ISSN 1726-4634
Rev. perú. med. exp. salud publica vol.18 no.1-2 Lima Jan./jun. 2001
TRABAJOS ORIGINALES
Factores de riesgo para infección por hepatitis C en dos unidades de diálisis de Lima-Perú
Javier Cieza Z1-2; Franck Pinares A1-2; Juana Hinostroza S2; Luis Estremadoyro S2; César Loza M2.
1 Servicios Médicos CORPAC.
2 Universidad Peruana Cayetano Heredia.
RESUMEN
En el Perú se reportan prevalencias de anticuerpos para hepatitis C (antiVHC) entre 60-90% en centros de hemodiálisis. Objetivo: Se determinaron variables asociadas a la presencia de antiVHC en pacientes en hemodiálisis en Lima, Perú. Materiales y métodos: En marzo del 2000, se diseñó un estudio de casos y controles. Fueron seleccionados 38 casos con marcador antiVHC positivo y 38 controles antiVHC negativos en 2 unidades de diálisis de Lima; además ambos grupos fueron apareados para edad y sexo. Odds ratio (OR) y sus intervalos de confianza (IC95%) fueron usados para investigar la asociación entre la variable dependiente (diagnóstico de antiVHC) y variables independientes (antecedente de transfusiones, antigüedad de hemodiálisis, centros de diálisis previos, antecedente de hepatitis, antígeno australiano, anticuerpos para hepatitis B, antecedentes de cirugía, pareja con hepatitis C, turno de diálisis, rechazo al transplante, centro de primera hemodiálisis). Resultados: Las variables que fueron significativas en el análisis univariado fueron: número de transfusiones sanguíneas, antigüedad en hemodiálisis y presencia de antígeno australiano (p<0.05). Por análisis de regresión logística multinomial la única variable que se comportó como factor de riesgo para infección por VHC fueron las transfusiones sanguíneas (OR: 4.8, IC95%: 1.6-14.4), y la presencia de antígeno australiano se comportó como factor protector de la infección por hepatitis C en el momento del estudio (OR: 8.7x10-9). Conclusiones: Estos hallazgos sugieren que en el Perú las transfusiones sanguíneas siguen siendo un determinante de la infección por hepatitis C en unidades de hemodiálisis.
Palabras clave: Hepatitis C/transmisión; Diálisis; Factores de riesgo (fuente: BIREME).
ABSTRACT
The prevalence for hepatitis C antibodies (antiHCV) has been described between 60% and 90% in peruvian hemodialysis centers. Objective: To determine variables associated to the positivity for antiVHC in hemodialysis patients in Lima-Peru. Materials and methods: In March 2000, a case-control study was designed. All 38 antiHCV positive cases and 38 negative controls from 2 dialysis units in Lima were included. Both groups were matched for age and sex. Odds ratio (OR) and their intervals of confidence (IC95%) were used to investigate the association between the dependent variable (positivity for antiHCV) and independent variables (antecedent of blood transfusions, time in hemodialysis, number of previous dialysis centers, hepatitis antecedent, australian antigen positivity, hepatitis B antibodies, previous surgery, positive hepatitis C sexual partner, turn of dialysis, transplant rejection, center of first hemodialysis. Results: The variables that reached significance in the univariante analysis were: number of blood transfusions, time in hemodialysis and the positivity for australian antigen (p<0.05). By multinornial logistic regression analisys the only variable that showed a risk for HCV infection was blood transfusions (OR: 4.8, IC95%: 1.6-14.4) The positivity for australian antigen behaved like a "protective factor" for hepatitis C infection (OR: 8.7x10-9). Conclusions: Blood transfusions are strongly associated to hepatitis C infection in peruvian hemodialysis unit patients.
Key words: Hepatitis C/transmission; Dyalisis; Risk factors (source: BIREME).
INTRODUCCIÓN
El estudio observacional prospectivo de aproximadamente 10,000 pacientes seleccionados aleatoriamente de unidades de diálisis en Europa, Japón y EEUU, describe una prevalencia de infección para hepatitis C de 13%, 19.6% y 10%, respectivamente (DOPPS: Estudio de prácticas y consecuencias en diálisis en tres continentes)1.
En 1999, la prevalencia nacional de anticuerpos contra el virus de la hepatitis C (antiVHC) en población en hemodiálisis de los Estados Unidos fue 8.9%; otros estudios de pacientes en hemodiálisis han informado prevalencias de antiVHC entre 10% y 36% en adultos2-4.
Esta realidad epidemiológica contrasta con algunos datos reportados en el Perú. Un estudio seroepidemiológico en una cohorte de personas en Lima-Perú, durante los años de 1986 a 1993 mostró que la tasa de hepatitis C fue 15.6%, y los grupos de riesgo con mayores tasas de antiVHC fueron los pacientes en hemodiálisis, hemofílicos, mayores de 39 años, mujeres y personas con bajo nivel educativo5. En grupos seleccionados como la población en diálisis, en cinco unidades de diálisis en Lima la prevalencia de anticuerpos fue 83.9%6. En otras unidades de diálisis del país, referencias no publicadas reportan prevalencias de antiVHC entre 60% y 90%.
El VHC se transmite eficazmente por la exposición percutánea directa a sangre infectada. Los factores de riesgo asociados con la infección de VHC entre los pacientes en hemodiálisis demostradas en el mundo incluyen: historia de transfusiones sanguíneas, volumen de sangre transfundida y años en diálisis7. El estudio Dialysis Outcomes and Practice Pattern Study (DOPPS) reporta que la probabilidad de infección por el VHC fue asociado estadísticamente a la edad, la raza negra, vivir en Japón y Europa y a la ausencia de políticas adecuadas de vacunación para VHB1.
El número de años en diálisis es el mayor factor de riesgo independiente que se asocia con las proporciones más altas de infección por VHC. Conforme los pacientes tienen más tiempo en diálisis, el predominio de infección por VHC aumenta de un promedio de 12% para los pacientes en diálisis<5años a un promedio de 37% para los pacientes en diálisis>5 años2,4,8. En Lima, un estudio realizado en 1996 muestra que el único factor de riesgo asociado a la infección por hepatitis C fue el tiempo de permanencia en hemodiálisis6.
El objetivo del estudio fue determinar las variables asociadas a la presencia de antiVHC en pacientes en hemodiálisis en dos unidades de diálisis de Lima, Perú en el año 2000.
MATERIALES Y MÉTODOS
En marzo del 2000, se realizó un estudio caso-control para identificar variables relacionadas a infección por HVC en 2 unidades de diálisis de Lima, Perú: el Centro de Diálisis CORPAC y el Centro de Diálisis de la Universidad Peruana Cayetano Heredia (UPCH). Se seleccionaron 38 casos, representados por pacientes con marcador antiVHC positivo. Para cada caso fue elegido al azar un control con marcador antiVHC negativo (38 controles). Ambos grupos fueron apareados para la edad y el sexo. En cada unidad de diálisis participante, tanto los casos como los controles, fueron entrevistados por un médico entrenado en recolectar datos mediante un cuestionario estandarizado. La entrevista se refirió a antecedentes en los 2 años precedentes. La información obtenida en estos cuestionarios involucró la variable dependiente antiVHC positivo, mediante test de ELISA 1 para anticuerpos contra el virus de la hepatitis C, y las variables independientes, tales como: antecedente de transfusiones, antigüedad de hemodiálisis, centros de diálisis previos, antecedente de hepatitis, antígeno australiano, anticuerpos para hepatitis B, antecedentes de cirugía, pareja con hepatitis C, turno de diálisis, rechazo al transplante, centro de primera hemodiálisis.
Odds ratio (OR) y sus intervalos de confianza (IC95%) fueron usados para investigar la asociación entre la variable dependiente (diagnóstico de antiVHC) y las variables independientes. Mediante un análisis univariado se seleccionaron aquellas variables significativas para infección de HVC y, aquellas que no fueron significativas pero con un ORA, fueron incluidas en un análisis de regresión logística multinomial. Solamente las variables que en la ecuación de regresión persistieron con un nivel de significancia (área para dos colas) menores a 0.05 fueron catalogadas como variables independientes en el modelo logístico9.
RESULTADOS
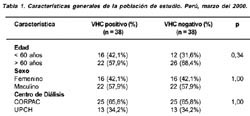
En la Tabla 1 se muestran factores, como edad > 60 años, sexo y centro de diálisis que se distribuyen tanto en casos como en controles de forma semejante (p > 0.05). Las variables que alcanzaron significancia en el análisis univariado para buscar factores asociados a infección de hepatitis C fueron: más de 2 transfusiones sanguíneas (OR: 4.4), antigüedad en hemodiálisis más de 36 meses (OR: 3.2) y presencia de antígeno australiano (p<0,05) (Tabla 2).
Por análisis de regresión logística multinominal (Tabla 3), las únicas variables que mostraron un riesgo para infección por VHC fueron las transfusiones sanguíneas (OR: 5,06, IC95%: 1,7-15,0) y la presencia de antígeno australiano se comportó como factor protector de la infeccion por hepatitis C en el momento de estudio (OR: 1x10-9).
DISCUSIÓN
En nuestro país pocos son los estudios que se han hecho en la identificación de variables asociadas a riesgo de tener anticuerpos VHC positivos, y realmente en las unidades de diálisis del país vivimos una epidemia de esta infección lo cual se traduce en tasas de prevalencia del 60% al 90% y tasas de incidencia que van del 40 a 80 casos/100 pacientes año riesgo (resultados inéditos en publicación) cifras 20 a 40 veces por encima de las tasas de seroconversión reportadas en Europa, Japón y EE.UU1,6,7. De los factores evaluados en el análisis de regresión logística multinomial sólo resultaron significativas las transfusiones de sangre y un factor protector, (presencia de antígeno australiano).
Antes de discutir las implicancias de estos hallazgos, es necesario mencionar algunas limitaciones del estudio: Las unidades de diálisis que participaron en el estudio no son representativas de todos los centros de diálisis de la ciudad de Lima; sin embargo, los resultados fijan una tendencia muy fuerte de que las transfusiones sanguíneas se comportan como variable independiente y tienen un riesgo 5 veces más alto de infección por VHC que aquellos pacientes que no fueron sometidos a transfusiones sanguíneas.
Si bien la mejor forma de identificar a los casos es procesando la muestra de sangre con la técnica de reacción en cadena de la polimerasa (PCR) para virus de la hepatitis C, la infección no detectable por dosaje de anticuerpos para VHC es mínima y no altera significativamente los resultados10.
Los mecanismos de transmisión de VHC en la población en diálisis no están claramente definida. Para pafíses desarrollados las transfusiones sanguíneas ya no son un problema en el control de la infección por VHC y el impacto que ha causado usar pruebas para detectar anticuerpos contra el VHC, de mayor sensibilidad y especificidad (90-97%) ha sido crítica en el control de calidad de los bancos de sangre para la detección de bolsas de sangre infectadas, y más bien han centrado su atención en factores intradiálisis, como rigurosas medidas de aislamiento11,12. Sin embargo, muchos estudios13,14,15 no muestran que esta medida tenga un efecto protector en la transmisión de VHC. Asimismo, la alta prevalencia de infección en las unidades de diálisis ha sido mostrada como un factor determinante en la transmisión de hepatitis C16; implementación de medidas de bioseguridad protegerían contra la transmisión de esta infecci6n17,18. Factores extradiálisis como intervenciones quirúrgicas se han reportado como factor de riesgo, factor que no es importante en nuestro medio.
Nuestra realidad epidemiológica es diferente; primero, porque nosotros no hemos superado la barrera del buen control de calidad de los bancos de sangre. El tipo de prueba usada en muchos bancos de sangre en el Perú para detección de anticuerpos de hepatitis C es el Elisa 1, cuya sensibilidad de la prueba no es más que 75% y su valor predictivo positivo está entre 70% y 85%, indicadores que contrastan con lo reportado para ELISA 2 y 3, con sensibilidad alrededor del 95% y valor predictivo positivo entre 88% y 95%; situación que ha reducido la incidencia de transmisión de hepatitis C postransfusión en los bancos de sangre de los EE.UU19.
La influencia de la infección por hepatitis C en la producción de anticuerpos para el virus de la hepatitis B ha sido reportada. El estudio de Navarro JL et al. sugiere que después de la vacunación para hepatitis B, un título de anticuerpos>100UI/L es necesario para mantener el nivel de anticuerpos por un año, y que la seropositividad para HVC puede reducir la efectiviclad de la vacunaci6n para hepatitis B en pacientes en hemodiálisis20,21.
El análisis de riesgo de nuestro estudio, muestra que el antígeno australiano se comporta más bien corno un factor protector, situación no observada en otros estudios, de tal manera que del resultado se desprende por lo menos 3 hipótesis: a) que la infección por hepatitis B activa (presencia de HBsAg positivo) limita o disminuye la respuesta de anticuerpos para hepatitis C; b) que los pacientes antígeno australiano positivo sean hospederos con polbre respuesta inmune por la enfermedad de fondo (IRCt) y c) que ambos virus ingresen en competitividad biológica para infectar al hospedero. Conjeturas no resueltas hasta el momento.
En la literatura han sido descritos otros factores protectores relacionados fundamentalmente a la capacidad de respuesta del hospedero en un gen asociado al HLA, incluso que determinó remisiones espontáneas de la infección por virus de la hepatitis C22,23.
En conclusión, el presente estudio sugiere que cuando el paciente es expuesto a 2 o más transfusiones sanguíneas el riesgo de infección por hepatitis C se incrementa 5 veces.
REFERENCIAS BIBLIOGRÁFICAS
1. Bragg JL, Young EW, Rayner HC, Arrighi M, Greenwood RN, Akiba T, et al. Hepatitis in hemodialysis patients from three continents: The Dialysis Outcomes and Practice Pattern Study (DOPPS). J Am Soc Nephrol 2000; 11: 258A. [ Links ]
2. Niu MT, Coleman PJ, Alter MJ. Multicenter study of hepatitis C virus infection in chronic hemodialysis patients and hemodialysis center staff members. Am J Kidney Dis 1993; 22: 568-73. [ Links ]
3. Zeldis JB, Depner TA, Kuramoto IK, Gish RG, Holland PV. The prevalence of hepatitis C virus antibodies among hemodialysis patients. Ann Intern Med 1990; 112: 958-60. [ Links ]
4. Hardy NM, Sandroni S, Danielson S, Wilson WJ. Antibody to hepatitis C virus increases with time on hemodialysis. Clin Nephrol 1992; 38: 44-8. [ Links ]
5. Sánchez JL, Sjogren MH, Callahan JD, Watts DM, Lucas C, Abdel-Hamid M, et al. Hepatitis C in Peru: risk factors for infection, potential aiatrogenic transmission, and genotype distribution. Am J Trop Med Hyg 2000; 63(5-6): 242-8. [ Links ]
6. De los Ríos R, Miyahira J, Colichón A, Cieza J. Prevalencia de anticuerpos antihepatitis C en pacientes en hemodiálisis crónica. Rev Med Hered 1997; 8(2): 67-71. [ Links ]
7. Moyer LA, Alter MJ. Hepatitis C virus in the hemodialysis setting: a review with recommendations for control. Semin Dial 1994; 7: 124-7. [ Links ]
8. Selgas R, Martínez-Zapico R, Bajo MA. Prevalence of hepatitis C antibodies (HCV) in a dialysis population at one center. Perit Dial Int 1992; 12: 28-30. [ Links ]
9. Breslow NE, Day NE. Statistical methods in cancer research, volume I: the analysis of case-control studies. Lyon, France, IARC Scientific Publication Nro 32, 1980. p. 191-246. [ Links ]
10. Schneeberger PM, Keur I, Van der Vliet W, Van Hoek K, Boswijk H, Van Loon AM, et al. Hepatitis C virus infections in dialysis centers in the Netherlands: A national survey by serological and molecular methods. J Clin Microbiol 1998; 6:1711-15. [ Links ]
11. Dos Santos JP, Loureiro A, Cenderoglio Neto M, Pereira BJ. Impact of dialysis room and reuse strategies on the incidence of hepatitis C virus infection in haemodialysis units. Nephrol Dial Transplant 1996; 11: 2017-22. [ Links ]
12. Zamir D, Storch S, Zonder HB, Zamir C, Weiner P. Hepatitis C virus seroconversion and genotype prevalence in patients and staff on chronic haemodialysis. J Clin Gastroenterol 1999; 28: 23-8. [ Links ]
13. CDC. Recommendations for preventing transmission of infections among chronic hemodialysis patients. April 27, 2001 / 50(RR05); 1-43 (Fecha de acceso julio del 2001). Disponible en URL: http://www.cdc.aov/hepatitis [ Links ]
14. Pereira JG, Lewey AS. Hepatitis C virus infection in dialysis and renal transplantation. Kidney Int 1997; 51: 981-99. [ Links ]
15. CDC. Recommendations for prevention and control of hepatitis C virus (HCV) infection and HCV-related chronic disease. MMWR 1998; 47: RR-19: 1-39 (fecha de acceso julio del 2001). Disponible en URL: http://www.cdc.aov/hepatitis [ Links ]
16. Petrosillo N, Gilli P, Serraino D, Denticop P, Male A, Ragni P, et al. Prevalence of infected patients and understaffing have a role in hepatitis C virus transmission in dialysis. Am J Kidney Dis 2001; 37: 1004-10. [ Links ]
17. Mc Laughlin KJ, Cameron SO, Good T, McCruden E, Ferguson JC, Davidson F, et al. Nosocomial transmission of hepatitis C virus within a British dialysis centre. Nephrol Dial Transplant 1997; 12: 304-9. [ Links ]
18. Jadoul M, Cornu C, Van Ypersele de Strihou C. Universal precautions prevent hepatitis C virus transmission: A 54 month follow-up of the Belgian multicenter study. The Universitaires Cliniques St-Luc (UCL) Collabo-rative Group. Kidney Int 1998; 53: 1022-25. [ Links ]
19. Gretch DR. Diagnostic tests for hepatitis C. Hepatology 1997; 26 (3 Suppl 1): 43S-47S. [ Links ]
20. Navarro JF, Teruel JL, Mateos ML, Marcen R, Ortuno J. Antibody level after hepatitis B vaccination in hemodialysis patients: influence of hepatitis C virus infection. Am J Nephrol 1996; 16(2): 95-7. [ Links ]
21. Navarro JF, Teruel JL, Mateos ML, Marcen R, Ortuno J. Hepatitis C virus infection decreases the effective antibody response to hepatitis B vaccine in hemodialysis patients. Clin Nephrol 1997; 47(3): 206. [ Links ]
22. Quinn PG, Jamal MM, Carey JD, Arora S, Harris T, Johnston DE, Sonnemberg A. A case control study of the factors associated with spontaneous resolution of hepatitis C viremia. Am J Gastroenterol 1999; 94(3): 668-73. [ Links ]
23. Cramp ME, Carucci P, Underhill J, Naoumov NV, Williams R, Donaldson PT. Association between HLA class II genotype and spontaneous clearance of hepatitis C viremia. J Hepatol 1998; 29(2): 207-13. [ Links ]
Correspondencia: Franck Pinares Astete.
Av. Aramburú 872, Lima 34, Perú.
Fax: 4412930.
E-mail. erickpinar@hotmail.com