Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Peruana de Medicina Experimental y Salud Publica
Print version ISSN 1726-4634
Rev. perú. med. exp. salud publica vol.18 no.3-4 Lima July/dic. 2001
TRABAJOS ORIGINALES
La inmunocromatografía para el diagnóstico de la infección por Taenia solium en Mesocricetus auratus mediante la detección de coproantígenos*
Hermes Escalante A 1; Obed Huamanchay C 1; Kelly Davelois A 2.
1 Facultad de Ciencias Biológicas, Universidad Nacional de Trujillo-Perú.
2 Centro de Análisis e Investigación Escalabs e.i.r.l. Trujillo-Perú.
RESUMEN
Objetivo: Evaluar la técnica de inmunocromatografía para el diagnóstico de la infección por Taenia solium en Mesocricetus auratus "hámsters" mediante la detección de coproantígenos. Materiales y métodos: Se produjo en Oryctolagus cunniculus conejo IgG anti-antígenos de excreción/secreción (ES) de T. solium y en Capra hircus "cabra" IgG anti-IgG de conejo. Parte de las IgG anti-antígenos ES de T. solium fue conjugado con oro coloidal. La inmunocromatografía se llevó a cabo utilizando tiras de nitrocelulosa en las cuáles se fijó dos bandas con anticuerpos de captura; en la primera, las IgG anti-antígenos ES de T. solium (banda de prueba), y en la segunda las IgG anti-IgG de conejo (banda control). La técnica fue evaluada con un "pool" de tres muestras de medio de cultivo con antígenos ES de T. solium, Hymenolepis nana, Dyphillobotrium pacificum y de larvas de Anisakis simplex, así como con un "pool" de tres muestras fecales de hámsters no parasitados, de parasitados por H. nana y de siete muestras fecales de hámsters parasitados por T. Solium. Resultados: La inmunocromatografía permitió detectar antígenos de T. solium en muestras de medio de cultivo con antígenos ES específicas y en heces de hámsters parasitados por T. solium mediante la coloración de la banda de prueba, siendo negativo cuando se utilizó medios con ES de otros helmintos y sin antígenos, así como con muestras de heces de hámsters infectados por otros parásitos y de no parasitados. En todas las tiras usadas se observó coloración de la banda control. Conclusión: La técnica de inmunocromatografía es capaz de detectar antígenos de T. solium, tanto en medio de cultivo como en heces de hámsters, faltando evaluar la sensibilidad y la especificidad con muestras fecales humanas para el diagnóstico de la teniosis mediante la detección de coproantígenos.
Palabras clave: Teniasis/diagnóstico; Tests inmunológicos; Antígenos (fuente: BIREME).
ABSTRACT
Objective: To assess the immunochromatography assay for the diagnosis of Taenia solium infection in hamsters (Mesocricetus auratus) by coproantigen detection. Materials and methods: IgG anti-T. solium excretory/secretory (E/S) antigens were produced in rabbits and IgG anti-rabbit IgG, in Capra hircus "goat". A portion of the anti-T. solium E/S IgG antigens was conjugated with colloidal gold. Immunochromatography was performed in nitrocellulose paper strips in which two transversal bands with capture antibodies were fixed. The first band had rabbit anti-T. solium E/S IgG antigens (test band), and the second band had goat IgG anti-rabbit IgG (control band). The assay was assessed using a pool of three culture media samples with E/S antigens from T. solium, Hymenolepis nana, Dyphillobotrium pacificum and of Anisakis simplex larvae, as well a by a pool of three faecal samples from non-infected hamsters, from hamsters infected with H. nana, and from a pool comprising seven hamsters infected with T. solium. Results: Immunochromatography detected T. solium antigens in media samples with T. solium E/S antigens and in stool samples from hamsters infected with T. solium by staining of the test band. Negative results were obtained with culture media samples with E/S antigens from other helminths and in pooled stool samples from hamsters infected with H. nana as well as from non-infected animals. In all strips used the control band got stained. Conclusions: The immunocromatography assay is able to detect T. solium antigens, both in culture media and in stools from infected hamsters, but its sensitivity and specificity should be tested in human fecal samples for diagnosing Tenia infections through coproantigen detection.
Key words: Teniasis/diagnosis; Inmunologic tests; Antigens (source: BIREME).
INTRODUCCIÓN
La teniosis es una infección intestinal del hombre causada por las formas adultas de Taenia solium y T. saginata, y que se adquieren al ingerir carne de cerdo y vacuno con cisticercosis viables 1, respectivamente. Esta parasitosis tiene importancia epidemiológica por ser el hombre el único hospedero definitivo de T. solium y, por lo tanto, el responsable de la dispersión en el ambiente de los huevos del parásito, forma infectante de la cisticercosis humana y animal 2.
El diagnóstico de la teniosis se realiza generalmente por técnicas coproparasitoscópicas tradicionales, las cuáles no han sufrido modificaciones a pesar de su baja sensibilidad y especificidad, debido principalmente a factores biológicos del parásito y a la falta de experiencia para poder identificar los huevos de Taenia sp 3. El uso de estas técnicas en estudios epidemiológicos no permiten obtener datos precisos de prevalencia de la teniosis en las diferentes partes del mundo. Se sabe que el porcentaje de esta parasitosis es de aproximadamente 1,0% y 0,3% en poblaciones de zonas endémicas de México y Perú, respectivamente 4,5.
Para mejorar el diagnóstico de la teniosis, en los últimos años se han evaluado las técnicas de enzyme-linked immunosorbent assay (ELISA) y DOT-ELISA, basados en la detección de antígenos de Taenia sp. en muestras fecales. La primera, en condiciones experimentales, alcanzó sensibilidades cercanas al 100%, sin dar reacciones cruzadas con muestras fecales de personas sanas o de pacientes con otras parasitosis; y la segunda, mostró una sensibilidad del 88% y una especificidad del 100%; sin embargo, estas dos pruebas no son capaces de distinguir una teniosis por T. solium de una producida por T. Saginata 6-8. Recientemente se ha determinado que la técnica de enzyme-linked immunoelectro transfer blot (EITB) o Western Blot puede ser usada en el diagnóstico de la teniosis mediante detección de anticuerpos séricos utilizando antígenos de excreción/secreción de T. solium obtenidos en cultivo 9.
La inmunocromatografía es una técnica inmunológica que permite visualizar la reacción antígeno-anticuerpo por la acumulación del oro coloidal del conjugado en zonas específicas del papel de nitrocelulosa donde se fijan previamente anticuerpos de captura 10,11. En la actualidad, esta técnica se viene utilizando para el diagnóstico rápido de varias enfermedades, a través de la detección de antígenos en diversos líquidos biológicos, tales como en infecciones por Streptococcus b-hemolítico, Chlamydia, virus de la hepatitis, malaria, etc 12.
El uso de la técnica de ELISA para la detección de coproantígenos de Taenia sp. permitirá mejorar el diagnóstico de la teniosis y realizar estudios epidemiológicos con resultados que se acerquen a la realidad; sin embargo, esta prueba tendrá sus limitaciones de aplicación por requerir de un laboratorio equipado, que no siempre está disponible en zonas endémicas. Estos antecedentes justifican la realizaci6n de investigaciones orientadas a desarrollar técnicas eficientes, rápidas y fáciles de realizar, que puedan ser aplicadas en el diagnóstico de la teniosis en zonas rurales y suburbanas, donde esta enfermedad es frecuente.
El presente trabajo tuvo como objetivo evaluar la técnica de inmunocromatografía para el diagnóstico de la infección por Taenia solium en Mesocricetus auratus "hámsters" mediante la detección de coproantígenos, empleando inmunoglobulinas G producidas en Oryctolagus cunniculus conejo y un conjugado formado por oro coloidal e inmunoglobulinas G de conejo anti-antígenos de excreción/secreción de T. solium.
MATERIALES Y MÉTODOS
MATERIAL BIOLÓGICO
En el estudio se utilizaron 50 ejemplares de Mesocricetus auratus "hámster" para el desarrollo experimental de T. solium y la obtención de muestras fecales, cinco especímenes de Oryctolagus cunniculus "conejo" y dos ejemplares de Capra hircus "cabra" para la producción de anticuerpos específicos de tipo IgG. Igualmente, se emplearon ejemplares adultos de Diphyllobothrium pacificum, Hymenolepis nana y larvas de Anisakis simplex.
PROCEDIMIENTOS
Obtención de antígenos de excreción/secreción de Taenia solium
Los céstodes se obtuvieron por infección experimental de hámster siguiendo los procedimientos establecidos 13-15.
Los antígenos fueron obtenidos de acuerdo a los procedimientos propuestos por Espino16 y Wilkins y col 9, para lo cual se incubaron asépticamente en el medio MEM (Minimum Essential Medium) Eagle de Sigmaâ, ejemplares de T. solium a razón de cinco ejemplares por placa. El medio con los antígenos de excreción/secreción (E/S) del parásito se recolectó a las 24 y 48 horas de incubación y se conservó con inhibidores de proteasas (Pefabloc, Pepstatin A y Leupeptin) a -20°C.
La concentración de los antígenos obtenidos fue determinada por el método de Bradford 17, verificando su presencia en el medio por la técnica de "Western Blot" 18, para lo cual se utilizó sueros de pacientes con teniosis confirmada.
Producción de anticuerpos policlonales
Se inmunizaron conejos con 0,125 mg de antígenos E/S de T. solium y cabras con 4 mg de IgG de conejo para producir anticuerpos específicos, siguiendo protocolos establecidos por Espino 16 y Campbell 19. Las IgG fueron purificadas por precipitación con sulfato de amonio, la desalinización por cromatografía de exclusión molecular en columnas 10 DG, Econo-Pac y la obtención de inmunoglobulinas G puras por cromatografía de afinidad en columnas de gel azul DEAE Affi-Gel de Bio Radâ, siendo su presencia verificada por Western Blot18, utilizando antígenos E/S de T. solium obtenidas de cultivo y las IgG de cabra anti-IgG de conejo por inmunodifusión doble empleando IgG específicas.
Conjugación de los anticuerpos con oro coloidal
La preparación del conjugado con oro coloidal se llevó a cabo siguiendo la metodología propuesta por Beesley 20 y Hermanson 21. La conjugación de las IgG anti-antígenos de T. solium con oro coloidal de 20 nm se realizó mezclando, gota a gota, 100 mL de los anticuerpos a la concentración de 0,22 mg/mL y a un pH de 9,2, con 1000 mL de la suspensión de oro coloidal a pH 9,0. Luego, se adicionó una solución de albúmina sérica de bovino (BSA) al 10% a pH 9,0, eliminando los anticuerpos no conjugados por centrifugación a 9000 rpm por 1 hora y a 4°C. El sedimento fue resuspendido con 20 mL de buffer A (buffer salino Tris/HCl a pH 8,2 que contiene 1% de BSA y 0,1% de azida de sodio).
Evaluación de la eficacia del conjugado por la técnica de inmunodot
La eficacia del conjugado preparado se evaluó por la técnica del dot-immunogold assay "inmunodot", según los procedimientos establecidos por Hids y cols 22 y Dykman y Bogatyrev 23.
En cuatro áreas circulares delimitadas de una tira de nitrocelulosa se colocó en el primer círculo 2 mL de los antígenos E/S de T. solium a la concentración de 0,0125 mg/mL, en el segundo círculo 2 mL de medio MEM sin antígenos, en el tercer círculo 4 mL de IgG de cabra anti-IgG de conejo a la concentración de 0,075 mg/mL y, en el cuarto círculo, suero preinmune de cabra. La tira se incubó con el conjugado a una dilución de 1/20.
Evaluación de la eficacia de la inmunocromatografía
Se realizó por procedimientos especificados por Millipore 10, para lo cual, con la ayuda del Bio Dot SF (Bio Rad ®) se fijó a 1 cm del borde inferior de la membrana de nitrocelulosa de 10,5 x 7,5 cm una banda transversal IgG de conejo anti-antígenos E/S de T. solium (banda de prueba) y, a 0,5 cm de ésta, una banda de IgG de cabra anti-IgG de conejo (banda control) para actuar como anticuerpos de captura. Luego, la membrana fue cortada en tiras de 2,5 x 0,5 cm y de 2,5 x 0,3 cm, pegándose en la parte superior de cada una de ellas una porción de papel de filtro absorbente grueso para facilitar la cromatografía.
La migración de la suspensión se evalúo colocando en un tubo de vidrio de 10 x 40 mm, 10 mL del conjugado, 10 mL de buffer A y 100 mL de muestra conocida. Se mezcló por agitación y luego se sumergió la parte inferior de la tira de ensayo preparada, dejando que la mezcla difunda por capilaridad durante 15 minutos, luego se lavaron las tiras con agua destilada estéril, para llevar a cabo la lectura de los resultados.
La eficacia de la técnica de inmunocromatografía fue realizada con las siguientes muestras:
- Antígenos de excreción/secreción de T. solium, H. nana, D. pacificum y de larvas III de A. simplex obtenidos en medio MEM Eagle, siendo el primer helminto obtenido por infección experimental en M. auratus.
- Muestras fecales de hámsters parasitados por T. solium y no parasitados, así como de hámsters parasitados por H. nana. Cada muestra de heces se mezcló con PBS-Tween 20 al 0,3% a la proporción de 1 a 4, siendo luego centrifugada a 3000 rpm por 10 minutos, recuperando el sobrenadante que fue conservado a -20°C.
RESULTADOS
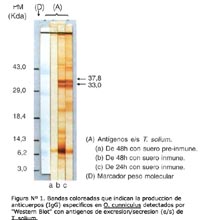
Los ejemplares de T. solium produjeron en el medio MEM Eagle antígenos de excreción/secreción a la concentración de 125 a 150 mg/mL. De los conejos se obtuvieron 5 mL de IgG anti-antígenos de T. solium a la concentración de 150 a 200 mg/mL, los que fueron puestos en evidencia por la técnica de "Western Blot" usando antígenos de excreción/secreción obtenidas de cultivo, que permitió mostrar las bandas antigénicas de 33,0 y 37,8 Kda específicos para T. solium; además, se observó que los antígenos obtenidos a las 24 horas presentaron una mayor especificidad que los obtenidos a las 48 horas de cultivo, por presentar un menor número de bandas inespecíficas (Figura N° 1).
De las cabras se obtuvieron 10 mL de IgG anti-IgG de conejo a la concentración de 300 a 350 mg/mL, cuya presencia se evidenció por la técnica de inmunodifusión doble, tanto de los sueros inmunes donde se observa varias bandas de precipitación, como de las inmunoglobulinas purificadas con una sola banda de precipitación (Figura N°2).
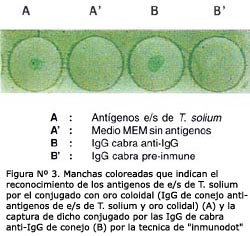
Se encontró que la concentración óptima de anticuerpos que debe ser adicionada a 1 mL de la suspensión de oro coloidal para su estabilización fue de 20 mg, lográndose conjugar las IgG de conejo anti-antígenos E/S de T. solium con oro coloidal. Este conjugado fue capaz de detectar por la técnica de "inmunodot" antígenos específicos fijados sobre el papel de nitrocelulosa, donde aparecen puntos de color rojo claro a los cinco minutos de incubación, siendo negativo en el lugar donde se fijó medio MEM sin antígenos; igualmente, el conjugado fue capturado por las IgG de cabra anti-IgG de conejo apareciendo el color rojo en la zona donde se fijaron las IgG de cabra inmunizada y no donde se fijó el suero pre-inmune de cabra (Figura N° 3).
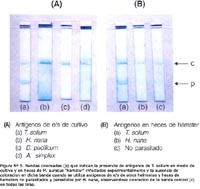
Se comprobó que la técnica de inmunocromatografía podía detectar simultáneamente la presencia del conjugado (IgG de conejo anti-antígenos de T. solium y oro coloidal) sin antígenos en una banda control (c), la que contiene anticuerpos de cabra anti-IgG de conejo y muestra una banda de color rojo en la parte superior de la tira; igualmente, detectó a los antígenos antes mencionados adheridos al conjugado en la banda de prueba (p), que contiene anticuerpos de conejo a los antígenos de T. solium, y muestra una banda coloreada en la parte inferior de la tira, manteniéndose la coloración en la banda control (Figura N° 4).
La inmunocromatografía permitió detectar antígenos de excreción/secreción de T. solium en un pool de tres muestras de medios donde se cultivó este cestode mediante la coloración de la banda de prueba (p); sin embargo, no se observó coloración en dicha banda cuando se utilizaron pooles de tres muestras de medio donde se cultivaron H. nana, D. pacificum y larvas de A. simplex. Igualmente, la técnica permitió detectar antígenos de T. solium en un pool de heces de siete hámsters parasitados con este céstode evidenciado por la coloración de la banda de prueba, siendo negativa con los pooles de heces de tres hámsters parasitados con H. nana y de tres no parasitados. En todas las tiras usadas se observó coloración de la banda control (c) (Figura N° 5).
DISCUSIÓN
En el presente trabajo se utilizaron antígenos de excreción/secreción de T. solium por ser más específicos y antigénicos que los somáticos. Algunos autores sostienen que dichos antígenos son enzimas o productos eliminados por este parásito como parte de su metabolismo y por tanto son propios de cada especie 16,24 . Estos antígenos, por producirse en forma continua y eliminarse con las heces de los huéspedes infectados, permiten el diagnóstico de esta parasitosis mediante su detección por técnicas inmunoenzimáticas de ELISA y DOT-ELISA6-8.
El empleo de los antígenos de T. solium obtenidos a las 24 horas de cultivo se debió a que presentaron las bandas de 37,8 y 33,0 Kda que son consideradas específicas 9, asimismo, porque se presentaron un menor número de bandas inespecíficas, en comparación con las obtenidas a las 48 horas de cultivo. Esto se explicaría porque al aumentar el tiempo de cultivo, los antígenos de excreción/secreción disminuyen paulatinamente, aumentando los antígenos somáticos, como consecuencia del deterioro del céstode9-16.
El uso de anticuerpos conjugados con oro coloidal en las técnicas de diagnóstico rápido permiten la detección de antígenos en muestras biológicas, siendo el objetivo principal de estas técnicas alcanzar la señal específica más intensa con una mínima o nula reacción inespecífica 25. Esta reacción se observó al detectar anticuerpos y antígenos específicos fijados a la membrana de nitrocelulosa utilizando un conjugado con oro coloidal en la prueba de inmunodot, confirmándose la eficacia del conjugado preparado 23.
La inmunocromatografía permitió comprobar que el complejo de oro coloidal con los antígenos migran sobre el papel de nitrocelulosa para reaccionar específicamente con los anticuerpos inmovilizados en el papel, dando bandas coloreadas por la acumulación del oro coloidal del conjugado. El papel de nitrocelulosa permite la migración por capilaridad de líquidos y solutos y a la vez conserva activos los anticuerpos fijados 10,11.
Por lo general, el tiempo de realización de las pruebas por inmunocromatografía dura de 5 a 15 minutos según el kit empleado. Este tiempo de lectura se debe entre otros factores, al tipo de membrana empleada, las que tienen diferentes tasas de flujo (migración). En el presente trabajo, el tiempo de migración fue muy prolongado para una técnica de diagnóstico rápido, lo que podría disminuir si se emplean membranas de nitrocelulosa de mayores tasas de flujo, donde pueden detectarse menores concentraciones de antígenos 10.
Los antígenos de T. solium presentes en la muestra control experimental, ya sea de medio de cultivo o heces de antígeno-conjugado que migra sobre la membrana siendo capturados por la primera banda (banda de prueba), en tanto que el conjugado libre, que debe estar en exceso, es capturado en la segunda banda (banda control), apareciendo las dos bandas teñidas de un color rojo claro por la acumulación del oro coloidal (esto se interpreta como un resultado positivo); en cambio, con la muestra negativa, sólo se tiñe la banda control. Sin embargo, si no se observa reacción en las dos bandas, esto indicaría deficiencias en la prueba. Estos resultados concuerdan con las interpretaciones de las pruebas realizadas con esta técnica 10,11.
Se recomienda continuar las investigaciones orientadas a estandarizar esta técnica para el diagnóstico rápido de la teniosis humana mediante la detección de coproantígenos, evaluando la sensibilidad, la especificidad y la reproducibilidad de la prueba con muestras fecales humanas de pacientes parasitados con T. solium y otros helmintos.
AGRADECIMIENTO
Al Ms. Enrique Díaz Limay, a la Br. Erika Hart Chu y al Br. Miguel Iglesias Medina de la Universidad Nacional de Trujillo por proporcionarnos ejemplares de H. nana, D. pacificum y larvas de A simplex y muestras fecales de hámsters parasitados por H. nana. Al Dr. Hugo García Lescano de la U. P. Cayetano Heredia por la revisión del manuscrito.
REFERENCIAS
1. Botero D, Tanowitz HB, Meiss LM, Wiffner M. Taeniasis and cysticercosis. Infect Dis Clin North Am 1993; 7(3): 683-97. [ Links ]
2. Sarti E, Flisser A, Schantz P, Bronfman M, Wijeyaratne P. Intervention strategies for tha prevention and control of Taenia solium. Taeniosis and cysticercosis in rural areas of Mexico. En: Garcia HH, Martínez SM. T. solium. Taeniasis/Cisticercosis. Lima: Editorial Universo; 1999. p. 327-38. [ Links ]
3. Schantz P, Sarti E. Diagnostic methods and epidemiologic surveillance of Taenia solium infection. Acta Leidensia 1989; 57: 153-63. [ Links ]
4. Sarti E, Schantza P, Lara-Aguilera RH, Gómez-Dandoy M, Flisser A. Taeniasis and cysticercosis in a mexican village. Trop Med Parasitol 1988; 39: 194-8. [ Links ]
5. Díaz F, García HH, Gilman RH, González AE, Castro M, Tsang V C W, et al. Epidemiology of teniasis and cysticercosis in a peruvian village. Am J Epidemiol 1992; 135: 875-82. [ Links ]
6. Allan JC, Avila G, García-Noval J, Flisser A. Inmunodiagnosis of taeniasis by coproantigen detection. Parasitology 1990; 101: 473-7. [ Links ]
7. Allan JC, Mencos F, García-Noval J, Sarti E, Flisser A, Wang Y, et al. Dispstick dot ELISA for detection of Taenia coproantigens in humans. Parasitology 1993; 101: 473-7. [ Links ]
8. Allan JC. Detection of Taenia solium antigens in feces. In: Garcia HH, Martinez SM. T solium. Taeniasis/Cysticercosis. Lima: Editorial Universo; 1999. p. 61-7. [ Links ]
9. Wilkins PP, Allan JC, Verástegui M, Acosta M, Eason AG, Garcia HH, et al. Development of a serology assay to detection Taenia solium taeniasis. Am J Trop Med Hyg 1999; 60(2):199-204. [ Links ]
10. Millipore A. A short guide for developing inmunochromatographic test strips (en línea). 2nd edition; 2001 (Fecha de acceso: diciembre 2001). URL disponible en: http://www.com/oemproducts. [ Links ]
11. Engler KH, Efstratiou A, Norn D, Koslov RS, Selga I, Glushkevich TG, et al. Immunochromatographic strip test for rapid detection of diphtheria toxin: description and multicenter evaluation in areas of low and high prevalence of diphtheria. J Clin Microbiol 2002; 4(l): 80-3. [ Links ]
12. Veda Lab. New test generation. In: Clinical Laboratory International. Reed Elsevier Publication 2000; 24(7): 13. [ Links ]
13. Letonja T. El hámster Mesocricetus auratus, huésped definitivo experimental de Taenia solium. Boletín Chileno de Parasitología 1975; 30(1-2): 9-12. [ Links ]
14. Merchant MT, Aguilar L, Avila G Robert L, Flisser A, Wilims K. Taenia solium description of the intestinal implantation sites in experimental hamster infections. J Parasitol 1998; 84(4): 681-5. [ Links ]
15. Maravilla PG, Avila G, Cabrera V, Aguilar L, Flisser A. Comparative of Taenia solium in experimental models. J Parasitol 1998; 84(5): 882-6. [ Links ]
16. Espino A. Mantenimiento in vitro de adultos de Fasciola hepática: obtención de antígenos de excreción-secreción. Rev Salud Animal 1988; 10: 287-93. [ Links ]
17. Bradford MM. A rapid and sensitive method for the quantitation of micrograms quantities of proteins utilizing the principle of protein dye binding. Annal Biochem 1976; 72: 248-54. [ Links ]
18. Tsang V C W. Enzyme-linked inmunoelectrotransfer blot technique (Western Blot) for human T. lymphotropic virus type III/lymphadenopathy-associated virus (HTLV-/Human Services). Atlanta: Public Health Service Centers for Disease Control; 1986. Immunology Series N° l5. [ Links ]
19. Campbell AM. Production and purification of antibodies. In: Diamandis EP, Christopoulus T. Inmunoassay. USA: Academic Press; 1996. p. 95-115. [ Links ]
20. Beesley J. Colloidal gold. A new perspective for cytochemical marking. Royal Microscopical Society Handbook N. 17. Oxford Science Publications. Oxford University Press; 1989 (Date of acces: november 2001). URL disponibility in: http://www.research.com/gold/gold8htm. [ Links ]
21. Hermanson G. Bioconjugate Techniques. USA: Edit. Academic Press; 1996. p. 593-604. [ Links ]
22. Hinds S, Kamal K, Farid Z, Mansour N, Boctos F, Woody J. Dot-enzime-linked immunosorbent assay (DOT-ELISA) for the rapid diagnosis of human fascioliasis. J Parasitol 1989; 75(4): 549-52. [ Links ]
23. Dykman LA, Bogatyrev VA. Use of the dot-immunogold assay for the rapid diagnosis of acute enteric infections. Published by Elsevier Science B.V.; 1999 (Fecha de acceso: noviembre 2001). URL disponible en: http://www.fems-microbiology.org. [ Links ]
24. Díaz A, Li-Elian O. Identificación mediante western blot de inmunógenos de Fasciola hepática reconocidos por los sueros de ratón infectados experimentalmente. Rev Cub Med Trop 1998; 50(1): 12-7. [ Links ]
25. British Biocell International. Production of higth quality rapid test kits. Clinical Laboratory International. A Reed Elsevier Publication 2000; 24(3): 22. [ Links ]
* Trabajo financiado por el Consejo Nacional de Ciencia y Tecnología según el Contrato de Subvenciones N° 877-2000-OAL.
Correspondencia: Hermes Escalante Añorga. Facultad de Ciencias Biológicas,
Universidad Nacional de Trujillo. Jr. San Martín 380, Trujillo-Perú. Telefax 044-235841
E-mail: hea@latinmail.com.pe