Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Medicina Experimental y Salud Publica
versión impresa ISSN 1726-4634
Rev. perú. med. exp. salud publica v.18 n.3-4 Lima jul./dic. 2001
TRABAJOS ORIGINALES
Neutralización por reducción en placas como método específico para el Diagnóstico Serológico de Fiebre Amarilla
Maribel Acuña B 1; Roger Castillo O 1; María García M 2.
1 Facultad de Ciencias Biológicas. Universidad Nacional Federico Villarreal.
2 División de Virología, Centro Nacional de Salud Pública, Instituto Nacional de Salud.
RESUMEN
Objetivos: Estudiar la capacidad neutralizante de muestras séricas humanas para ser empleada como prueba de confirmación frente a otras técnicas y evaluar la relación de neutralización en diferentes poblaciones para cepas de FA: 287-78 (nativa) y 17D (referencial). Materiales y métodos: Se empleó la cepa 17D para la estandarización de la prueba en células VERO utilizando dos métodos (sólido y semi-líquido); además, se seleccionaron muestras séricas humanas en base al antecedente vacunal (presente o ausente), a la procedencia (endémica y no endémica) y la positividad a virus del dengue, las cuáles fueron evaluadas por ELISA. Las poblaciones seleccionadas se enfrentaron por la prueba estandarizada (PRNT) frente a las cepas de FA: 17D (cepa vacunal derivada del prototipo Asibi) y 287-78 (primer aislamiento de FA del Instituto Nacional de Salud del Perú). Resultados: Se obtuvieron buenos resultados con el método semi-líquido, siendo el séptimo día el óptimo de coloración de las placas. De los cuatro grupos seleccionados, tres fueron positivos por ELISA y los resultados por PRNT fueron para la suspensión 17D, 29 negativos y 67 positivos con títulos entre 1:10 y 1:2560; y para la cepa 287-78, 17 negativos y 79 positivos con títulos entre 1:10 y 1:2560. Conclusiones: La técnica semi-líquida con tiempo de coloración al séptimo día ofrece óptimos resultados en plaqueo y neutralización. Además, el ELISA resultó ser menos específico frente al PRNT y se encontró variación en relación a títulos y capacidad neutralizante en algunos sueros para ambas cepas.
Palabras clave: Fiebre Amarilla/diagnóstico; Tests de neutralización; Test de ELISA (fuente: BIREME).
ABSTRACT
Objectives: To study the neutralizing capability of human serum samples in order to be used as a confirmation test compared to other techniques, and to assess the neutralization relationship in different populations for 287-78 (native) and 17D (referential) YF strains. Materials and methods: The 17D strain was used to standardize the test in VERO cells using two methods (solid and semi-liquid). Additionally, human serum samples selected on the basis of having received YF vaccine (yes/no), their origin, and being positive for Dengue virus, and these samples were assessed using an ELISA. The selected populations were confronted using the standardized test (PRNT) with YF 17D strains (vaccinal strain derived from the Asebi prototype) and with YF 287-78 (the first YF strain isolated by the Peruvian National Institute of Health). Results: Accurate results were obtained with the semi-liquid technique, the seventh day was the optimum time for plate staining. Three of the four selected groups were positive for ELISA. The findings for PRNT were: using YF 17D strain, 29 negatives and 67 positives, with titers between 1:10 and 1:2560; and for YF 287-78, 17 negatives and 79 positive, with titers between 1:10 and 1:2560. Conclusions: The semi-liquid technique with the staining time at the seventh day showed up optimal results for plating and neutralization. Additionally, the ELISA method turned out to be less specific compared to PRNT and variations related to titers and neutralizing capability in some sera for both strains were detected.
Keys word: Yellow fever/diagnois; Neutralization tests; Enzyme-linked inmunosorbent assay (source: BIREME).
INTRODUCCIÓN
La Fiebre Amarilla (FA) es una enfermedad febril aguda, causada por un virus de la familia Flaviviridae, género Flavivirus, siendo considerada como una de las arbovirosis más importantes que se presentan en nuestro país 1,2.
En la actualidad, se cuenta con una vacuna antiamarílica sumamente eficaz (vacuna de virus vivo atenuado de la cepa 17D3), la cual brinda protección individual y colectiva a la población, detiene la propagación geográfica de la enfermedad creando una barrera de inmunidad y previene epidemias 4. Sin embargo, a pesar de ello, la FA continúa siendo una causa importante de morbilidad y mortalidad en amplias zonas tropicales de América y Africa 3,5,6.
En el Perú, para efectos de la vigilancia diagnóstica y confirmación, el Instituto Nacional de Salud (INS) recibe muestras séricas de todo el país con el diagnóstico clínico de FA para la realización de los procedimientos de laboratorio correspondientes, como: aislamiento y tipificación viral, serología por ELISA de captura de IgM e IgG (MAC y GAC ELISA) e inhibición de hemaglutinación (IHA) a FA. Ante la falta de una prueba de confirmación serológica y para estudios de investigación epidemiológica, se propone la estandarización de la prueba de neutralización por reducción en placas (PRNT) como método para el diagnóstico serológico especifico de FA. Para ello, se evaluó la capacidad neutralizante de los anticuerpos presentes en poblaciones seleccionadas frente a la cepa 287-78 (primer aislamiento en el Perú) y la cepa vacunal 17D, así como se confrontó los resultados entre PRNT y una prueba inmunoenzimática (ELISA).
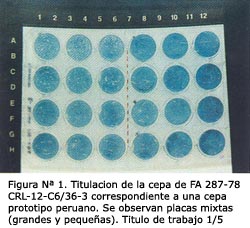
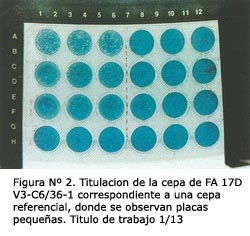
MATERIALES Y MÉTODOS Se incluyeron 96 muestras séricas provenientes de la seroteca de Virología del INS, procedentes de zonas endémicas y no endémicas del país obtenidas entre los años 1998-2000. Las características y procedencia de las muestras se mencionan en la Tabla N° 1. Como patrones se utilizaron sueros hiperinmunes específicos (HMAF) para FA y Dengue y sueros controles positivos y negativos (IgM e IgG). PRODUCCIÓN DEL STOCK DE SEMILLAS VIRALES Se utilizaron 2 cepas de FA: 287-78 CRL-12 (décimo segundo pasaje en cerebro, de ratón lactante), aislada a partir de una muestra sérica procedente de la ciudad de Ayacucho (brote epidémico del año 1978) y la cepa vacunal 17D-V3 (tercer pasaje en células VERO), como referencial. Ambas cepas fueron mantenidas mediante pasajes sucesivos en cultivos de células C6/36 con la finalidad de incrementar la cantidad de partículas virales. Para ello, se inoculó 0,3 mL de cada cepa en frascos de 25 cm2 con monocapa confluente de células C6/36 y, para permitir la absorción viral, se dejó incubando 60 minutos a temperatura ambiente. Luego de este periodo, se adicionó 5 mL del medio de mantenimiento (E-MEM 2% SBF) y se dejó incubando a 28°C por 10 días. Al cabo de esto, se sometió al proceso de congelamiento y descongelamiento para asegurar la homogeneidad del virus en la suspensión. Finalmente, se centrifugó a 2500 rpm por 15 minutos; y el sobrenadante se alicuotó 1 mL/vial, para luego ser conservado a -70°C. La confirmación viral se realizó mediante la prueba de inmunofluorescencia indirecta (IFI). Siguiendo el mismo procedimiento, se replicó hasta el tercer pasaje con el propósito de incrementar el título viral, esto para el caso de la cepa 287-78; mientras que la cepa 17D se mantuvo en el primer pasaje, debido a que el título fue aceptable en relación a cantidad y claridad de las placas. TITULACIÓN DE LAS SEMILLAS VIRALES POR PLAQUEO-LÍNEA CELULAR VERO. TÉCNICA SEMI-LÍQUIDA PARA FA Para la titulación viral se siguió el método descrito por Morens7 con algunas modificaciones: a partir de cultivos de células VERO clon E-33 con 4 días de siembra se preparó una suspensión de 3 x 105 células/mL en medio de crecimiento (E-MEM 10% SBF) de la siguiente manera: se eliminó el medio de crecimiento del frasco de 75 cm2 y se lavó la monocapa de células con Tripsina-DTA 10x, luego se adicionó 1,5 mL de Tripsina-EDTA 10x, dejándose incubar 1 minuto a temperatura ambiente hasta observar el desprendimiento de las células, momento en el cual se eliminó la tripsina. Se suspendieron las células adicionando 10 mL de medio de crecimiento y se homogenizó con la ayuda de una pipeta. Se realizó el conteo de células en cámara de Neubauer, calculando el promedio de sus 4 cuadrantes y ajustando la concentración a 3 x 105 células/mL con la siguiente fórmula: Volumen final a añadir (10 x X cel.)-10 10 :constante obtenida en función al factor de la cámara de Neubauer. Para la titulación viral por plaqueo se sembró 0,5 mL de la suspensión celular por pocillo, en placas plásticas de poliestireno de 24 pocillos. Luego, se inoculó 0,05 mL (por triplicado) de las diluciones seriadas en base 10 del virus (a partir de la suspensión original hasta la dilución 10-6). Después de 150 minutos de incubación a 37°C en atmósfera con CO2 al 5%, se adicionó el medio de soporte a razón de 0,5 mL/pocillo. Se incubaron las placas en las mismas condiciones durante 7 días, período en el cual se colorearon las células con solución de azul-negro de naftol y ácido acético (colorante de plaqueo), para luego proceder al conteo de las placas virales formadas. Una vez contadas, se calculó el título del virus en unidades formadoras de placas por mililitro (UFP/mL) usando la siguiente fórmula: Título del virus = X placas x 20 x inversa de la dilución viral. donde: X placas : promedio de placas contadas. PROCESAMIENTOS DE LAS MUESTRAS SÉRICAS POR MAC Y GAC ELISA Se utilizó la técnica descrita por el laboratorio de Arbovirus y Rickettsias del INS8. El antígeno empleado para esta técnica correspondió a la cepa de FA 287-78. PROCESAMIENTOS DE LAS MUESTRAS SÉRICAS POR PRNT PARA FA Se realizaron diluciones al cuádruple de cada muestra do suero, previamente inactivados a 56°C por 30 minutos (para inactivar al complemento), desde 1:10 a 1:1024 en medio de mantenimiento como diluyente. Un volumen de 0,03 mL de cada suero fue incubado a 4°C durante toda la noche con 0,03 mL de la dilución de trabajo del virus calculado para dar 15-30 UFP/0,05 mL en el volumen final de la mezcla virus-suero y/o controles. Después de la incubación, fueron inoculados 0,05 mL de la mezcla virus-suero sobre células VERO, previamente sembradas en placas de poliestireno de 24 pocillos en forma similar al descrito en la titulación viral por plaqueo. Los pasos siguientes fueron similares a los antes descritos (Ver titulación de las semillas virales por plaqueo). Para cada suero se contó el número de placas virales en cada dilución y se determinó el porcentaje de reducción por cada muestra en relación con el virus control, utilizando la siguiente fórmula: % PRINIT = 100 – (N° de placas formadas en dilución de suero x 100) Toda muestra con un porcentaje de reducción del número de placas mayor o igual a 70% se consideró positiva de anticuerpos, teniendo en cuenta los criterios empleados por Morens7 y Alvarez 9. ANÁLISIS ESTADÍSTICO Para el análisis de los resultados se utilizó el programa SPSS/PC versión 7,5. Para determinar el coeficiente de correlación entre las cepas de FA 287-78 y 17D se utilizaron los análisis de Tau-b de Kendall y Wilcoxon debido a que los resultados obtenidos no presentaron una distribución normal. RESULTADOS Para el cumplimiento de los objetivos propuestos, las cepas de FA 17D y 287-78 fueron inoculadas en la línea celular C6/36, incubadas a 28°C y observadas hasta el décimo día, período en el cual fueron cosechadas Durante los 10 días de observación no se diferenció efecto citopático, pero se confirmó la presencia del virus mediante IFI con el empleo de anticuerpos monoclonales específicos, obteniendo para la cepa 287-78 CRL-12 con pasaje C6/36-3 una inmunofluorescencia de 4+ y para la cepa 17D-V3 pasaje C6/36-1, 3+ (recordemos que 4+ en IFI representa 100% de positividad en un campo de inmunofluorescencia celular y 3+ un 75%). Cabe mencionar que en los pasajes anteriores, C6/36-1 y C6/36-2 para la cepa 287-78 CRL-12 tuvieron como resultado de IFI 2+ y 3+, respectivamente. DETERMINACIÓN DEL TÍTULO VIRAL POR PLAQUEO Para el desarrollo de la titulación viral por placas de las cepas de FA 17D V3-C6/36-1 y 287-78 CRL-1 2-C6/36-3 se ensayaron diferentes técnicas: una bajo capa de agar o método sólido descrito por Dulbecco y Vogt 10, el cual no ofreció resultados apreciables para ninguna de las cepas; y el método semi-líquido descrito por Morens 7, el cual ofreció mejores resultados. En este método se obtuvo que el momento óptimo de coloración de las placas fue el séptimo día. Una vez determinado el día óptimo de coloración de la metodología adecuada, se procesaron las cepas de FA, obteniéndose los siguientes títulos virales: FA 17D-V3-C6/36-1 de 10 3,7 UFP/mL, FA 287-78 C RL-12-C6/36-2 de 103,9 UFP/mL y FA 287-78 CRL-12-C6/36-3 de 10 4,1 UFP/mL. A su vez, se determinó la dilución de trabajo a ser usado en el PRNT en los valores de 1:5 para la cepa 17D-V3-C6/36-1 y 1:13 para la cepa 287-78 CRL-12-C6/36-3; en éstas, se observaron placas homogéneas sin superposiciones, las cuáles fueron contadas en número promedio de 20 al ser mezcladas con los sueros problema y en las diluciones de respaldo (controles de infectividad viral o plaqueo) (Ver Figuras N° 1 y N° 2).
3
donde:
X cel. :promedio de células contadas con ayuda de la cámara de Neubauer.
10 :volumen del medio de crecimiento adicionado al frasco con células.
20 : constante obtenida a razón de los volúmenes usados en el inóculo.
(N° de placas de la dilución de respaldo)
MORFOLOGÍA Y TAMAÑO DE LAS PLACAS
Para la cepa 17D-V3-C6/36-1 se observaron placas pequeñas regularmente esféricas y de diámetro aproximado 0,5 mm, mientras que para la cepa 287-78 CRL-12-C6/36-3 las placas formadas fueron mixtas (pequeñas y grandes) variando entre 0,5-1 mm de diámetro, todas esféricas con borde difuso. En ambos casos, las placas fueron neutralizadas en el mismo grado por el suero hiperimmune (HMAF) para FA y el suero control positivo.
PRNT PARA FA
De las 96 muestras séricas humanas empleadas en el estudio, 67 (69,8%) fueron positivos a PRNT al 70% para la cepa 17D-V3-C6/36-1 y 79 (82,3%) positivos para la cepa 287-78 CRL-12-C6/36-3, con títulos que variaron desde las diluciones de 1:10 hasta >1:2560. La Figura N° 3 muestra los resultados obtenidos en concordancia para ambas cepas, donde 72 muestras fueron positivas para las cepas 17D y 287-78 y 16 fueron negativas a ambas.
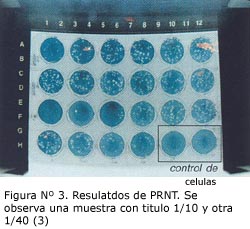
Entre las muestras discordantes, una no fue captada para la cepa 287-78, siendo ésta positiva para la cepa 17D; el porcentaje de reducción de ésta (muestra 37) fue 67% para la cepa 287-78 y 80% para la cepa 17D, siendo considerada en este caso como positiva, de acuerdo al criterio tornado (PRNT al 70%) (Tabla N° 2).
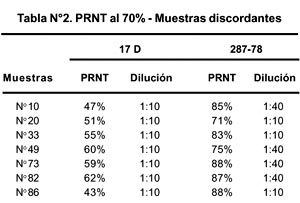
De las 7 muestras positivas para la cepa 287-78 y negativas para la cepa 17D (muestras 10, 20, 33, 49, 73, 82 y 86) se observaron diferencias no significativas en porcentaje de reducción en relación a ambas cepas. En relación a los títulos hallados, se observaron diferencias marcadas para ambas cepas como se muestra en la Tabla N° 3.
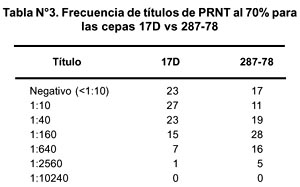
Utilizando el análisis de Tau-b de Kendall, se obtuvo un coeficiente de correlación de 0,647 para ambas cepas y con la prueba de Wilcoxon un p = 0,02, lo que indica que existen diferencias en cuanto a la capacidad neutralizante de los sueros con relación a cada cepa.
Tomando en cuenta los criterios de selección de muestras (ver Tabla N° 1), se obtuvieron resultados con cierta variabilidad. Estos resultados se muestran en la Tabla N° 4.
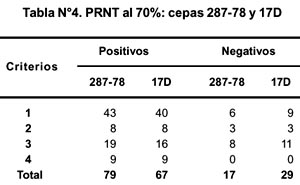
Las muestras agrupadas en vacunados (20) y no vacunados (76) (datos obtenidos de una ficha epidemiológica) mostraron una ligera diferencia en sus títulos de PRNT, encontrando variación en cuanto a la reacción de anticuerpos para ambas cepas sólo en los no vacunados (p<0,01).
La sensibilidad y especificidad de la prueba de PRNT fue corroborada al ser enfrentada con los sueros controles e hiperinmunes, dando resultados positivos con los de FA y negativos con los de Dengue.
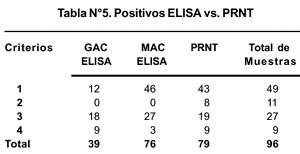
Finalmente, se evaluó la relación entre el PRNT y ELISA (MAC y GAC ELISA), donde se pudo determinar que el ELISA es una prueba menos sensible para el diagnóstico de FA (Tabla Nº 5). En ambos casos se empleó la cepa 287-78 como antígeno viral.
DISCUSIÓN
El virus de FA se replica en diferentes líneas celulares, siendo las más empleadas VERO y C6/36 9,11-14. Méndez 11 reporta que los primeros aislamientos del virus de la FA en el Perú se hicieron en la línea celular C6/36, observando efecto citopático entre los 6 y 8 días; debemos mencionar que dentro de éste grupo figura la cepa 287-78, la que fue mantenida en pasajes sucesivos en cerebro de ratón lactante. El presente trabajo describió en su primera parte la producción del stock de semillas virales de FA en células C6/36 para la cepa 17D a partir del tercer pasaje en células VERO (17D-V3) y la cepa 287-78 a partir del décimo segundo pasaje en cerebro de ratón lactante (287-78 CRL-12). Cabe resaltar que para ambos casos no se observó efecto citopático. Sin embargo, se pudo asegurar la replicación viral en C6/36, aún cuando no hubo efecto citopático por la prueba de inmunofluorescencia y por la prueba de plaqueo, utilizando la línea celular VERO 15.
La técnica de plaqueo, neutralización y el uso de diferentes líneas celulares fueron usadas por diferentes autores. Alvarez 9, usó el método semi-líquido descrito por Morens 7 en células BHK-21; Barry 14, empleó la técnica bajo capa de agarosa modificado en células VERO; y Méndez 11, usó la técnica bajo capa de agarosa en células LLCMK 2. En el presente trabajo se utilizaron dos métodos: bajo capa de agarosa y semi-líquido utilizando células VERO, siendo ésta última la que ofreció buenos resultados en cuanto a formación de placas. Para los trabajos de plaqueo, el período de incubación para su coloración fue de 4 a 5 días 9-16, mientras que en el método estandarizado, el tiempo de coloración óptimo fue 7 días. Además se encontró que en relación de un pasaje a otro, el incremento en el título fue 103,65 UFP/mL para las cepas 287-78 CRL-12-C6/36-2 y C6/36-3, representando un incremento del 50% en relación al pasaje anterior.
Sobre la morfología y tamaño de las placas, se encontraron diferencias entre 17D y 287-78, debido probablemente al origen y mantenimiento de ambas cepas, dado que una de ellas fue atenuada (17D) y la otra silvestre (287-78) mantenida en cerebro de ratón lactante. Muchas cepas silvestres causan placas de tamaño y morfología variable 7.
La interpretación de las pruebas serológicas en infecciones por FA en las diferentes áreas puede algunas veces resultar difícil, debido a la falta de datos reales en la ficha epidemiológica 17 y/o a la dificultad de obtener una segunda muestra del paciente por diferentes motivos. Debemos considerar que la mayoría de las muestras del estudio fueron tomadas en promedio después del segundo día de iniciado la enfermedad, presentando muchos títulos de PRNT cercanos a 1:10, donde los anticuerpos neutralizantes aún están en formación 5, según reporta Morens 7, además que el título de anticuerpos se incrementa conforme aumenta el tiempo de enfermedad. En nuestro caso, se obtuvieron títulos de anticuerpos superiores a 1:160 después de los 30 días de enfermedad. Para las muestras con antecedente vacunal y diagnóstico positivo a FA, los títulos de anticuerpos fueron más elevados y para las muestras que no refirieron antecedente vacunal los títulos fueron variados (17D: <1:10 hasta >1:640 y 287-78: <1:10 hasta >1:2560).
De acuerdo a los resultados obtenidos, podemos observar que la cepa 287-78 fue más susceptible a ser neutralizada que la 17D, pues encontramos un número heterogéneo en los títulos de PRNT hallados en relación a ambas cepas. Debemos mencionar además que las reacciones de neutralización detectan anticuerpos dirigidos contra antígenos superficiales de los virus (glicoproteínas de envoltura o antígenos de la cápside). Estos anticuerpos son tipo-especifico, por lo que permiten determinar el subtipo viral causante de la enfermedad 18.
Las muestras analizadas de acuerdo a los criterios de inclusión procedieron de diferentes departamentos (zonas) del país. Para el criterio 1 (zonas de centro y sur del país), los resultados muestran que hay variabilidad en relación a títulos de PRNT en ambas cepas; para el criterio 2 (zonas del oriente), se observó una diferencia no significativa en relación a títulos de PRNT para ambas cepas; para el criterio 3 (zonas del oriente y norte), las muestras presentaron diferencias en porcentajes de reducción en placas y en títulos para ambas cepas, resultado que puede ser explicado por un posible contacto con algún brote epidémico o que hayan tenido el antecedente de vacunación y que no figuró en su ficha clínica epidemiológica; y para el criterio 4 (zonas del centro), se encontraron resultados positivos con títulos altos, pero con diferencias en cuanto al comportamiento inmunológico para ambas cepas.
Indudablemente, la respuesta humoral juega un importante papel en la inmunidad a la FA adquirida previamente en forma natural, por exposición a parientes antigénicos cercanos al virus amarílico en áreas de transmisión, lo cual da origen a casos inaparentes de la enfermedad, cuyo diagnóstico clínico es difícil de determinar 4.
Finalmente, podemos mencionar que el GAC ELISA tiene menor capacidad para detectar anticuerpos cuando observamos el criterio 2 (muestras con diagnóstico negativo a FA y Dengue, con antecedentes vacunal) donde encontramos que de las 11 muestras, 8 fueron positivos para PRNT, mientras que para GAC ELISA todos fueron negativos. Para los otros criterios, podemos asumir que los anticuerpos de tipo IgM cumplen un rol importante en los procesos de neutralización, coincidiendo con los de Morens y la Organización Mundial de la Salud, tal como se observan en los resultados por PRNT 5,7.
Los resultados obtenidos nos permiten contar con una metodología útil en el diagnóstico serológico de FA y otras arbovirosis frecuentes en nuestro país.
REFERENCIAS
1. Cabezas C. Fiebre Amarilla en el Perú. Boletín de Enfermedades Infecciosas y Tropicales 1995; 4(1): 3. [ Links ]
2. Cabezas C. Fiebre Amarilla en el Perú y riesgo de urbanización. En: Libro de Resúmenes del Curso Internacional de Enfermedades Virales Emergentes. Lima: INS, Universidad de Texas-USA, NAMRID; 1997. p. 33-4. [ Links ]
3. Instituto Nacional de Salud. Reunión de Expertos. Prevención y control de la Fiebre Amarilla y riesgo de urbanización. 14-15 Mayo 1998. Cusco, Perú; 1998. [ Links ]
4. Neyra RJ, Sipán TF. La Fiebre amarilla, pasado y presente en el Perú. Rev Diagnóstico 1983; 12(3): 86-96. [ Links ]
5. World Health Organization. The inmunological basis for inmunization. Geneva: WHO; 1993. Series Module 8: Yellow fever. p. 1-14. [ Links ]
6. Meegan JM. Yellow fever vaccine. Expanded programme on immunization. Geneva: WHO; 1991. p. 1-11. [ Links ]
7. Morens D, Halstead S, Repik P, Putvatana R, Raybourne N. Simplified plaque reduction neutralization assay for Dengue viruses by semimicro methods in BHK-21 cells: comparison of the BHK suspension test with standard plaque reduction neutralization. J Clin Microbiol 1985; volumen: 250-4. [ Links ]
8. Instituto Nacional de Salud. Manual de procedimientos de laboratorio para el diagnóstico de Arbovirosis. Lima: INS; 1996. Serie de Normas Técnicas N° 16. [ Links ]
9. Alvarez V, Valdéz P, Vásquez RS, Delgado HI, García IS, Morier DL, et al. Normalización de la técnica de reducción de placas para diferenciar una infección por Dengue de una infección por Fiebre Amarilla. Rev Cub Med Trop 1998; 50(3): 177-81. [ Links ]
10. Lennette E. Pruebas serológicas en las infecciones por virus y rickettsias. En: Muñoz ME, Oriol AA, Sosa MJ. Diagnóstico y tratamiento de las enfermedades por virus y rickettsias. Madrid-España: Editorial Interamericana; 1965. p. 188-98. [ Links ]
11. Méndez M, Calisher CH, Kruger H, Sipán F, Sánchez S, Lazuick J. Foco permanente de Fiebre Amarilla en el valle del río Apurímac, Ayacucho, Perú y primer aislamiento del virus de la Fiebre Amarilla en ese país. Bol Of Sanit Panam 1984; 97(3): 215-23. [ Links ]
12. Nassar ES, Chamelet BE, Coimbra M, Souza ML, Suzuki A, Ferreira BY, et al. Jungle Yellow Fever: clinical and laboratorial studies emphasizing viremia on a human case. Rev Inst Trop Sao Paulo 1995; 37(4): 337-41. [ Links ]
13. Nogueira R, Schatzmayr H, Miagostovich M, Cavalcanti S, Carvalho R. Use of MAC-ELISA for evaluation of Yellow Fever vaccination. Rev Inst Med Trop Sao Paulo 1992; 34(5): 447-50. [ Links ]
14. Barry M, Patterson J, Tirrell S, Cullen M, Shope R. The effect of chloroquine prophylaxis on Yellow Fever vaccine antibody response: comparison of plaque reduction neutralization test and enzyme-linked immunosorbent assay. Am J Trop Med Hyg 1991; 44(1): 79-82. [ Links ]
15. Burleson GF, Chambers MT, Wiedbrauk LID. Techniques for assessing antiviral agents. In: Virology. A laboratory manual. Academic Press, INC; 1992. p. 8-42, 72-84, 152-6. [ Links ]
16. Barry B, Calisher CH, Shope R. Arboviruses. In: Diagnostic procedures for viral, rickettsial and chlamydial infections. USA: American Public Health Association (APHA). Publication INC; 1989:797-855. [ Links ]
17. Autores. DOF 1999. NOM-168-SSA-1998. Actualización correspondiente a expediente clínico (Fecha de acceso: noviembre 2000). URL disponible en: http://www.mazatlan.com.mx/medicalegal/index4.htm. [ Links ]
18. Carballal G, Oubiña J. Virología médica. 2° edición. Lima: Editorial El Ateneo; 1996. [ Links ]
Correspondencia: María Paquita García Mendoza. División de Virología. instituto Nacional de Salud. Calle Cápac Yupanqui 1400, Lima 11-Perú.
Telf: (51-1)4719920. Fax.: (51-1) 4710179.
E-mail: pgarcía@ins.sld.pe















