Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Medicina Experimental y Salud Publica
versión impresa ISSN 1726-4634
Rev. perú. med. exp. salud publica v.18 n.3-4 Lima jul./dic. 2001
TRABAJOS ORIGINALES
Validación de sustratos atractivos a oviposición para la detección de Aedes Aegypti
Pablo Villaseca C 1; Walter León C 1; Miriam Palomino S 1; Rosa Mostorino E 2; Leonid Lecca G 3.
1 División de Entomología, Centro Nacional de Salud Pública, Instituto Nacional de Salud.
2 Dirección Ejecutiva de la Red de Laboratorios, Centro Nacional de Salud Pública, Instituto Nacional de Salud.
3 Instituto Nacional de Salud.
RESUMEN
Objetivo: Comparar tres tipos de atrayentes a oviposición para la detección de Aedes aegypti (agua local, infusión de pasto Stenotaphrum secundatum y solución acuosa de propionato de metilo al 0,5%) en tres ciudades endémicas de Dengue del Perú. Materiales y métodos: Entre Setiembre y Octubre del 2001 se realizó un muestreo dirigido en viviendas de localidades de las provincias de Tarapoto (departamento San Martín), Satipo (Junín) y Tumbes (Tumbes) en base al antecedente de haber presentado, un caso confirmado de dengue o la presencia de pupas y larvas de Ae. aegypti a la inspección. En cada vivienda se colocaron 4 ovitrampas (con las 3 soluciones y una solución control: agua mineral) y se observaron por 3 días consecutivos, inspeccionándolas cada 24 horas. Para el análisis se empleó el test de rango múltiple de Duncan y la prueba de Dunnett, siendo significativo un p<0,05. Resultados: De 248 ovitrampas instaladas (88 en Tarapoto, 88 en Satipo y 72 en Tumbes) en 62 lugares, resultaron positivas 13,7%. El promedio global de huevos por ovitrampa. fue 8,02 (rango: 0-131) y se encontró que el promedio de huevos en la infusión de pasto fue mayor al encontrado en las otras soluciones (p<0,05). Conclusión: La infusión de pasto resultó la más efectiva sustancia atrayente en las ovitrampas empleadas para detectar Ae. aegypti.
Palabras clave: Aedes; Oviposición; Insectos vectores; Perú (fuente: BIREME).
ABSTRACT
Objective: To compare three types of oviposition baits (local water, Stenotaphrum secundatum solution and 0.5%-methyl propionate solution) for the detection of Aedes aegypti in three Dengue endemic cities in Peru. Materials and methods: Based upon one confirmed Dengue case and in the occurrence of Aedes pupae and larvae, a selective sampling of houses in Tarapoto (San Martfn), Satipo (Junin) and Tumbes (Tumbes) was performed between September and October, 2001. Four traps (containing the three solutions, as well as a control solution: mineral water) were placed in each house and observed for a 3-day period, being supervised every 24 hours. The Duncan Multiple Test and the Dunnet Test (significance level, p < 0,05) were used to perform the analysis. Results: Of 248 traps placed (88 in Tarapoto, 88 in Satipo and 72 in Tumbes) in 62 houses, 13.7% were positive. The average egg content for each trap was 8,02 (range: 0-131) and the average egg content found in the vegetable infusion was higher than those met in the other solutions (p<0,05). Conclusion: The vegetable infusion is the most effective trap bait used for detection of Aedes aegypti.
Key words: Aedes; Oviposition; Insect vectors; Peru (source: BIREME).
INTRODUCCIÓN
El Aedes aegypties el vector principal de la enfermedad producida por el virus Dengue. Su reinfestación en nuestro país data desde 1984 y, desde entonces, este vector se ha distribuido a lo largo del territorio nacional, encontrándose hasta el año 2000 en 15 departamentos y 110 distritos.
Ante este problema, dentro de la política de control del dengue, se desarrolla una vigilancia. entomológica en diferentes departamentos del país, teniendo como una de sus principales tareas la búsqueda del mosquito (Ae. aegypti) en su fase larvaria en las viviendas de las localidades.
Para realizar esta actividad se requiere gran cantidad de recursos humanos, por lo que se buscan otras alternativas do detección del vector, utilizando sitios de oviposición artificial u "ovitrampas"1, que son más sensibles y efectivas que la encuesta aédica, tal como lo refiere Barata2.
Las ovitrampas se fundamentan en la predilección del mosquito por depositar sus huevos en la zona húmeda, cerca de la interfase con el líquido1. Generalmente, estas ovitrampas son utilizadas en el campo por varios días, aunque en algunas regiones han sido incorporadas en la vigilancia cotidiana, observándose que, si bien el número de trampas que reciben huevos y el número de huevos por trampa son bajos, ello depende de la estación en que se realiza la recolección3.
Desde que Buxton y Hopkins, en 1927, refirieron que las infusiones de materias vegetales atraían un mayor número de mosquitos hembras y por ende mayor cantidad de huevos depositados, diversos investigadores han venido empleando tales soluciones como "atrayentes" para mejorar la efectividad de las ovitrampas 4-6. Por ejemplo, Reiter utilizando ovitrampas con infusión de heno concentrada y con una solución al 10%, encontró 8 veces más huevos en aquellas que en las ovitrampas que contenían agua o propionato de metilo al 0,5% 7.
En nuestro país, ante la necesidad de contar con un monitoreo efectivo del mosquito Ae. aegypti, se realizó la presente investigación en áreas endémicas del vector, con el objetivo de comparar tres tipos de atrayentes a oviposición: agua local, solución de pasto Stenotaphrum secundatum y solución acuosa de propionato de metilo al 0,5%. Se incluye esta última solución debido a que existen reportes de laboratorio que afirman que mejoran la oviposición 8-9.
MATERIALES Y MÉTODOS
Estudio cuasiexperimental, realizado durante los meses de setiembre y octubre del 2001, en las ciudades de Tarapoto (departamento San Martín), Satipo (Junín) y Tumbes (Tumbes). En estas tres ciudades, el dengue es una enfermedad endémica y estacional, habiendo presentado en el segundo trimestre del 2001 índices aédicos >5.
Las localidades o sectores periurbanos fueron escogidos de manera dirigida, según la información proporcionada por el personal de Entomología de las Direcciones Regionales de Salud basándose en la presencia de un índice aédico >5 y de casos confirmados de dengue, Así, se escogieron en Tarapoto y Satipo 4 y 9 sectores periurbanos, respectivamente; en tanto que en Tumbes se escogieron 5 localidades (Aguas Verdes, Zarumilla, Tumbes, Caleta Grau y Caleta La Cruz). La selección de las viviendas también fue de manera dirigida, según el antecedente de presentar en la vivienda un caso confirmado de dengue en los últimos seis meses o de presentar al momento de la inspección domiciliaria pupas y larvas de Ae. aegypti.
Las ovitrampas fueron preparadas en el Instituto Nacional de Salud (Lima-Perú) y consistían en contenedores de vidrio de color ámbar, de 9,2 cm de diámetro por 12,5 cm de alto, dentro del cual se colocó una faja de papel kraft de 28 cm de largo por 6 cm de alto; igualmente y en forma cruzada, se colocó una paleta de cartón de 10 cm de largo por 3,5 cm de ancho, de tal manera que al añadir la solución atrayente, parte del papel y la paleta quedaban sumergidos y humedecidos (Figura N° 1).

Se emplearon tres tipos de soluciones atrayentes:
Ovitrampa con solución 1: con 250 mL de agua local, estancada por 7 días.
Ovitrampa con solución 2: con 250 mL de agua local conteniendo pasto (Stenotaphrum secundatum), estancada por 7 días (9 g de pasto para 2 L de agua).
Ovitrampa con solución 3: con 250 mL de agua local más 1,25 mL de propionato de metilo para lograr una solución al 0,5%.
Además, se utilizaron ovitrampas con solución control (solución 0): con 250 mL de agua mineral.
PROCEDIMIENTO DE RECOLECCIÓN
En cada sitio escogido se colocaron 4 ovitrampas, con las soluciones control y atrayentes (soluciones 1, 2 y 3). Estas fueron observadas por 3 días consecutivos, cada 24 horas, teniendo en cuenta que en el caso de ser positiva solo se cambiaba la paleta y el papel kraft que recubría la parte interna de la ovitrampa, manteniéndose la solución 3,10.
El papel y la paleta de los ovitrampas positivas fueron introducidos en una bolsa plástica de manera individual y transportadas inmediatamente al laboratorio donde se realizó la contabilidad de los huevos de Ae. Aegypti; para ello se empleó un microscopio esteroscopio binocular a 35x.
ANÁLISIS ESTADÍSTICO
Para el análisis de resultados se utilizó el programa SPSS 10,0. Se empleó el test de rango múltiple de Duncan y la prueba de Dunnett para evaluar las diferencias entre ovitrampas, considerándose como significativo un p<0,05.
RESULTADOS
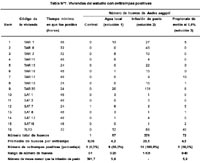
En total se instalaron 248 ovitrampas (88 en Tarapoto, 88 en Satipo y 72 en Tumbes) en 62 lugares. Resultaron positivas 13,7%(34/248) de las ovitrampas, distribuidas en 25,8% (16/62) de las viviendas (Tabla N°1).
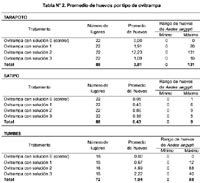
En Tarapoto se encontró que 40,9% (9/22) de los lugares presentaron ovitrampas positivas, totalizando 17 ovitrampas positivas y 335 huevos. Además, se encontró que el promedio de huevos en el agua de pasto (solución 2) fue mayor al de las otras soluciones (p<0,05). En Satipo, se encontró que 27,2% (6/22) de las viviendas presentaron ovitrampas positivas, totalizando 14 ovitrampas positivas y 41 huevos; y en Tumbes se encontró que sólo una vivienda (de 18) tuvo 3 ovitrampas positivas, totalizando 140 huevos. En estas dos últimas ciudades no se encontraron diferencias significativas en el número de huevos depositados entre las diferentes soluciones probadas. El promedio de huevos obtenidos en cada solución de las ciudades del estudio se presenta en la Tabla N° 2.
Cuando se evaluaron sólo las 34 ovitrampas positivas, se encontró que el promedio de huevos en la infusión de pasto (solución 2) fue significativamente mayor al encontrado en las otras soluciones (p<0,05). En la Tabla N° 3 se muestra el promedio de huevos presente en las ovitrampas positivas.
DISCUSIÓN
Al investigar diferentes sustancias atrayentes de Ae. aegypti, encontramos que las ovitrampas con infusión de pasto estancada resultaron 5,6 y 5,2 veces mis efectiva que el agua local y la solución de propionato de metilo al 0,5%, respectivamente. Ello concuerda con lo reportado por Reiter 7 y con una investigación previa (no publicada) realizada por nuestro equipo de trabajo el año 2000 en Lima-Perú, al comparar dos sustancias atrayentes (solución de propionato de metilo al 0,5% e infusión de pasto concentrada), resultando ésta última 8,8 veces más efectiva. Asimismo, al comparar la sensibilidad en la atracción de las diferentes soluciones en las viviendas con ovitrampas positivas, encontramos que la infusión de pasto alcanzó 100% de positividad, muy superior a los porcentajes obtenidos con las soluciones de agua local y propionato de metilo al 0,5% (con 56% y 50% de positividad, respectivamente) (Ver Tabla N° 1).
El aumento del número de huevos en las ovitrampas con infusión de pasto estaría en relación a una atracción olfatoria del Ae. aegypti por esta sustancia 9, además que se ha comprobado que este atrayente contiene una excelente fuente de nutrición que favorece el crecimiento del estadío larvario del vector 11.
Comúnmente, los trabajos de campo realizados pueden dar la impresión que el Aedes prefiere hábitats con agua limpia para su reproducción, debido a que sus larvas son a menudo encontradas en recipientes con agua libre de material suspendido11; sin embargo, se ha demostrado que el agua limpia es un ambiente estéril para las larvas, mientras que la fauna microbiana de las infusiones de pasto contribuyen al crecimiento de las larvas. Por ejemplo, Barrera reportó la permanencia y competencia de estos mosquitos en floreros de cementerios 12. E incluso, existen pruebas de laboratorio que demuestran que la presencia de actividad microbiana es un indicador de la oviposición, ya que muestran que el recipiente todavía no está lleno de larvas competentes 13. Además, existen estudios que reportan la presencia de flora bacteriana dentro del tracto digestivo de las larvas, reconociéndose especies de Aeromonas, Escherichia coli y Tatunella 14.
Las ventajas del uso de las ovitrampas en la vigilancia entomológica del vector causante del dengue radica en su buena sensibilidad (detectan el vector en bajas densidades) y practicidad: en un área urbana, dos operadores pueden instalar en sólo una mañana 80 ovitrampas, sin dificultad. Ello, en contraste por ejemplo a la inspección larval y la colecta de mosquitos por el método de aspiración, el cual requiere gran laboriosidad, habilidad y continuo entrenamiento 4.
En nuestro estudio, encontramos sólo 13,7% de ovitrampas positivas, lo que puede atribuirse a la época en que se desarrolló la recolección vectorial (setiembre y octubre) y, como sabemos, las densidades de Ae. aegypti son mayores durante la estación lluviosa (entre diciembre y abril).
Con los resultados obtenidos en el presente estudio, sugerimos emplear la infusión de pasto como atrayente de las ovitrampas en las localidades donde se desea investigar la presencia de Ae. aegypti. Con su utilización, se estaría facilitando la detección de este vector dentro de un sistema de vigilancia en forma precoz y que permitirá tomar acciones de prevención y control en forma oportuna.
AGRADECIMIENTO
Al Dr. Oscar Tovar por la identificación de la especie de pasto (gramínea) utilizada en la infusión, al Técnico agropecuario Oseas Sifuentes Mendoza por proporcionamos el pasto, a la Lic. Nancy Linares por su colaboración en el análisis estadístico, y al Dr. César Cabezas por su colaboración en la revisión del manuscrito. Al personal de la DISA San Martín: Blgo. Elty López y Téc. Juan Ruiz; de la DISA Junín: Lic. Lucia Villar, Téc. Miguel Granza, Téc. Eugenio Francisco, Téc. Miguel Mamerto Zambache y Téc. Walter Torres; y de la DISA Tumbes: Téc. Víctor Herrera, Téc. Percy Purizaga, Téc. Antonio Ríos, Téc. William Sandoval, Téc. Carlos Rivas, Téc. Ricardo Gamboa y Téc. Ricardo Alva.
REFERENCIAS
1. Service MW. Mosquito ecology: field sampling methods. New York: John Wiley and Sons; 1976. [ Links ]
2. Barata EA, Da Costa Al, Chiaravalloti F, Glasser CM Barata JMS, Natal D. Población de Aedes aegypti en área endémica de dengue, Sudeste del Brasil. Rev Saude Publica 2001; 35: 237-42. [ Links ]
3. Chadde DD, Corbet PS. Seasonal incidence and diel patterns of oviposition in the field of the mosquito, Aedes aegypti (L.) (Diptera:Culicidae) in Trinidad, West Indies: a preliminary study. Ann Trop Med Parasitol 1987; 81: 151-61. [ Links ]
4. Bettie VF. The physico-chernical factors of water in relation to mosquitoes breeding in Trinidad. Bull Entomol Res 1932; 23: 477-96. [ Links ]
5. Frank JH, Lynn HC. Standarizing oviposition traps for Aedes aegypti and Culex quinquelasciatus: time and medium. J Fla Anti-Mosq Assoc 1982; 53: 22-7. [ Links ]
6. Kitron UD, Webb DW, Novak RJ. Oviposition behavior of Aedes triseriatus (Diptera: Culicidae): prevalence, intensity ad agregation of eggs in oviposition traps. J Med Entomol 1989; 26: 462-7. [ Links ]
7. Reiter P, Amador M, Colon N. Enhancement of the CDC ovitrap with hay infusions for daily monitoring of Aedes aegypti populations. J Am Mosq Control Assoc 1991; 7(1): 52-5. [ Links ]
8. Fay RW, Perry AS. Laboratory studies of the ovipositional preference of Aedes aegypti. Mosq News 1965; 25: 276-81. [ Links ]
9. Klowden MJ, Blackmer JL. Humoral control of pre-oviposition behavior in the mosquito, Aedes aegypti. J Insect Physiol 1987; 33: 689-92. [ Links ]
10. Haddow AJ, Gilleett JD. Observations on the oviposition cycle of Aedes (Stegomyia) aegypti (Linnaeus). Ann Med Parasitol 1957; 51: 159-69. [ Links ]
11. Riviere F. Effects of two predators on community composition and biological control of Aedes aegypti and Aedes polynesiensis. In: Lounibos LP, Rey JR, Frank JH (eds.). Ecology of mosquitoes: proceedings of a workshop. Florida: Florida Medical Entomology Laboratory; 1985. p. 121-43. [ Links ]
12. Barrera R. Coexistencia de 3 especies de mosquitos. Boletín de la Dirección de Malariología y Saneamiento ambiental 1990; 30 (1): 95. [ Links ]
13. Benzon GIL, Apperson CS. Reexamination of chemically mediated oviposition behavior in Aedes aegypti (L.) (Diptera: Culicidae). J Med Entomol 1988; 25:158-64. [ Links ]
14. Ulloa A, Rodríguez MH. Larval production and potential food sources of Aedes aegypti in various containers. J Am Mosq Control Assoc 1996; 12 (3): 465. [ Links ]
Correspondencia: Pablo Villaseca Campos.
División de Entomología, Instituto Nacional de Salud.
Calle Cápac Yupanqui 1400, Lima 11 Perú.
Telf: (51-1)4719920-Fax: (51-1) 4710179.
E-mail: entomo@ins.sld.pe